小鼠嗜肺巴斯德杆菌检测方法优化及感染小鼠的药物净化
张 韬,崔 璨,马贯中,张爱华
(1.南京医科大学医药实验动物中心,南京211166;2.上海南方模式生物科技股份有限公司,上海200120)
嗜肺巴斯德杆菌(Pasteurella pneumotropica)属于巴斯德菌科巴斯德菌属,为革兰阴性短杆或球杆菌[1]。嗜肺巴斯德杆菌是条件性致病菌,多数动物感染后无任何临床症状,但在动物免疫机制受到抑制和应激因子的作用下,容易发生呼吸道疾病,还可与仙台病毒、肺支原体等呼吸道病原微生物合并感染[2],因而影响实验动物质量;而且使用隐性感染的小鼠进行动物实验,也会对实验结果产生严重干扰[3]。
由于嗜肺巴斯德杆菌对外界理化因素抵抗力不强,生长条件相对苛刻,在检测中与其他细菌涂布于同一培养基上同时培养时为弱势菌落,故传统的血琼脂平皿直接分离培养法易造成漏检[4]。因此,优化嗜肺巴斯德杆菌检测方法以提高检测敏感度,可避免检测假阴性的发生。目前,针对嗜肺巴斯德杆菌感染,最有效的清除方式是剖宫产和胚胎移植。然而这两种方法耗时且费用昂贵,不适用于饲养量大、品系多的设施[3]。因此,需要建立一种应急情况下快速去除嗜肺巴斯德杆菌的药物净化方案。
本研究评价了直接涂板法和改良增菌法对嗜肺巴斯德杆菌的检出情况,并对本地分离出的嗜肺巴斯德杆菌进行了抗生素敏感性测试;然后用该菌株感染小鼠后隔离饲养,进一步进行药物安全性和净化效果分析。本研究旨在优化嗜肺巴斯德杆菌检测方法,提高检测敏感性,以强化嗜肺巴斯德杆菌的日常监测,并对嗜肺巴斯德杆菌感染小鼠的药物净化方案进行探讨。
1 材料与方法
1.1 实验动物
评价检测方法时,选取某设施实验用小鼠152只。
药物安全性评价用SPF级C57BL/6小鼠48只,雌性,7~8周龄。药物净化效果评价用SPF级C57BL/6小鼠80只,雌性,16~17周龄。以上实验小鼠均购自南京医科大学医药实验动物中心[SCXK(苏)2016-0002],饲养于南京医科大学医药实验动物中心[SYXK(苏)2015-0015]。动物饲养条件:室温(22±1)℃,相对湿度40%~70%,给予12 h昼夜光照循环,自由进水进食。实验过程中,药物净化效果评价的实验小鼠均在屏障设施内的独立房间内,以IVC笼具进行隔离饲养,笼器具等装置单独进行高压灭菌处理。动物实验经南京医科大学实验动物福利伦理委员会批准[IACUC-1701021]。
1.2 主要试剂和药品
脑心浸液培养基购自北京陆桥技术股份有限公司;哥伦比亚血琼脂培养基购自上海科玛嘉微生物技术有限公司;特级马血清购自南京贝斯特生物技术有限公司;PCR相关试剂购自南京诺唯赞生物科技股份有限公司;抗菌药物药敏纸片(包括头孢氨苄30μg/片、头孢西丁30μg/片、头孢噻吩30μg/片、头孢羟唑30μg/片、头孢克洛30μg/片、青霉素10U/片、四环素30μg/片、复方新诺明(磺胺甲噁唑/甲氧苄啶)23.75或1.25μg/片、丁胺卡那30μg/片、庆大霉素10μg/片、妥布霉素10μg/片、恩诺沙星10μg/片)购自杭州微生物试剂有限公司;微需氧产气袋购自日本Mitsubishi Gas Chemical公司;拜有利10%恩诺沙星注射液购自德国Bayer公司;三溴乙醇、叔戊醇购自美国Sigma公司。
1.3 菌株
本研究第一部分优化检测方法时,从待检小鼠咽拭子和气管中分离获得并检测确认为嗜肺巴斯德杆菌的菌株,收集后用于药敏实验和药物净化研究。
1.4 主要仪器
生物安全柜(BIOⅡAdvance 6)购自西班牙Telstar公司;生化培养箱(SPX-150BS-Ⅱ)购自上海新苗医疗器械制造有限公司;三目生物显微镜(CX31RTSF)购自日本Olympus公司;全波长酶标仪(Multiskan Spectrum)购自美国Thermo公司;NEW ATB自动细菌鉴定分析仪(IAF020480)购自法国BioMérieux公司;PCR仪(S1000)购自美国Bio-Rad公司;电泳仪购自上海天能科技有限公司。
1.5 嗜肺巴斯德杆菌检测方法优化
小鼠经三溴乙醇(250 mg/kg)腹腔注射麻醉,采集咽拭子后,安乐死小鼠,无菌解剖小鼠;采集气管内壁分泌物,涂布于血琼脂平皿,37℃培养18~24 h(直接涂板法)。然后截取0.5 cm气管组织,将咽拭子和气管组织一同放入增菌液(脑心浸液培养基+体积分数为5%的马血清)[5]中,37℃培养18~24 h(改良增菌法)。培养结束后,直接涂板法的血琼脂平皿按照国家标准[4]观察培养结果;增菌培养的菌液接种于血琼脂平皿,37℃分离培养18~24 h后观察培养结果。上述步骤中观察到的可疑菌落,均按国家标准[4]继续进行纯化,用梅里埃NEWATB自动化微生物鉴定分析系统以及16SrRNA通用引物PCR序列比对法[6]进行菌株鉴定。两种方法同时鉴定为嗜肺巴斯德杆菌者,判定为阳性。记录两种方法的检测结果,比较检出率。
1.6 抗生素敏感性测试
采用纸片扩散法,将嗜肺巴斯德杆菌菌株增菌过夜后,制成0.5麦氏菌悬液。将菌悬液均匀致密涂布于各血琼脂平皿表面,室温下放置15 min。然后将头孢氨苄、青霉素、恩诺沙星等12种抗菌药物药敏纸片分别平贴于已涂布菌液的各培养基表面,与微需氧产气袋一起置于密封袋中,37℃培养24 h,测量抑菌环直径并进行比较分析。
1.7 恩诺沙星饮水给药安全性实验
48只雌性C57BL/6小鼠随机分为6组,每组8只,饮水给药。实验组每天摄入恩诺沙星剂量分别为85、150、200、250和300 mg·kg-1·d-1,配制方法是将1.73、3.05、4.08、5.10和6.10 mL恩诺沙星原液分别溶于300 mL灭菌水。连续给药6周,对照组正常饮用灭菌水。每天观察小鼠状态,记录给药后2、6、24、48 h各组小鼠的异常表现和死亡情况。实验结束时,剖检各组实验动物,取肝、肾组织,用体积分数为10%的甲醛溶液固定标本,脱水,石蜡包埋,切片后行HE染色,用于组织病理学检查。
1.8 嗜肺巴斯德杆菌阳性鼠药物净化研究
制作1×107CFU/mL(菌落形成单位,colony forming unit)的嗜肺巴斯德杆菌菌液,以100μL/只的剂量对C57BL/6小鼠进行灌胃处理。1周后,采集咽拭子,将咽拭子放入增菌液中,按1.5节中改良增菌法进行嗜肺巴斯德杆菌检测。检测出嗜肺巴斯德杆菌阳性后,将小鼠分为实验组和对照组。实验组小鼠每天摄入的恩诺沙星剂量分别为50、85、150 mg·kg-1·d-1,连续给药2周后停药6周;对照组正常饮水。每个剂量组和对照组均4笼,每笼5只小鼠。其间每周以笼为单位,对笼内所有小鼠采集咽拭子,按1.5节中改良增菌法进行嗜肺巴斯德杆菌检测。这部分实验中,相关微生物和感染小鼠的实验操作均在生物安全柜内完成;实验结束后,对所有小鼠尸体以及实验废弃物等做高压灭菌处理。
1.9 统计学分析
采用SPSS 19.0统计学软件对各实验结果数据进行统计分析。检测方法优化实验结果分析采用Fisher精确概率法;血液生化指标结果以-±s表示,多组间比较先进行方差分析,然后组内两两比较采用LSD-t检验。以P<0.05认为差异有统计学意义。
2 结果
2.1 嗜肺巴斯德杆菌检测方法优化
对152只小鼠同时采用直接涂板法和改良增菌法进行嗜肺巴斯德杆菌检测。结果显示,直接涂板法只有极个别平板分离出可疑菌落(图1A),改良增菌法平板可疑菌落生长更具优势(图1B)。挑取可疑菌落分离培养后,该菌在血平皿上呈灰白色的光滑滴露样(图1C);染色后油镜下观察显示,该菌为两端钝圆的革兰阴性小杆菌(图1D)。然后经NEWATB微生物鉴定分析系统和16 SrRNA通用引物PCR序列比对法(图1E)鉴定,结果均证明是嗜肺巴斯德杆菌(相似度均≥99%)。
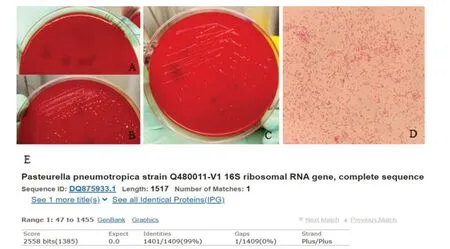
图1 直接涂板法(A)和改良增菌法(B)分离结果对比,以及菌落分离纯化后在血平皿上的菌落形态(C)、革兰染色镜检(D,×1 000)及PCR序列比对(E)结果Figure1 Results of isolation by routine procedure(A)and modified method(B),as well as the colony morphology on blood plateafter purification(C),microscopic result of Gram staining(D,×1 000)and sequencealignment(E)
最终,152只小鼠中一共检出嗜肺巴斯德杆菌阳性样品23份(对应23只小鼠)。其中,直接涂板法检出率为1.3%(2/152),改良增菌法检出率为15.1%(23/152)。经统计学分析,两者差异有统计学意义(P<0.05),提示改良增菌法优于直接涂板法。
将鉴定为嗜肺巴斯德杆菌的分离株进行冻存,用于后续的药敏实验和药物净化研究。
2.2 嗜肺巴斯德杆菌药敏试验
选用青霉素、四环素等12种常见抗生素对嗜肺巴斯德杆菌做药敏试验。结果显示,所试嗜肺巴斯德杆菌菌株对恩诺沙星、头孢西丁、头孢羟唑、头孢克洛、四环素、庆大霉素和妥布霉素敏感;对头孢噻吩、复方新诺明和丁胺卡纳中度敏感;对头孢氨苄和青霉素则具有耐药性(表1)。因此,选用恩诺沙星对小鼠进行后续药物净化研究。
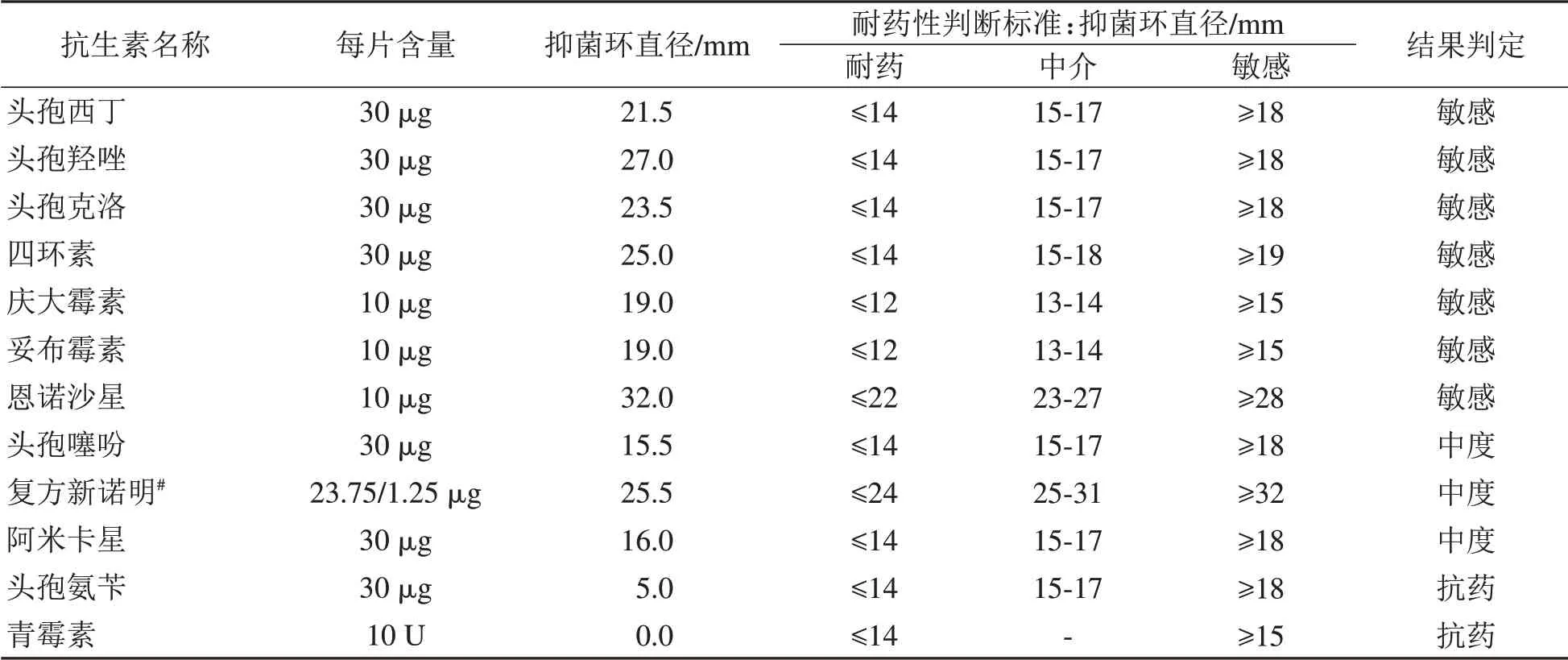
表1 嗜肺巴斯德杆菌菌株对12种抗生素的药敏试验结果Table1 Antimicrobial sensitivity test resultsof Pasteurella pneumotropica to 12 antibiotic
2.3 恩诺沙星饮水给药的安全性
恩诺沙星注射液配制成不同的质量浓度,对小鼠进行连续饮水给药,实验期内各剂量组小鼠饮食和精神均未见异常,未出现跛行、呕吐、腹痛、皮肤红斑瘙痒等异常反应或死亡,各时间点大体剖检也未见异常。HE染色结果(图2)显示,与对照组相比,实验组的肝、肾病理学检查均未见明显变化。实验组各剂量下的血液生化指标检测结果的平均值与对照组比较,肝功能相关的谷丙转氨酶(ALT)、总蛋白(TP)、白蛋白(ALB)和肾功能相关的血肌酐(CREA)的测量值较为一致,差异无统计学意义(P>0.05,表2);各剂量实验组的碱性磷酸酶(ALP)含量高于对照组(P<0.05),但仍在正常范围(118±15.9)[7-8];血尿素氮(BUN)和血尿酸(UA)水平均低于对照组(P<0.05),但没有明确提示意义。
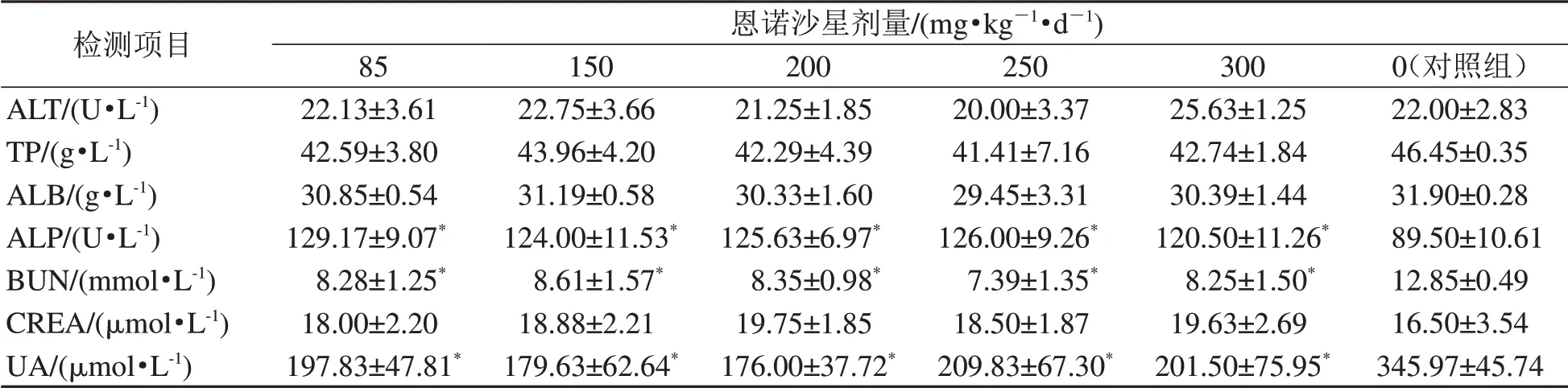
表2 恩诺沙星不同剂量组小鼠的血液生化指标Table2 Blood biochemical indexesin miceat different dosesof enrofloxacin
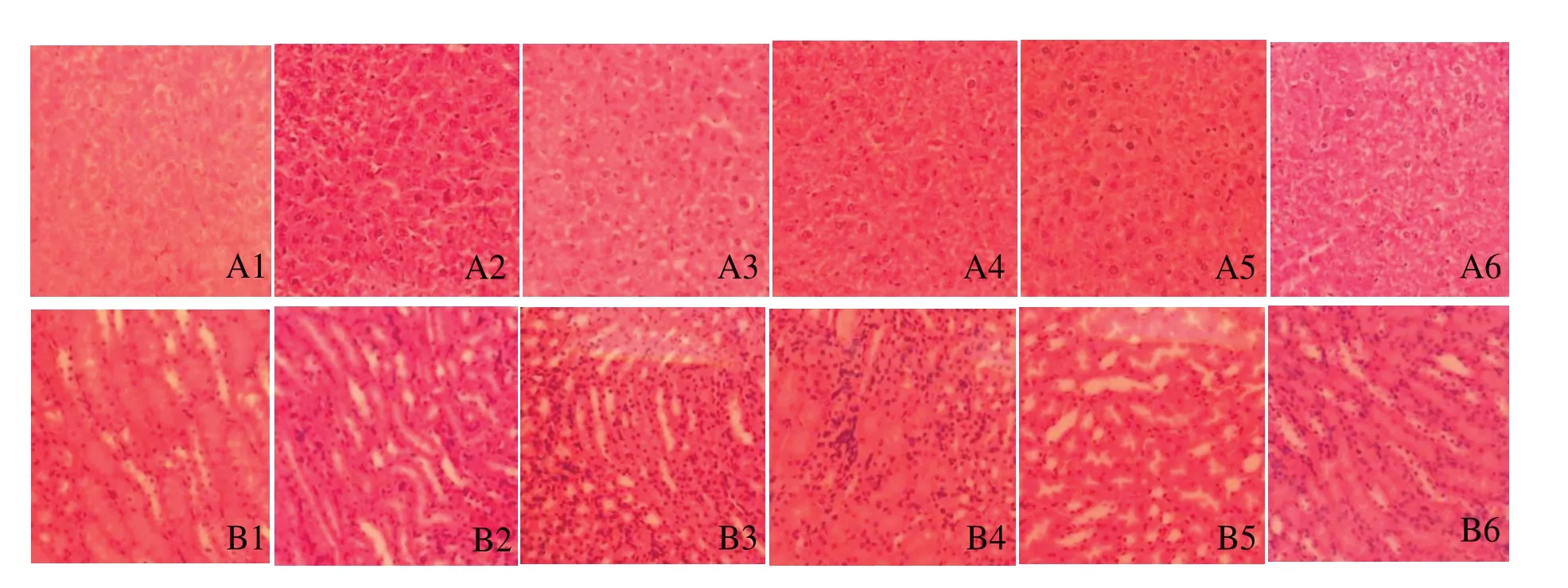
图2 各组小鼠肝脏(A)和肾脏(B)组织的病理学结果(HE染色,×400)Figure 2 Histological observation on liver(A)and kidney(B)in each group(HE staining,×400)
2.4 恩诺沙星的净化效果
综合文献[3,9~10]和安全性实验结果,通过设计3个剂量梯度(50 mg·kg-1·d-1、85 mg·kg-1·d-1、150 mg·kg-1·d-1)来测试恩诺沙星饮水给药的疗效,结果如表3所示。各剂量实验组给予恩诺沙星饮水给药1周后,嗜肺巴斯德杆菌阳性小鼠均转阴;50 mg·kg-1·d-1剂量组在停药第6周后,4笼中有2笼出现嗜肺巴斯德杆菌转阳;但85 mg·kg-1·d-1和150 mg·kg-1·d-1剂量组维持6周仍未转阳。
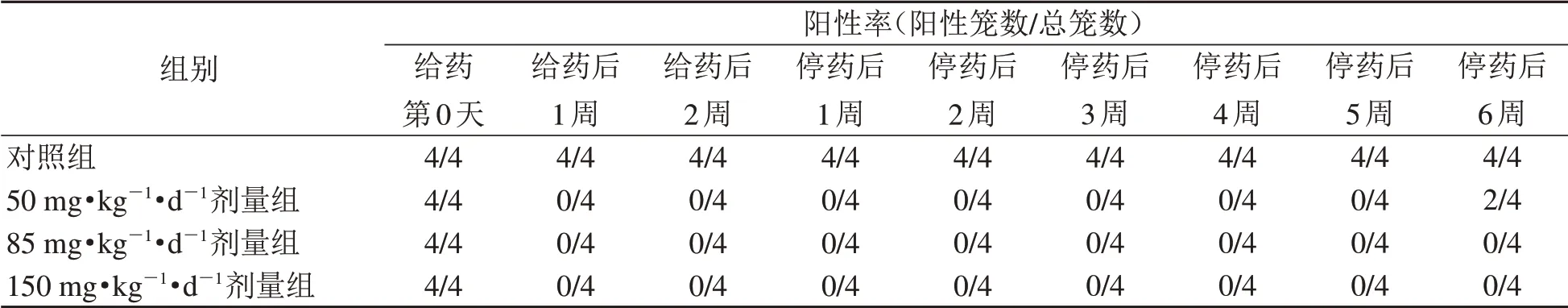
表3 恩诺沙星药物净化效果Table 3 Effect of drug purification with enrofloxacin
3 讨论
嗜肺巴斯德杆菌是目前国内外实验小鼠感染率最高的病原菌之一[11-12]。因为嗜肺巴斯德杆菌本身比较脆弱、动物感染后带菌量较少[12]、在血平皿上属于非优势菌落等原因,直接分离容易造成漏检,因此提高嗜肺巴斯德杆菌的检测敏感性十分重要。已有报告显示,从小鼠咽部采样,嗜肺巴斯德杆菌分离率最高[12]。因此,本研究使用增菌液(脑心浸液培养基+体积分数为5%的马血清)对小鼠咽拭子和气管组织进行增菌。结果显示,相比于直接涂板法,改良增菌法的嗜肺巴斯德杆菌检出率更高,提示后者可用于动物房的日常健康监测。
除了胚胎移植和剖宫产净化外,嗜肺巴斯德杆菌感染鼠的药物净化方法值得进一步探讨。本研究中,本地分离的嗜肺巴斯德杆菌菌株对7种抗生素敏感。其中,恩诺沙星口服吸收较快且完全,组织分布浓度高[13],能购买到液体制剂,而其他抗生素存在口服不易吸收或剂型不方便操作等问题。因此,本研究选择恩诺沙星经饮水给药进行后续研究。此前,有研究者尝试用恩诺沙星治疗嗜肺巴斯德杆菌阳性小鼠,给药剂量为8.5~85 mg·kg-1·d-1[3,9-10]。本 研 究 以85 mg·kg-1·d-1为最低剂量,设置了梯度递进的高浓度剂量组,进行安全性测试。结果显示,本实验条件下300 mg·kg-1·d-1以下剂量的恩诺沙星饮水给药安全性良好,与前人在大鼠上进行的毒理实验结论一致[14]。因为文献[3]中25.5 mg·kg-1·d-1剂量治疗曾出现过疑似复发,结合安全性试验的结果,本研究进一步设置50 mg·kg-1·d-1、85 mg·kg-1·d-1和150 mg·kg-1·d-1三个剂量组,探寻合适的药物净化剂量。既往研究中往往以单只鼠为单位进行检测评估疗效,本研究选择以笼为单位评估净化效果,更接近实际饲养状态,能准确地反映恩诺沙星饮水给药的效果。结果显示,85 mg·kg-1·d-1以上剂量的恩诺沙星饮水给药2周能有效清除感染小鼠体内的嗜肺巴斯德杆菌,且在停药6周后未出现复阳。综合考虑,笔者认为每天85 mg·kg-1·d-1恩诺沙星是清除感染小鼠体内嗜肺巴斯德杆菌的推荐剂量。
综上所述,改良增菌法提高了嗜肺巴斯德杆菌检测的灵敏度,可用于动物房的日常健康监测。在饲养繁育量大的非生产种群内,85 mg·kg-1·d-1以上剂量的恩诺沙星饮水给药作为一种药物净化手段,可以成为除剖宫产和胚胎移植以外清除嗜肺巴斯德杆菌的应急替代方案。

