小鼠诺如病毒感染实验小鼠的抗体变化规律分析
李晓波,付 瑞,王淑菁,,李 威,王莎莎,,黄宗文,,秦 骁,,王 吉,,岳秉飞
(中国食品药品检定研究院实验动物资源研究所实验动物质量检测室,北京102629)
诺如病毒(norovirus)为杯状病毒科,诺如病毒属,其中最具代表性的是人类诺如病毒,可导致人发生急性胃肠炎。诺如病毒既能感染人,也可感染动物,并具有种属特异性。小鼠诺如病毒(murine norovirus,MNV)是实验小鼠中感染率最高的病原体[1-2],各品系小鼠均易感,可致RAG2-/-/STAT1-/-小鼠死亡。虽然免疫功能正常的小鼠感染MNV后无明显临床症状,但会终生携带病毒,并可导致其细胞免疫功能发生变化,进而影响相关的动物实验结果[3-6]。
大量研究表明,在人、猪、牛和小鼠中,各种诺如病毒株感染都会引起体液免疫应答[7-11];体外表达组装的病毒样颗粒(virus-like particle,VLP)经鼻或口给药,在人类志愿者、牛、猪和小鼠中均能诱导黏膜IgA及血清IgG的产生。产生的血清抗体能够阻断MNV的VLP与ABH组织血型抗原结合,表明此类抗体能够发挥抗病毒感染的保护作用,而用多种MNV的VLP组成的疫苗混合物对小鼠进行接种可增强小鼠抗体的产生[12-16]。
KM、BALB/c、NIH、C57BL/6J及BALB/cnu等品系小鼠为我国生物制品检定常用小鼠,本研究采用MNV感染这5个品系的实验小鼠,检测其感染1~9周的多克隆抗体及中和抗体产生情况,分析总结各品系小鼠抗体变化规律,研究MNV感染对小鼠体液免疫应答的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
KM、BALB/c、NIH、C57BL/6J及BALB/cnu共5个品系的SPF级实验小鼠,每个品系20只,均为4周龄,雌性,购自国家啮齿类实验动物种子中心[SCXK(京)2017-0005],经检测符合SPF等级实验动物国家标准且MNV为阴性。动物实验于中国食品药品检定研究院屏障动物设施(生物安全2级)[SYXK(京)2017-0013]中进行,实验所用鼠料、水及垫料等均经灭菌处理,实验结束后所有动物通过二氧化碳窒息处死。本研究已通过中国食品药品检定研究院实验动物福利伦理审查委员会审查[批准号:中检动(福)第2018(B)020号],按实验动物3R原则给予人道关怀。
1.1.2 病毒株与细胞
MNV BJ10-2062株(GenBank:KM458057)由本实验室分离并保存[17];RAW264.7细胞购自中国科学院上海生命科学研究院细胞资源中心,目录号为TCM13。
1.2 主要试剂与仪器
DMEM培养液(批号RNBH2973)购自北京细工生物科技有限公司;胎牛血清(批号1640958)购自美国Gibco公司;MNV VP1重组抗原、MNV抗体阳性及阴性血清对照均由本实验室制备;辣根过氧化物酶标记的羊抗小鼠IgG(批号10237522)购自美国KPL公司;邻苯二胺(批号0688)购自北京博奥拓达科技有限公司;酶标仪(型号MK3)购自美国Thermo公司;恒温培养箱(型号MIR-262)购自日本Sanyo公司;倒置显微镜(型号Ti-S)购自日本Nikon公司;二氧化碳细胞培养箱(型号8000DH)购自美国Thermo公司。
1.3 动物分组及处理
每个品系的实验小鼠均随机分为感染组和对照组,每组各10只。参考文献[18~19]报告的剂量,感染组经口灌胃0.2 mL MNV液(经RAW264.7细胞培养的MNV),对照组灌胃0.2 mL生理盐水(即0.9%氯化钠溶液)。每只小鼠分别在感染MNV后的第7、14、21、28、35、42、49、56及64天,连续从眼周静脉采血,3 000 r/min离心10 min以分离血清,-20℃保存备用。
1.4 病毒感染能力测定
通过测定病毒的半数组织细胞感染量(median tissue culture infective dose,TCID50)来反映MNV的感染能力。将MNV用DMEM培养液稀释成10-1~10-11系列浓度,接种于96孔RAW264.7细胞板,每个稀释度接种1列,每孔接种0.1 mL,分别接种第1~11列;第12列为正常细胞对照,加入0.1 mL的DMEM培养液。置于37℃二氧化碳培养箱中继续培养,接种第4天记录每孔细胞病变情况,采用Reed-Muench两氏法计算病毒TCID50。
1.5 病毒总IgG抗体测定
参考文献[20],采用间接ELISA法测定每份血清的MNV总IgG抗体水平。具体步骤:用MNV VP1重组抗原包被酶标板,加入1∶40稀释的血清,37℃孵育1 h;洗板后,加入1∶30 000稀释的辣根过氧化物酶标记的羊抗小鼠IgG(二抗),37℃孵育1 h后加入显色剂显色,用酶标仪测定490 nm波长处的吸光度值。
1.6 中和抗体测定
待测血清先经56℃水浴灭活30 min后,用DMEM培养液从1∶256比例开始2倍系列稀释,共8个稀释度;每个稀释度加入同体积的病毒液(事先用DMEM培养液稀释成200 TCID50/0.1 mL),混匀,置于37℃培养箱中孵育1 h。设立病毒对照、MNV抗体阳性及阴性血清对照,待测血清本身有可能会对细胞产生毒性作用,因此随机选择一份待测血清作为血清毒性对照,以观察待测血清本身是否会导致细胞病变。其中阳性和阴性血清对照与待检血清进行平行实验,处理过程完全相同。将病毒分别稀释成200、20、2.0和0.2 TCID50,每个稀释度加入同体积的DMEM培养液,作为病毒对照;将血清毒性对照以1∶40比例稀释,加入同体积的DMEM培养液,作为血清毒性对照。上述处理好的待测血清及对照样本置于37℃培养箱中反应1 h,然后加入96孔RAW264.7细胞板中,每孔0.1 mL,每个稀释度设置4个平行孔;最后1列作为细胞对照,每孔加入0.1 mL的DMEM培养液。接种后第4天进行结果判定。
中和抗体滴度计算:阳性对照及血清毒性对照不出现细胞病变效应(cytopathic effect,CPE),阴性对照出现CPE,病毒对照200 TCID50出现CPE,0.2 TCID50不出现CPE,符合上述条件说明实验成立,可进行结果判定。采用Reed-Muench两氏法计算中和抗体滴度:距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数),lgPD50=高于50%血清的稀释度的对数-距离比例×稀释度对数之间的差;其中,PD50(median protective dose,半数保护剂量)即为中和抗体滴度。
1.7 统计学分析
采用SPSS 19.0软件进行实验结果分析,计量数据用-±s表示。感染组和对照组在每个时间点的总抗体吸光度均值差异比较采用t检验;各品系小鼠感染组总抗体吸光度均值及中和抗体滴度均值比较先采用方差分析,然后用LSD-t检验进行两两比较,以P<0.05认为差异有统计学意义。
2 结果
2.1 各品系小鼠感染MNV后的总抗体水平
2.1.1 每个时间点的总IgG抗体吸光度均值比较
各品系小鼠感染MNV后每个时间点,对照组和感染组的总抗体吸光度均值分别经t检验比较,结果表明KM、BALB/c、NIH、C57BL/6J及BALB/c-nu小鼠分别在感染后第21、35、14、及28天感染组吸光度均值明显高于对照组,差异均有统计学意义(P<0.01),即抗体开始转阳(图1)。

图1 各品系小鼠感染小鼠诺如病毒后的抗体变化Figure1 Antibody changesin variousstrainsof miceafter MNV infection
2.1.2 总IgG抗体吸光度均值变化规律
各品系小鼠感染MNV后的抗体变化规律见图1。NIH小鼠第21~28天和第35~42天这两个时间段的抗体水平升高最快,第42天后放缓,第49天进入平台期;C57BL/6J小鼠第7~35天的抗体水平升高缓慢,第35~42天抗体水平迅速升高,随后稍有放缓,至第56天进一步放缓;KM小鼠第7~35天抗体水平上升较缓慢,第35~56天处于快速上升期,随后放缓;BALB/c与BALB/c-nu小鼠相比,前35天BALB/c-nu小鼠抗体产生速度快于BALB/c,随后BALB/c小鼠升高较快,而BALB/c-nu小鼠抗体水平基本不变,至第42天两者抗体水平相近,随后BALB/c小鼠继续升高,而BALB/c-nu小鼠开始缓慢下降。
2.2 各品系小鼠感染MNV后的中和抗体水平
2.2.1 病毒TCID50测定
接种细胞第4天观察记录细胞出现CPE的情况,结果见表1。采用Reed-Muench两氏法计算MNV病毒液的TCID50为10-5.330/0.1 mL。
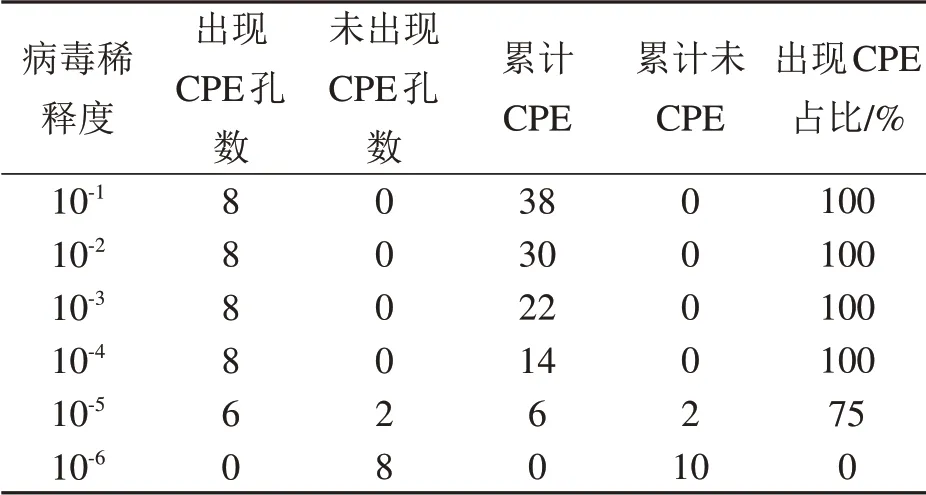
表1 RAW264.7细胞接种MNV后最终细胞病变效应结果Table1 Final CPEresultsof MNV inoculation
2.2.2 不同品系小鼠的中和抗体滴度比较
采用单因素方差法分析比较各品系小鼠的中和抗体滴度,NIH、C57BL/6J及KM小鼠之间无明显差异(P>0.05);BALB/c小鼠的lgPD50为3.146,明显低于NIH、C57BL/6J及KM小鼠(P<0.01);BALB/c-nu小鼠的lgPD50为2.338,明显低于NIH、C57BL/6J、KM及BALB/c小鼠(P<0.01,图2A)。

图2 各品系小鼠中和抗体滴度比较(A)及中和抗体变化规律(B)Figure 2 Comparison of neutralizing antibody titers(A)and the change curve of neutralizing antibody(B)of mice of variousstrains
2.2.3 中和抗体滴度变化规律
各品系小鼠感染MNV不同时间的中和抗体变化规律见图2B。KM小鼠感染第7天及第14天各有2份血清未检出中和抗体(最低限值lgPD50为2.408),随后中和抗体滴度不断升高,至第42天到达平台期;C57BL/6J小鼠感染第2周时中和抗体滴度迅速升高,第14天开始放缓,第56天达最高值(有1份样本超出检测限,最高限值lgPD50为4.515);NIH小鼠感染第7~35天中和抗体滴度迅速升高,至第35天到达平台期;BALB/c小鼠中和抗体滴度变化趋势与C57BL/6J小鼠相似,感染第2周中和抗体滴度迅速升高,第14天开始放缓,第64天到达峰值。与其他品系不同,BALB/c-nu小鼠中和抗体一直维持在较低水平,随时间变化幅度不大。
3 讨论
MNV是第一个可以通过细胞进行体外培养的诺如病毒,可在原代巨噬细胞和树突状细胞中生长,也可在传代细胞小鼠巨噬细胞系RAW264.7上生长并能够产生CPE[21-22]。通过RAW264.7细胞体外培养体系能够分离到MNV的单克隆中和抗体,研究发现其识别的抗原决定簇存在于主要衣壳蛋白VP1中一个高度可变的P2结构域[23-24]。Chachu等[25]研究发现,MNV特异的B细胞和免疫抗体IgG在清除病毒中起重要作用,B细胞缺陷小鼠无法像野生型小鼠一样有效地清除原发性MNV感染,将源自B细胞缺陷小鼠或抗体产生缺陷小鼠的免疫脾细胞过继转移至适应性免疫应答缺陷的RGA-/-小鼠,无法有效清除MNV的持续感染,而过继转移多克隆抗MNV血清或中和性抗MNV单克隆抗体则足以降低全身和肠道中MNV的水平。以上研究表明,MNV感染的体液免疫应答在抗病毒感染过程中发挥了重要作用。
MNV感染的小鼠能够产生明显的抗体反应,产生的抗体可被中和[24]。早期研究发现,MNV感染CD-1小鼠后第1周抗体出现阳性,随后抗体滴度不断升高,一直到第5周实验结束时仍未出现下降[26];该结果表明MNV抗体在动物体内能够长期持续存在。本研究进一步发现各品系小鼠抗体变化的规律不同:NIH小鼠在感染第49天时总抗体水平进入平台期,一直持续到实验结束(第64天);C57BL/6J、KM及BALB/c小鼠的总抗体水平在实验周期内(9周)持续升高;BALB/c-nu小鼠在第42天总抗体达峰值,随后缓慢下降。中和抗体变化规律与总IgG抗体略有不同,其中C57BL/6J和BLAB/c小鼠在感染前两周中和抗体滴度迅速升高,随后升高幅度减缓;KM及NIH小鼠中和抗体分别在感染后第42天和第35天进入平台期;与其他品系小鼠不同,BALB/c-nu小鼠的中和抗体滴度一直维持在较低水平,比较恒定。BALB/c-nu小鼠为无胸腺小鼠,T细胞免疫缺陷,与BALB/c小鼠相比,其中和抗体水平明显降低,说明T细胞缺陷影响了B细胞的活化及MNV特异抗体的产生,T细胞和B细胞发挥的适应性免疫应答是清除MNV感染的关键。另外,BALB/c及BALB/c-nu小鼠的总IgG抗体水平显著低于NIH及C57BL/6J小鼠(P<0.05),而BALB/c及BALB/c-nu小鼠的中和抗体滴度显著低于C57BL/6J、NIH及KM小鼠(P<0.01)。以上结果表明MNV感染能够引起NIH、C57BL/6J、KM小鼠发生较强的体液免疫应答,而BALB/c及BALB/c-nu小鼠的体液应答较弱。
尽管NIH、C57BL/6J和KM小鼠的中和抗体水平较高,但其肠道病毒含量均处于较高水平,表现为长期持续感染[27]。有报道显示,MNV可能通过肠道微生物的保护或肠道细胞的特殊分化等机制,逃避了体液免疫应答,因此肠道发挥着特殊的MNV“避难所”作用[28-29],而肝、脾、肺等组织大部分不含病毒[27],说明免疫系统在这些组织中能够正常发挥抗病毒功能。
本研究结果表明5个品系小鼠感染MNV产生的体液免疫应答各不相同,可推测应用不同品系小鼠进行疫苗等生物制品效价评价实验产生的结果会有所不同,进一步研究不同品系小鼠在疫苗效价评价实验中的差异对指导疫苗检定用动物的选择具有重要的指导意义,同时这些品系小鼠感染MNV是否会影响生物制品动物实验的结果,以及产生什么样的影响,这些仍需进一步研究和探讨。

