第二代肠道病毒71型(EV71)抗原国家标准品的建立
高帆,卞莲莲,吴星,么山山,王一平,毛群颖,梁争论
中国食品药品检定研究院,北京102629
手足口病(hand,foot and mouth disease,HFMD)是一种常见于5岁以下婴幼儿和儿童的传染性疾病,少数患儿可并发病毒性脑炎、脑干脑炎、肺水肿和急性弛缓性麻痹等重症,甚至死亡[1-2]。肠道病毒71型(enterovirus 71,EV71)是导致重症HFMD的主要病原体,90%以上的死亡HFMD病例均由EV71所致[3-4]。我国是迄今唯一生产EV71疫苗的国家,已有3家企业研发的EV71灭活疫苗(C4亚型)相继获批上市[1,4-5],分别为中国医学科学院医学生物学研究所(昆明所)、北京科兴生物制品有限公司(科兴公司)和武汉生物制品研究所有限责任公司(武汉所)。目前EV71疫苗已签发上市8 000余万剂,显著降低了我国EV71-HFMD死亡人数[6]。
EV71疫苗抗原含量检测是质量控制和剂量确定的关键指标[7]。2010年,中国食品药品检定研究院(中检院)与我国主要EV71疫苗研发实验室联合建立了第一代EV71抗原国家标准品,赋值1 600 U/mL[8],并证明了抗原含量与疫苗免疫原性的相关性,直接支撑了我国EV71疫苗从临床前研发、临床研究到上市后的顺利衔接,有效保证了我国EV71疫苗质量的一致性和有效性。研究成果得到世界卫生组织(World Health Organization,WHO)的高度认可。随后中检院与英国国家生物制品检定所(National Institute for Biological Standards and Control,NIBSC)进一步合作,以我国第一代EV71抗原国家标准品为依据创建了EV71抗原国际标准品,并于2019年获得ECBS(Expert Committee on Biological Standardization)审批正式成为第1代EV71抗原国际标准品(赋值14 500 IU/mL)[9],为全球EV71疫苗研发及应用提供了科学标准。
本研究对第一代EV71抗原国家标准品进行换代,建立第二代EV71抗原国家标准品。两代标准品的生产及冻干工艺一致。第二代标准品以国家单位(U/mL)赋值,用于我国EV71疫苗生产企业依据国家药品标准进行质量控制,为EV71疫苗一致性评价提供保障;同时溯源至国际单位(IU/mL),为进行WHO EV71疫苗指南[10]提出的全球范围内EV71疫苗质量和保护效果标准化评价,促进我国独创EV71疫苗申请WHO预认证、走入国际市场以及全球HFMD防控奠定基础。
1 材料与方法
1.1 标准品1stInternational Standard for Enterovirus A71 inactivated vaccine由NIBSC保存,code number:18/116,赋值:14 500 IU/mL,编号:WHO IS;第一代EV71抗原国家标准品由中检院保存,品种编号:300016-201001,赋值:1 600 U/mL,编号:NS。
1.2 候选标准品 由科兴公司依据《肠道病毒71型灭活疫苗(Vero细胞)制造及检定规程》(YBS0-0332015),采用EV71病毒株(H07株)接种非洲绿猴肾细胞(Vero细胞),经培养、收获病毒液、灭活病毒、浓缩、纯化和加入冻干剂后冻干制备而成。候选标准品编号:CS。装量均匀性:装量平均值为0.5187 g/瓶,CV为0.7%;抗原均匀性:抗原含量平均值为2 332 U/mL,CV为5%;水分为2.8%,CV为0.5%。
1.3 协作标定 由中检院肝炎室牵头,依据《WHO manual for the establishment of national and other secondary standards for vaccines》[11]以及《中国药典》三部(2020)版的相关要求和理念,联合3家EV71灭活疫苗已获批上市的生产企业进行协作标定。4个协作实验室随机编号为lab1~4。中检院负责分发WHO IS、NS和CS,由4个协作实验室按各自试剂盒的标准操作程序(standard operating procedure,SOP)对候选标准品进行6次独立检测。其中lab1采用通用试剂盒[9],lab2~4采用企业内控试剂盒。
1.4 适用性EV71收获液、原液和疫苗的编号分别为H、B和V,由武汉所、昆明所和科兴公司自行制备。解离方法根据各实验室SOP执行。3个实验室(编号lab2~4)依据各自内控试剂盒SOP,以WHO IS、NC和CS为标准品,分别对企业自制的EV71收获液、原液和疫苗各进行6次独立检测。
1.5 稳定性 采用3人3平行对CS抗原含量进行检测,共计27次,确定抗原含量基点值。加速稳定性:将CS置2~8和37℃条件下0~56 d,各时间点进行3次独立检测。以抗原含量基点值为标准,计算各时间点抗原含量残留率。复溶稳定性:将CS复溶后置2~8℃保存1、3、5和7 d后检测抗原含量,并计算复溶后各时间点的抗原含量残留率。冻融稳定性:将CS复溶后置-20℃条件下反复冻融1~5次后,检测抗原含量,计算反复冻融后的抗原含量残留率。
1.6 统计方法 全部原始数据汇总至中检院,由中检院采用Statistic软件进行双平行线法计算:在5%的显著性水平下,双平行线的平行性或线性出现显著性差异,或独立实验的95%置信区间大于80%~120%时,检测结果无效。对有效结果采用Microsoft Office Excel软件计算平均值、CV和95%置信区间等。
2 结果
2.1 协作标定WHO IS与CS以及NS与CS均具有良好的平行性和线性,见图1。以WHO IS为标准检测CS的结果显示,CS检测的平均值为2 316 IU/mL,实验室内CV为4.3%~9.3%,实验室间CV为7.1%,95%置信区间为2 229~2 403 IU/mL。以NS为标准检测CS的结果显示,CS检测平均值为2 437 U/mL,实验室内CV为3.9%~10.7%,实验室间CV为5.3%,95%置信区间为2 355~2 519 U/mL。见表1。协作标定累积图显示,各实验室检测结果分布均较为集中,见图2。标定结果,将候选标准品赋值为2 320 IU/mL(相当于2 440 U/mL)。
图2 协作标定结果的累积图Fig.2 Cumulative graph of collaborative calibration result
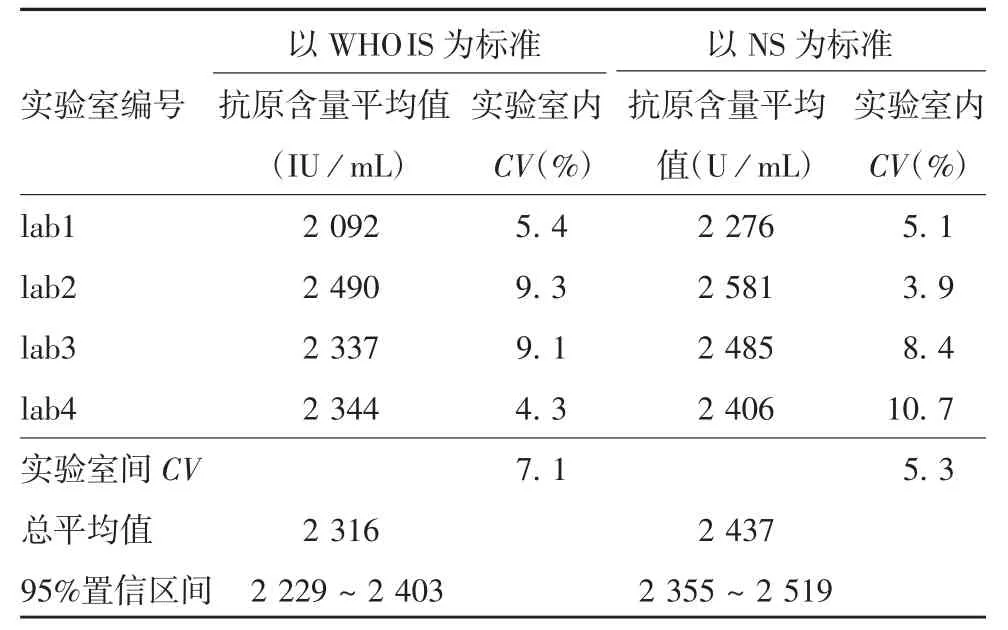
表1 协作标定结果(n=6)Tab.1 Result of collaborative calibration(n=6)
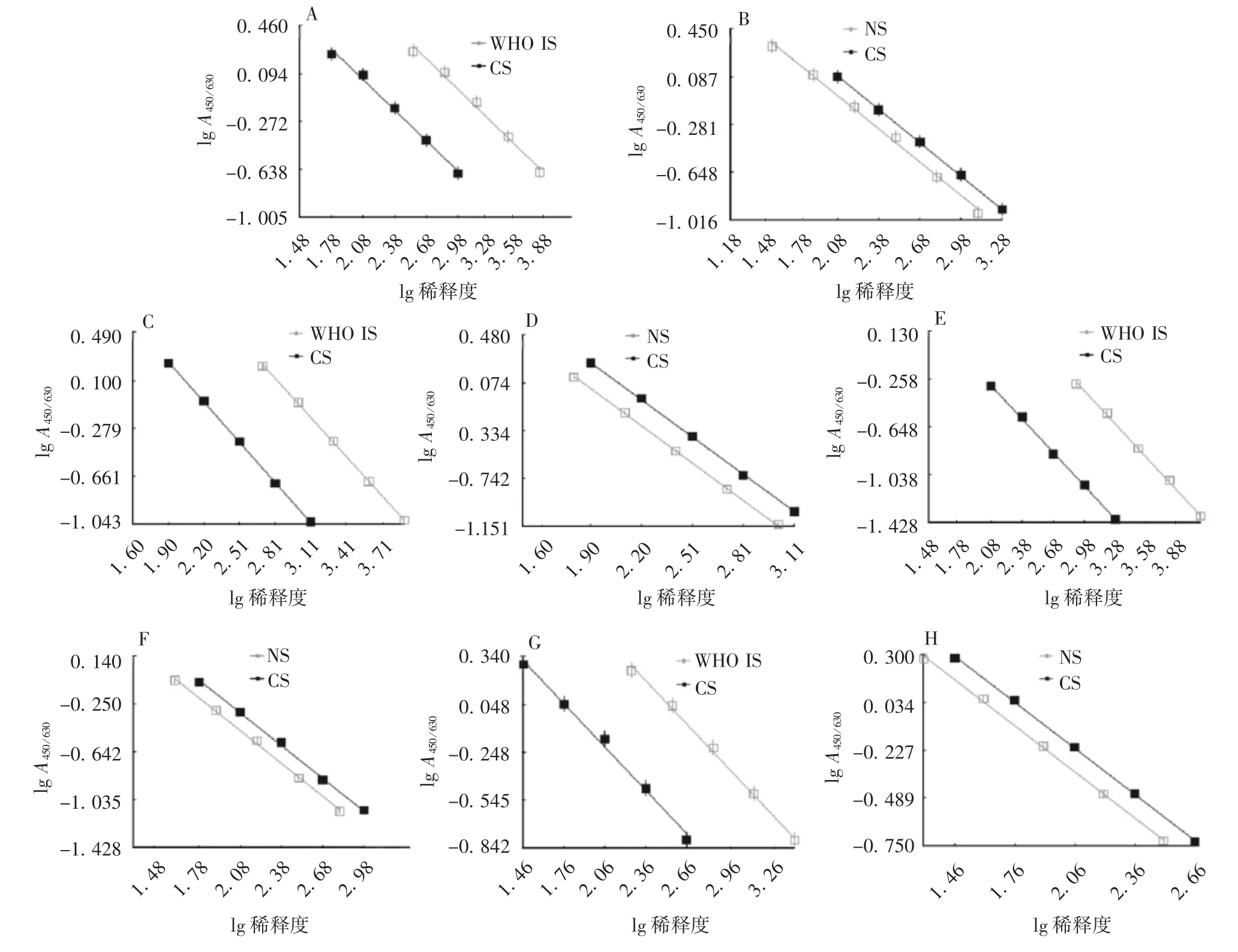
图1 协作标定的平行性和线性Fig.1 Parallelism and linearity in collaborative calibration
2.3 适用性
2.3.1 平行性和线性3家实验室(lab2~4)采用内控试剂盒,对自制的EV71收获液、原液和疫苗抗原含量进行6次独立检测。结果显示,以CS为标准检测各种样品均具有较好的平行性和线性,见图3。

图3 适用性的平行性和线性验证Fig.3 Parallelism and linearity in verification for suitability
2.3.2 准确性 以CS为标准与以WHO IS为标准的检测结果比较,准确率为92%~101%;以CS为标准与以NS为标准的检测结果比较,准确率为93%~102%。准确率均位于90%~110%之间,见表2。
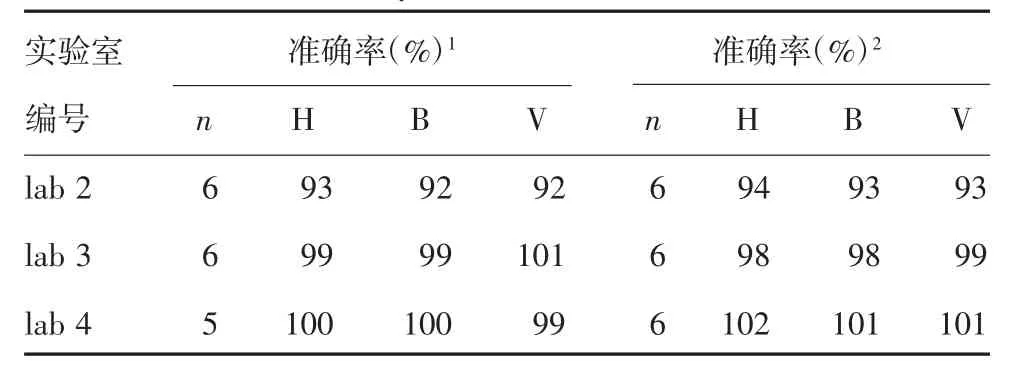
表2 准确性结果Tab.2 Result of accuracy
2.2 候选标准品赋值 依据4个实验室完成的协作
2.4 稳定性
2.4.1 加速稳定性 采用3人3平行对CS抗原含量进行检测,共计27次,确定抗原含量基点值为2 256 U/mL(CV为6%)。在2~8和37℃条件下各时间点进行3次独立检测,以抗原含量基点值为标准,计算的各时间点的抗原含量残留率均位于基点结果的90%~110 %之间,见表3。
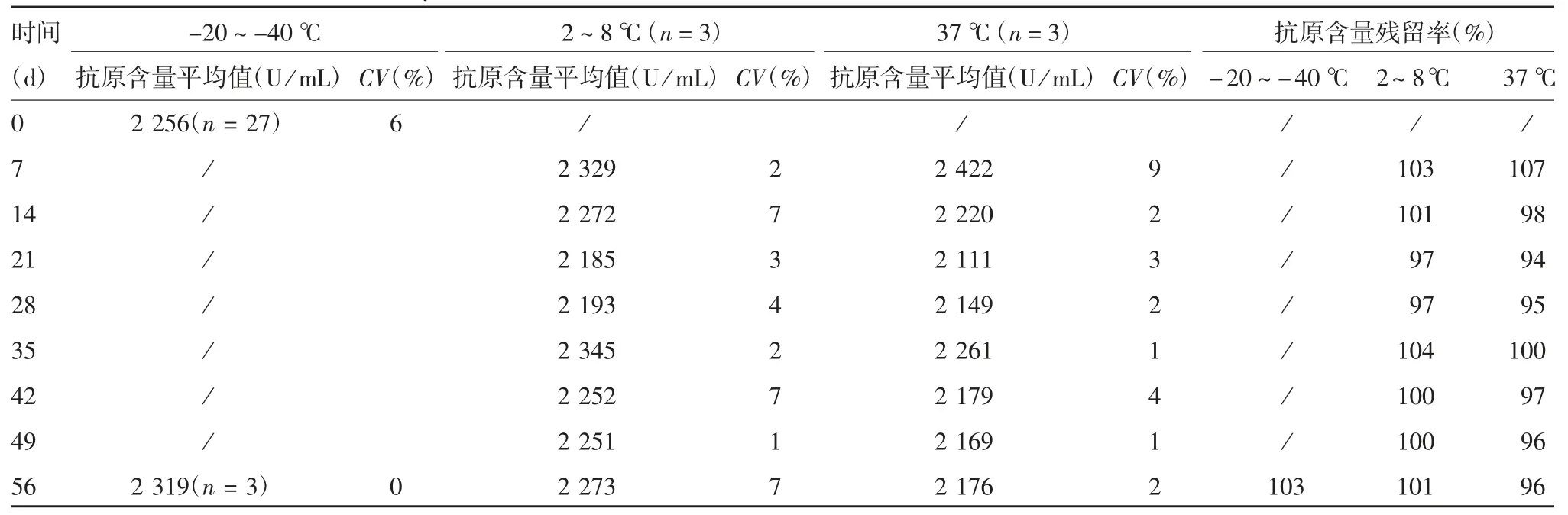
表3 加速稳定性结果Tab.3 Result of accelerated stability test
2.4.2 复溶稳定性 以抗原含量基点值2 256 U/mL为标准,计算复溶后各时间点的抗原含量残留率,结果显示,复溶后2~8℃保存1、3、5和7 d的抗原含量残留率分别为101%、108%、108%和108%,均未超过90%~110%,见表4。

表4 复溶后2~8℃的稳定性结果(n=3)Tab.4 Stability after reconstitution and storage at 2~8℃(n=3)
2.4.3 冻融稳定性 以抗原含量基点值2 256 U/mL为标准,计算反复冻融后候选标准品的抗原含量残留率,结果显示,反复冻融1、3和5次后,抗原含量残留率分别为95%、96%和91%,未超过90%~110%,见表5。
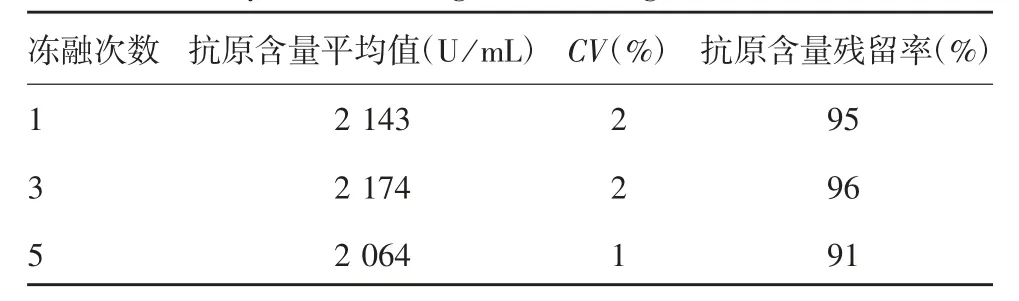
表5 冻融稳定性结果(n=3)Tab.5 Stability after freezing and thawing(n=3)
3 讨论
标准物质对疫苗的质量控制和评价具有重要意义[12]。中检院已建立了EV71疫苗抗原国家标准品[8]、中和抗体国家标准品[8]和效力国家参考品[13]共3个国家标准物质,以及EV71标准检测毒株。一系列标准物质为EV71疫苗的全面质量控制提供标尺。同时,为了推动我国EV71疫苗的国际化,中检院联合NIBSC共同主导成功研制了第一代EV71中和抗体国际标准品[14]和第一代EV71抗原国际标准品[15],表明我国生物制品标准物质的研制水平已与国际接轨,提升了我国在疫苗国际标准领域的话语权。
本研究建立的第二代EV71抗原国家标准品经均匀性和稳定性考核合格后,分发给4个实验室,采用通用试剂盒或内控试剂盒进行协作标定和适用性研究,最终赋值为2 320 IU/mL(相当于2 440 U/mL)。其中通用试剂盒为中检院与NIBSC联合研制,曾分发给全球14个实验室进行第一代EV71抗原国际标准品的协作标定[7]。结果显示该试剂盒可适用于EV71不同基因型抗原含量检测,检测结果具有较好的一致性,且实验室间CV较内控试剂盒更低,特别是检测单抗CT11F9为具有中和活性的构象单抗,具有交叉反应性好、中和效价高、体内保护效果好和位点清晰的特点[15-16],可作为EV71疫苗体外效力评价的通用质控方法。
EV71疫苗效力评价采用体外效力和体内效力双指标[7]。其中体内效力为用BALB/c小鼠检测ED50,存在变异大、周期长以及使用大量实验动物不符合动物伦理3R原则等问题,欧洲替代方法验证中心提倡研究体外相对效力的方法代替动物体内法。对于EV71疫苗,体外效力检测抗原含量具有结果精密度高、检测周期短、操作便捷、影响因素少,以及符合3R原则等优势,特别是采用中和活性单抗建立的通用试剂盒,对保证体外抗原与体内效力一致性,提高疫苗生产和质控准确性,保证疫苗质量可控和批间一致性具有重要意义。

