CTAB调控乳腺癌干细胞抑制迁移
李 宁,潘 悦,陶 旭 锋,肖 桂 山
(大连理工大学 化工学院,辽宁 大连 116024)
0 引 言
有研究表明约90%的癌症相关死亡是由肿瘤转移引起的[1].乳腺癌可以转移到骨、肺和脑等部位,目前大多数与乳腺癌相关的死亡归因于转移而不是原发性肿瘤的生长[2-4].乳腺癌目前的治疗方法有手术、化学疗法、中药和免疫治疗等[5-6].尽管最近在医学上取得了重大进步,但是这些治疗方法对乳腺癌的转移有一定的局限性,因此乳腺癌转移仍然是目前乳腺癌临床治疗需要面对的重要困难.
肿瘤转移是一个复杂的过程,并不是所有的肿瘤细胞都能够在这个过程中存活并且通过血管渗透和迁移到达新的部位,只有具有攻击性的癌细胞才能完成肿瘤细胞的转移并定植生存.类肿瘤干细胞(cancer stemness cells,CSCs)被认为存在于大多数原发性肿瘤中并带有自我更新和分化特性,具有较强的攻击性,可以从中衍生出转移性细胞向远处转移[7].因此有研究表明癌症复发以及转移的根本原因是CSCs的存在,并且通过调控CSCs可以影响乳腺癌的转移[8].在Wang等的研究中,Anillin通过涉及细胞干性和分化控制的非经典机制来调节乳腺癌细胞的迁移、生长和转移[9].乔书培研究发现miR-486-3p可以调控MAPK信号通路进而阻碍乳腺癌干细胞的增殖来抑制乳腺癌的转移[10].因此,研究乳腺癌干细胞对乳腺癌转移具有重要意义.
十六烷基三甲基溴化铵(CTAB)是一种季铵盐并具有两性结构,即具有非极性疏水尾巴和带正电荷的极性头部.这种结构可以帮助CTAB附着在细胞膜上并形成纳米级微孔.因此,CTAB可以破坏脂质双层并增加细胞膜的通透性从而诱导细胞凋亡.有很多研究表明CTAB对多种肿瘤具有明显的抑制作用,因此CTAB有可能成为抗肿瘤的候选药物.而以前的工作表明,CTAB可以通过靶向多种信号通路,诱导肝癌细胞凋亡以及逆转乳腺癌的耐药性[11-12],但是CTAB是否可以调控乳腺癌的转移目前尚不清楚.本实验拟在探讨CTAB对乳腺癌转移的治疗作用并初步阐述其调控乳腺癌转移的相关机制.
1 材料与方法
1.1 材料与试剂
CTAB(H6269-250G,纯度≥99%)购自Sigma Aldrich公司,DMEM高糖培养基(C11995500BT)购自Gibco公司,胎牛血清(FBS)购自PAN公司.MTT(M8181-1G)、青霉素、链霉素、BCA蛋白测定试剂盒(PC0020)和总蛋白提取试剂盒(R0020)购自Solarbio公司.Super ECL Plus超灵敏发光液(P1050,100 mL)购自Solarbio公司.一抗β-actin(66009-1-lg)购自Proteintech公司,CD44(3570)和CD133(64326S)抗体购自Cell Signaling Technology公司,APC Mouse Anti-Human CD44(560890)和PE Mouse Anti-Human CD133(566593)抗体购自BD Biosciences公司,兔二抗(A25022)和鼠二抗(A250012)购自美国Abbkine公司.双丙烯酰胺(M104026-100g)购自Aladdin公司,四甲基乙二胺(TEMED)购自Macklin公司.
1.2 实验方法
1.2.1 细胞培养及MTT检测 将ZR-75-1细胞(购自南京科佰生物科技有限公司)培养在DMEM高糖培养基中,培养基中添加10% FBS、100 units/mL青霉素和100 μg/mL链霉素,在5% CO2的细胞培养箱(Thermo Fisher Scientific公司)里于37 ℃进行培养.在96孔板中进行MTT测定以评估细胞活力.将ZR-75-1细胞用胰蛋白酶消化,用含FBS的培养基终止消化,离心弃上清液,用FBS清洗ZR-75-1细胞一次,加入新的培养基,将细胞以5×103个/孔的密度接种到每个孔中以进行过夜培养,然后加入终浓度为0、0.247、0.521、1.04、2.06、4.12、8.23、16.5、33.0 μmol/L的CTAB处理ZR-75-1细胞24 h.随后,将20 μL MTT溶液(5 mg/mL)添加到每个孔培养4 h.最后,将甲臜蓝紫色晶体用150 μL DMSO溶解并用酶标仪(Tecan,Infinite 200 Pro)以490 nm 波长测量吸光度.
1.2.2 细胞划痕实验 将细胞接种到6孔板中,待其生长至80%~90%密度,用200 μL黄色移液管尖端将细胞单层去除,并用磷酸盐缓冲液(PBS)洗涤4次以除去细胞碎片.然后将细胞在具有CTAB(ZR-75-1细胞1.04 μmol/L)的DMEM中孵育24 h.最后,使用倒置显微镜(Olympus 公司,U-RFL-T)观察细胞迁移并测定其距离.在每个孔中分析5个随机选择的区域,通过计算划痕宽度变化的百分比来量化细胞迁移能力.
1.2.3 Transwell细胞迁移分析 为了检测CTAB对乳腺癌肿瘤转移的影响,使用孔径为8 μm 的Transwell小室(Corning Costar公司)进行迁移分析.将细胞用胰蛋白酶消化,并以5×104个/mL的密度悬浮在不含有FBS的DMEM中.随后,将细胞悬浮液和含有10% FBS的培养基分别装入上隔室和下隔室.待细胞贴附后,将实验分为CON组(加入FBS)和CTAB组(加入终浓度为1.04 μmol/L的CTAB),在37 ℃的5% CO2中温育24 h后,用棉签擦拭上表面的细胞,将下表面上迁移的细胞固定并染色.用4%多聚甲醛固定细胞30 min,并用0.1%结晶紫溶液染色20 min.用33%乙酸洗涤聚碳酸酯膜后,在600 nm 波长下测量吸光度并计算迁移率.
1.2.4 流式细胞仪检测肿瘤干性 CON组和CTAB组取5×105个ZR-75-1细胞,用PBS洗涤2次,21 ℃、2 100 r/min下离心4 min,弃去上清液,加入200 μL染色缓冲液吹匀细胞.向CON组和CTAB组悬浮液中均加入20 μL CD44抗体和5 μL CD133抗体,4 ℃放置30 min.将染色的ZR-75-1细胞用染色缓冲液洗涤2次,然后再加入500 μL染色缓冲液吹匀,使用Life Attune声波聚焦流式细胞仪(Thermo Fisher Scientific,Attune NxT)选择对应的荧光通道进行检测.
1.2.5 免疫荧光技术 以2×104个/孔的密度将ZR-75-1细胞培养在24孔板中,第2 d给予1.04 μmol/L CTAB,长至80%左右用PBS清洗,使用4%的多聚甲醛固定细胞30 min,PBS洗涤2次;3%的H2O2孵育15 min,PBS洗涤2次;加入血清封闭,室温封闭15 min,弃去血清;一抗4 ℃过夜,次日回收一抗,PBS洗涤2次;荧光二抗孵育1 h,弃去二抗,PBS洗涤2次;加入DAPI染料1 min,弃去,PBS洗涤2次,倒置荧光显微镜拍照.
1.2.6 Western Blot检测相关蛋白表达 将CON组和加入1.04 μmol/L CTAB处理的细胞,消化洗净后,加入RIPA裂解液和PMSF混合液(按体积比100∶1混合),按Solarbio总蛋白提取试剂盒提取总蛋白.使用Solarbio试剂盒(BCA法)检测蛋白浓度,按比例加入5倍的上样缓冲液后95 ℃孵育10 min.每条泳道加入10~20 μg蛋白样品,设置恒压80 V跑至分离胶,然后调至恒压130 V跑至结束.将胶转移至甲醇活化的PVDF膜上,300 mA恒流转膜60~120 min,牛奶封闭3 h,用TBST洗膜,一抗(体积比1∶1 000 稀释)4 ℃孵育过夜,次日TBST洗膜,室温孵育二抗2 h,TBST清洗,ECL超敏显影液孵育PVDF膜,凝胶成像仪(Bio-Rad,17001402,ChemiDoc MP Imaging System)显影.
1.3 统计学分析
采用GraphPad Prism 5.0进行数据处理和统计分析,结果以平均值±标准差表示,使用t检验(两组)或是双边ANOVA(多组)评估组间统计差异,P<0.05被认为具有统计学意义.
2 结 果
2.1 筛选CTAB用于乳腺癌转移治疗的安全浓度
选取乳腺癌ZR-75-1细胞,给予CTAB的浓度为0、0.247、0.521、1.04、2.06、4.12、8.23、16.5、33.0 μmol/L,分别处理ZR-75-1细胞24 h和48 h,采用MTT法测定CTAB对ZR-75-1乳腺癌细胞存活率的影响.筛选CTAB不引起乳腺癌细胞死亡的最大浓度,结果显示24 h后,CTAB对ZR-75-1细胞不引起杀伤的最大浓度为1.04 μmol/L(如图1所示).因此在24 h之内选择1.04 μmol/L作为后续治疗浓度,而在48 h内选择0.521 μmol/L作为后续治疗浓度.
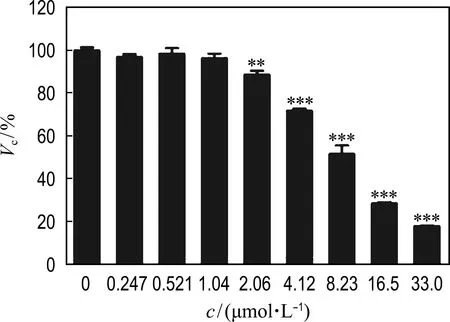
(a)ZR-75-1-24 h
2.2 CTAB抑制乳腺癌ZR-75-1细胞的转移
本实验选择乳腺癌ZR-75-1细胞,以检测CTAB对乳腺癌转移的影响.首先使用伤口愈合测定法测量癌细胞迁移能力.将ZR-75-1培养在96孔板中,待细胞贴壁长至80%,用200 μL枪头在6孔板内平行划3条线,PBS洗去多余细胞,给予1.04 μmol/L的CTAB处理24 h.结果显示,孵育24 h后,CON组中的ZR-75-1细胞迅速扩散到伤口区域,伤口接近完全愈合,而CTAB处理的细胞向伤口区域的扩散速度比CON组慢(图2(a)).这些结果证明CTAB具有抑制乳腺癌细胞迁移的能力.
使用经典的Transwell实验进一步验证CTAB对ZR-75-1细胞迁移的影响.将细胞洗净离心后加入无血清培养基,小室内加入400 μL 共5×103个细胞,下室内加入600 μL培养基(包含10%的胎牛血清),3~4 h后给予1.04 μmol/L 浓度的CTAB,放入细胞培养箱培养24 h,固定染色拍照.Transwell迁移分析的结果表明,CON组被染色的细胞的数量明显多于CTAB组细胞的数量,CTAB可以减少ZR-75-1细胞通过聚酯纤维膜的细胞数量(图2(b)).统计分析,CTAB组的相对细胞迁移率显著低于CON组(图2(b)).这部分结果表明CTAB可以抑制乳腺癌细胞的迁移能力.
2.3 CTAB抑制乳腺癌细胞系干细胞
为了探究CTAB抑制乳腺癌ZR-75-1细胞转移的作用机制,使用流式细胞术检测CTAB对乳腺癌干细胞比例的影响.CD44和CD133是乳腺癌干细胞的特定表面标志物.CD44+/CD133+双阳性已被广泛应用于鉴定乳腺癌干细胞[13-15].选取乳腺癌细胞ZR-75-1,给予1.04 μmol/L CTAB处理24 h,使用CD44和CD133抗体共染乳腺癌细胞.实验发现,CON组细胞在CD44+/CD133+双阳性区域(Q2)的比例为10%,加入CTAB处理24 h后,细胞在CD44+/CD133+双阳性区域(Q6)的比例为1.4%,相较于CON组,双阳性的细胞比例明显下降(图3(a)).
同时CD44和CD133抗体共染乳腺癌细胞,免疫荧光结果显示,CTAB处理后,绿色荧光和红色荧光明显变浅,CD44+和CD133+在细胞中的表达明显减少(图3(b)).上述结果证实,CTAB可降低乳腺癌干细胞(CD44+/CD133+)比例.
为了进一步探究CTAB对调控乳腺癌ZR-75-1细胞干性的作用,本研究进一步验证CTAB对乳腺癌细胞成球能力的影响.将ZR-75-1细胞消化离心,PBS洗净细胞,加入干细胞培养基重悬细胞,使用超低吸附24孔板,1×103个/孔,CTAB组给予1.04 μmol/L的CTAB,每天拍照观察,于第8 d结束实验.结果如图4(a)所示,CTAB组的乳腺癌ZR-75-1细胞成球数量变少且体积变小,证明CTAB可以抑制乳腺癌细胞的成球能力.

(a)ZR-75-1划痕实验
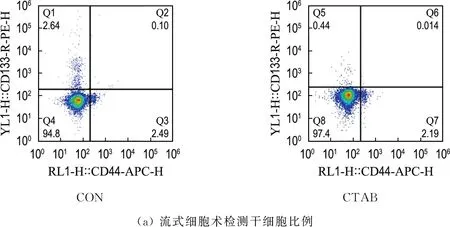
(b)免疫荧光观测干细胞比例
为了研究CTAB对乳腺癌干细胞干性的抑制作用,检测了乳腺癌干性标志物CD44和CD133的mRNA和蛋白水平.CTAB处理ZR-75-1细胞24 h后,qRT-PCR结果显示CTAB在mRNA水平下调CD44和CD133(图4(b)).与mRNA水平一致,Western Blot结果显示CTAB降低了CD44和CD133的蛋白表达(图4(c)).
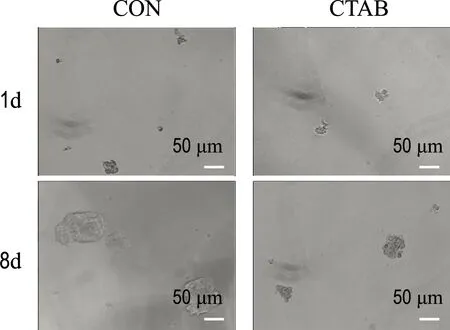
(a)CTAB抑制乳腺癌ZR-75-1细胞成球
这些结果表明,CTAB可以抑制乳腺癌ZR-75-1干细胞的数量以及细胞干性.
3 讨 论
越来越多的证据表明,乳腺癌干细胞(BCSCs)与乳腺癌疾病的恶性程度密切相关,且BCSCs在乳腺癌进展中起着重要的作用.BCSCs位于肿瘤细胞的起始位置,具有自我更新的能力,可以分化为多种癌细胞[16].已有多项研究表明调控乳腺癌干细胞对乳腺癌转移具有作用.Reithmeier 等发现TRAP通过TGFβ2/TβR和CD44促进MDA-MB-231乳腺癌细胞的转移[17].Li等证实miR-520a-3p抑制CCND1和CD44表达从而抑制乳腺癌细胞的增殖、迁移和侵袭[18].韩亚娟等的实验表明CD133促进乳腺癌MDA-MB-231细胞的侵袭和转移[19],因此乳腺癌干细胞可作为治疗乳腺癌转移的关键靶点.本文的结果表明,在流式细胞术和免疫荧光实验中CTAB可以降低乳腺癌ZR-75-1细胞中CD44+/CD133+双阳性干细胞的比例,并且可以抑制ZR-75-1细胞的成球能力.在mRNA和蛋白水平,CTAB均一致降低了CD44和CD133的表达.因此,CTAB可以调控乳腺癌干细胞来抑制乳腺癌ZR-75-1细胞的迁移.因此,CTAB可作为乳腺癌转移治疗的潜在化合物,且是通过调控乳腺癌干细胞实现的.
在肿瘤转移过程中,肿瘤细胞会面临巨大的挑战,包括在系统循环中的失常和剪切应力诱发的细胞凋亡,在远处器官定植时的高氧化应激,以及暴露于新的恶劣环境中的代谢应激[20].当前研究已表明代谢重编程赋予转移性癌细胞适应代谢应激和氧化应激等不利环境的能力.AMPK是AMP激活的蛋白激酶,由3个亚基组成的异源三聚体复合物:带有蛋白激酶催化结构域的α亚基(由蛋白激酶AMP激活的α(PRKAA)编码)和非催化性β(PRKAB)、γ(PRKAG)调节亚基,是哺乳动物组织中细胞代谢和能量稳态的主要调节器[21-22].关于AMPK和癌症转移的关联已有较多研究.脂联素治疗增加LKB1的表达,提高AMPK活性,从而抑制乳腺癌细胞的黏附,迁移和侵袭能力被抑制[23].Cai等的研究结果显示在小鼠转移模型中激活的AMPK驱动丙酮酸脱氢酶复合物(PDHc)活化以维持三羧酸循环(TCA循环)并通过使癌细胞适应代谢和氧化应激来促进癌症转移[20].另一方面,课题组之前的研究也说明了CTAB可通过激活AMPK在体外和体内增强乳腺癌对阿霉素(DOX)的药物敏感性[12].那么CTAB是否通过调控AMPK来影响乳腺癌细胞干性进而影响肿瘤转移值得进一步探讨.
本研究的实验结果初步证明CTAB具有良好的抑制乳腺癌细胞转移作用.CTAB作为纳米材料的打孔剂被认为应该完全去除,本研究提示了一定浓度的CTAB对乳腺癌细胞有杀伤作用,并且课题组先前的研究证实CTAB可以提高乳腺癌细胞对DOX的敏感性以及CTAB促进乳腺癌细胞凋亡,因此本文为CTAB能够应用于未来乳腺癌的治疗及其成药潜力提供了一定的理论依据.本研究还存在一些局限性,下一步将使用更多的乳腺癌细胞系来确定CTAB对乳腺癌干性以及转移的调控作用.进一步的研究将使用小鼠乳腺癌转移模型,集中说明CTAB在体内对乳腺癌转移的作用以及CTAB对体内癌细胞干性的调控作用.
4 结 语
长碳链季铵盐类化合物CTAB可以抑制乳腺癌CD44+/CD133+双阳性干细胞比例和干性标记物CD44和CD133的表达.本实验证实CTAB具有抑制乳腺癌干性进而调控乳腺癌转移的潜力.CTAB给药或许是乳腺癌转移治疗的新策略.

