两种布洛芬给药方式治疗早产儿动脉导管未闭的临床观察
王洲洪,李格花,黄少玲,黄春贞,邓福先
(南宁市第一人民医院,广西 南宁 510022)
动脉导管开放是胎儿在子宫内赖以生存的一条生理性通道。当胎儿出生后,新生儿开始自主呼吸,肺膨胀并承担气体交换功能,肺循环和体循环各司其职,动脉导管因用进废退而自动闭合。足月儿出生后10~15h动脉导管即开始发生功能性关闭,目前动脉导管未闭(patent ductus arteriosus,PDA)是指出生后新生儿动脉导管开放持续72h以上[1]。新生儿PDA是一种常见的先天性心血管畸形,占先天性心脏病的10%~21%,多见于女性,早产儿随着胎龄的降低发病率明显增加[2]。国外文献报道超低出生体质量儿(extremely low birth weight infants,ELBWIs)PDA发生率高达40%~60%[3],体重<1 000g的早产儿发病率可高达80%[4]。目前由于药物的早期干预,新生儿的后期动脉导管自然闭合概率开始变得不明确[5]。PDA所致的导管水平分流可引起肺/体循环改变,肺循环淤血,肺循环血流增加,体循环血量减少,重新分布各脏器血流量,诱发多种并发疾病,例如新生儿支气管肺发育不良(bronchopulmonary dysplasia,BPD)、充血性心力衰竭、肾损伤、脑室内出血(intraventricular hemorrhage,IVH)、早产儿视网膜病(retinopathy of prematurity,ROP)、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、喂养不耐受(feeding intolerance,FI)等,也影响了早产儿存活率,严重者危及生命[6]。目前临床上内科治疗多以药物促进动脉导管闭合,本研究选取近3年我院新生儿科符合血流动力学改变显著PDA(hemodynamically significant PDA,hsPDA)[7-8]患儿病例,采取口服及经直肠给药两种给药方式,根据患儿动脉导管关闭情况及不良反应比较两种给药方式的优缺点。
1 研究对象与方法
1.1 研究对象
选取南宁市第一人民医院2017年6月至2020年6月收治的276例诊断符合hsPDA而给予布洛芬药物治疗的早产儿作为研究对象。详细记录早产儿一般资料,包括性别、胎龄、日龄、体重及相关诊断和临床症状。276例早产儿根据给药方式的不同分为观察组(经直肠给药)和对照组(口服给药)各138例。其中,男119例,女157例;出生胎龄在25~34周237例,34+1~36+6周39例;出生体重680~3 100g。观察组与对照组出生后禁食的比例差异有统计学意义(χ2=19.256,P<0.05),其他资料两组间差异均无统计学意义(P>0.05),见表1。本研究获得医院医学伦理委员会批准,患儿监护人均签署知情同意书。
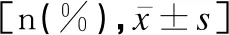
表1 两组患儿出生时临床资料Table 1 Clinical data of infants at birth in the two
1.2 纳入标准
目前hsPDA的定义尚无统一标准,本研究采用以下定义:心脏超声明确存在①左向右分流(或双向双期分流);②左心房与主动脉根部比值>1.3;③动脉导管直径>1.5mm且有以下临床征象之一:心脏杂音、水冲脉、心动过速、心前区搏动增强、脉压差增大、呼吸情况恶化[9]。同时选取必须禁食者包括频繁呕吐、食道闭锁、十二指肠狭窄、十二指肠闭锁而直肠功能正常者18例纳入观察组。
1.3 排除标准
①动脉导管水平右向左分流的严重先天性心脏病,如右向左分流的房间隔缺损/室间隔缺损及法洛四联征等;②Ⅲ级及以上IVH;③血清肌酐水平>159.1mmoL/L,尿量<1mL-1·kg-1·h-1;④严重感染;⑤血小板数量<60×109/L;⑥凝血功能障碍有出血倾向;⑦肺动脉压≥40mmHg[10];⑧NEC;⑨其他原因不能继续治疗者;⑩有布洛芬使用禁忌症者。
1.4 治疗方法
使用美国GE公司生产的Vivid7彩色多普勒超声诊断仪,S8-3探头(频率8MHz)。安静状态下进行常规心脏超声切面检查诊断PDA。所有患儿均采用综合性治疗,包括限液、静脉营养、呼吸支持、肺表面活性物质应用、防治感染及出血、预防和治疗并发症。根据患儿消化道情况酌情增减奶量。
布洛芬治疗方法:口服或经直肠给予布洛芬混悬液(国药准字H19991012;规格:15mL,0.6g/瓶),首剂10mg/kg,第2、3剂为5mg/kg,每剂间隔24h[11-12],3次给药完毕后24h复查心脏超声了解动脉导管闭合情况,未闭合且动脉导管直径>1.5mm者再次用药3天1个疗程。①口服:予以布洛芬口服或经胃管注入;②直肠灌注给药:先清洁排便,抽取布洛芬混悬液,用预先温热的小号胃管经肛门插入4~5cm后缓慢推入(1min左右推完),之后拔出导管,轻揉臀部,抬高臀部5~10min后恢复原体位。
1.5 观察指标
两组治疗前后分别检查头颅彩超、血常规、肝肾功能、尿量、前列腺素E2(prostaglandin E2,PGE2),用药期间观察两组患儿是否有少尿、胃出血、IVH、NEC、BPD、新生儿持续肺动脉高压(persistent pulmonary hypertension of the newborn,PPHN)、喂养不耐受等并发症。治疗4天后,两组患儿分别复查心脏超声,观察并记录动脉导管的闭合情况,测量PDA肺动脉端未闭内径。
1.6 统计学方法

2 结果
2.1 两组动脉导管直径变化
治疗前,观察组患儿动脉导管直径最大为4.9mm,最小为1.7mm,对照组最大为5.1mm,最小为1.6mm。治疗前、后两组动脉导管直径差异均无统计学意义(P>0.05)。治疗后,观察组动脉导管闭合114例(82.60%),对照组闭合109例(78.98%),两组差异无统计学意义(P>0.05)。左心房内径∶主动脉内径(ratio of the left atrium to aorta diameter,LA∶AO)在治疗前均大于1,治疗后接近于1,两组差异无统计学意义(P>0.05),见表2。
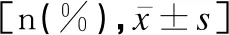
表2 两组心脏超声检查动脉导管直径的比较Table 2 Comparison of arterial catheter diameter in cardiac ultrasonography between the two
2.2 两组治疗前后实验室指标变化
治疗后,观察组、对照组患儿的血小板均轻度下降,肌酐、尿素氮均轻度上升,但两组间差异均无统计学意义(P>0.05);两组PGE2、总胆红素(total bilirubin,TBIL)水平差异也均无统计学意义(P>0.05),见表3。

表3 两组实验室指标变化Table 3 Changes of laboratory indicators in the two
2.3 两组并发症及死亡情况
观察组与对照组在少尿、PPHN、IVH、BPD、ROP及死亡人数方面差异均无统计学意义(P>0.05),观察组胃出血、NEC及FI的发生率均低于对照组,差异均有统计学意义(P<0.05),见表4。

表4 两组并发症及死亡发生情况[n(%)]Table 4 Occurrence condition of complications and deaths in the two groups[n(%)]
3 讨论
3.1 早产儿PDA发病相关因素
目前研究发现,早产儿PDA的发生除了与自身动脉导管的组织发育不成熟、不易发生重塑有关外,还与动脉导管对氧、血管活性物质的反应异常有关;遗传因素也参与了早产儿PDA的发病[13]。肺的扩张、肺血管阻力的降低、氧含量的增加、体循环阻力的增加、前列腺素(prostaglandin,PG)的降低等因素促使动脉导管闭合,而动脉血氧分压升高、局部和循环中PGE2浓度下降是引起动脉导管闭合的最重要的原因[14]。血小板计数减少与HsPDA发病率无明显关系[15]。
3.2 前列腺素对PDA作用机制探讨
早产儿PDA的一般治疗包括限制液量、利尿等对症处理;PDA的特殊药物为环氧合酶(cyclooxygenase,COX)抑制剂,如布洛芬、吲哚美辛和对乙酰氨基酚等。PG由花生四烯酸在前列腺素合成酶的作用下生成的一类旁-自分泌激素,在不同部位产生的前列腺素类型不一样,通常对邻近组织起作用。在动脉导管壁内合成的PGE2通过与其特异性G蛋白耦联受体(prostaglandin E2receptor 1-4,EP1-4)结合,激活腺苷酸环化酶,增加cAMP浓度,抑制收缩蛋白对钙离子的敏感性,使导管舒张,现在仍然认为PGE2是维持导管开放最强力、最重要的前列腺素类物质[16]。目前降低PGE2水平是内科治疗新生儿PDA的主要方法。布洛芬是芳基丙酸类非选择性环氧合酶抑制剂,能够抑制PG合成,降低血液循环中PG水平,促使动脉导管闭合,早已经被美国FDA批准用于治疗新生儿PDA,渐渐取代了吲哚美辛[17],目前在国外也还有吲哚美辛灌肠方法治疗的报道[18]。
3.3 经直肠给药在早产儿的临床应用
直肠给药主要用于无法口服的患者[19]。在我国古代早已有直肠给药的用药方式,东汉时期张仲景在《伤寒论》中首创了肛门栓剂和灌肠术。小儿直肠黏膜血液循环旺盛,吸收能力很强,药物可以通过3条途径进入血液循环。直肠灌注溶液时,主要经直肠肛门周围两个静脉丛吸收到下腔静脉,快速分布全身,直肠中下段及肛门的黏膜较厚且血管丰富,在此部位药物可获得迅速充分的吸收。因直肠中下段血流不经肝脏直接返回体循环,经直肠给药50%~75%可回避肝脏首过代谢,提高其生物利用度[20]。还可以通过直肠淋巴系统吸收后,经乳糜池,胸导管进入血液循环。布洛芬经直肠给药在儿童及成人已经较多栓剂运用,用药后布洛芬经直肠吸收,达峰时间(time-to-maximum,Tmax)为10~12min,且无明显的后滞时间,峰浓度(concentration maximum,Cmax)为(13.88±1.92)mg/L。蛋白结合率为99%,本品主要在肝内代谢,绝大部分经肾由尿液排出,其中的1%为原形物,一部分随粪便排出,两种制剂具有生物等效性。有研究显示经直肠灌注给药的生物利用率是口服给药的2倍,且无副反应及后遗症。从本研究的数据可以看出:布洛芬经直肠给药在动脉导管关闭率、PPHN、IVH、ROP、BPD、PGE2浓度、血小板减少、少尿、肌酐、尿素氮、病死率方面与口服给药差异均无统计学意义(P>0.05)。这与国外文献报道一致[21]。有研究显示早期喂养,喂养量大的早产儿布洛芬口服后1周内,消化道出血、NEC的发生率较少[22]。但比较副作用及不良反应,本研究中已经喂养的患儿布洛芬经直肠给药后,发生消化道疾病如胃出血、NEC、喂养不耐受的比例低于对照组。尤其对食道闭锁、十二指肠畸形、NEC患儿,在评估患儿病情后部分患儿仍能给予布洛芬经直肠给药治疗HsPDA。
综上所述,布洛芬经直肠给药吸收快,能与口服布洛芬达到相同的治疗hsPDA效果,减少了胃出血、NEC、喂养不耐受的发生,简单、安全、方便,还适用于一些不能口服但是可以直肠给药的患儿,目前我科未发现直肠方面任何不良反应,值得临床应用推广。

