电针调节肝脏PPARα、GLUT4表达改善ZDF大鼠糖脂代谢的机制研究*
段浩茹,李 瑞,李秋艳,庄舒婷,宋姗姗
(北京中医药大学,北京 100029)
2型糖尿病(Type 2 Diabetes Mellitus,T2DM)是一种以胰岛素抵抗(Insulin Resistance,IR)合并胰岛素相对分泌不足为特点的代谢紊乱性疾病,常伴有脂代谢异常。越来越多的文献证明,脂代谢紊乱不是以往认为的继发于T2DM之后,而是引起IR的重要原因。单纯降糖已不再是治疗T2DM的终极目标,应联合治疗血糖、血脂紊乱[1]。研究发现,脂肪细胞因子可参与T2DM发生发展[2],而肝脏作为能量代谢的重要器官能够通过葡萄糖转运子4(Glucose transporter-4,GLUT4)、过氧化物酶体增殖物激活受体α(Proliferator-activated receptorα,PPARα)发挥调节糖脂代谢的作用[3-4]。针刺调节T2DM血糖、血脂水平疗效肯定,已被WHO列为可行的治疗方式之一[5],但其发挥作用的具体机制仍未完全阐明,故本研究以IR伴肥胖的自发型糖尿病动物模型Zucker糖尿病肥胖(Zucker Diabetic Fatty,ZDF)大鼠为研究对象,以低频电针为干预手段,探索电针调节糖脂代谢的机制,为临床应用提供科学依据与指导。
1 实验方法
1.1 实验动物
8周龄SPF级雄性ZDF(fa/fa)大鼠14只,体质量175~225 g,同期出生8周龄雄性Zucker瘦型(Zucker Lean, ZL)(fa/+)大鼠7只,体质量140~180 g。动物购买自北京维通利华生物科技有限公司[许可证号:SCXK(京)2016-0006]。饲养环境温度23 ℃,相对湿度60%,空气流通,12 h昼夜循环光照。所有动物普通饲料适应性喂养1周后改用purina#5008饲料诱导成模。实验过程遵循2006年国家科学技术部发布的《关于善待实验动物的指导性意见》的规定。
1.2 实验材料
Purina#5008饲料(美国PMI营养国际有限公司,成分:粗脂肪7.1%,粗蛋白24.0%);罗氏ACCU-CHEK performa血糖仪(罗氏血糖健康医护公司);罗氏血糖试纸(罗氏血糖健康医护公司);华佗牌电针仪(苏州医疗用品厂有限公司);无菌针灸针(0.22 mm×13 mm,北京中研太和医药有限公司);PPARα兔多克隆抗体(货号:15540),GLUT4鼠单克隆抗体(货号:66846),GAPDH兔多克隆抗体(货号:10494),均购自美国Abcam公司。
1.3 模型制备与动物分组
所有动物均以purina#5008饲料诱导饲喂4周并以空腹血糖及餐后2 h血糖均>11.1 mmol/L为成模标准。成模后的ZDF大鼠按空腹血糖高低随机区分为模型组和电针组,7只ZL大鼠为空白组。造模及电针干预期间均以purina#5008饲料喂养。
1.4 干预方法
电针组:将大鼠以自制鼠套固定并暴露下肢及背部,静置5 min待大鼠适应及情绪稳定后,针刺大鼠双侧脾俞、胰俞、后三里和三阴交穴,取穴及针刺方法按照《实验针灸学》[6]进行。捻转针身使针下有紧实感后连接电针仪,接入低频15 Hz连续波,电流输出强度以引起大鼠肌肉轻微抖动且无剧烈挣扎为度。电针接入穴位为同侧胰俞、后三里,隔日换对侧。留针20 min,1次/d,1周6次,连续干预4周。模型组、空白组则进行与电针组同样的抓取与固定4周。
1.5 样本采集及指标检测
干预结束后,大鼠禁食不禁水12 h后,以2%戊巴比妥钠溶液进行腹腔注射麻醉。腹主动脉取血后室温静置2 h,4 ℃,3 000 r/min,离心15 min后取上清液,以放射免疫法检测血清相关指标。大鼠处死后,取大鼠肝脏组织,冻存于-80 ℃冰箱,以Western Blot法检测PPARα、GLUT4蛋白表达。
1.5.1 空腹血糖及OGTT试验曲线下面积 自造模起至电针干预结束后每周末采用尾尖取血法检测并记录各组大鼠空腹血糖(FBG)。电针干预前后对所有大鼠以50%的葡萄糖溶液按2 g/kg灌胃,检测灌胃前空腹血糖及灌胃15 min、30 min、1 h和2 h时间点的血糖,并绘制曲线图,计算曲线下面积(OGTT-AUC)。
1.5.2 空腹血脂、血清胰岛素以及血清脂肪细胞因子水平 以放射免疫法检测血清胰岛素(INS)、甘油三酯(TG)、胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、极低密度脂蛋白(vLDL)、游离脂肪酸(FFA)、脂联素(ADP)、抵抗素(Resistin)、瘦素(LEP)及肿瘤坏死因子α(TNF-α)水平。计算胰岛素抵抗指数,计算公式为:胰岛素抵抗指数(HOMA-IR)=(空腹血清胰岛素含量×空腹血糖含量)/22.5。
1.5.3 Western Blot法检测PPARα、GLUT4蛋白表达水平 肝脏组织于研钵中加入液氮后快速研磨成粉末,每100 mg粉末组织中加入1 mL裂解液(含10 μL蛋白酶抑制剂)混匀,冰上静置30 min,4 ℃,10 000 rpm离心15 min后取上清液。BCA蛋白定量后加入5×loding buffer蛋白变性,确保每个样品蛋白上样量一致。制胶(10%SDS-聚丙烯酰胺凝胶分离胶),上样(20 μg),电泳(浓缩胶,60 V,20 min;分离胶,80 V,60 min),电转(80 V,75 min)。于5%脱脂奶粉(TBST配置)中室温封闭1.5 h,加入一抗4 ℃孵育过夜(通用型抗体稀释液配置。PPARα, 1∶1 000; GLUT4,1∶5 000;GAPDH,1∶50 000),二抗室温孵育1.5 h(5%脱脂奶粉配置,1∶10 000),后采用ChemiDoc MP全能型成像系统曝光。采用Image J软件计算条带灰度值进行统计分析。
1.6 统计学处理
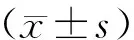
2 实验结果
2.1 各组大鼠一般状态比较
造模前,3组大鼠体型相似,均为瘦长型,精神状态良好且活动灵活,毛发有光泽,饮食及大小便均正常;成模后,空白组一般状态变化不明显,模型组与电针组大鼠体型明显肥胖,精神较萎靡,水平爬行及爬高次数均减少,毛发光泽度降低且有断毛现象,饮食饮水增加,排便排尿量明显增多,并具有明显异味;电针干预后大鼠较模型组体型变化不明显,活动状态、精神状态、皮毛色泽及断毛现象改善,饮食饮水变化不明显,排便情况有所改善。
2.2 各组大鼠FBG及OGTT试验曲线下面积变化情况
电针干预前,模型组大鼠FBG、OGTT-AUC明显高于空白组,差异有统计学意义(P<0.01);与电针组比较差异无统计学意义(P>0.05)。干预后模型组FBG、OGTT-AUC与空白组比较显著升高,差异有统计学意义(P<0.01);电针组FBG、OGTT-AUC与模型组比较明显下降,差异有统计学意义(P<0.01),提示电针具有一定降糖效应。见表1、图1。

表1 各组大鼠干预前后FBG、OGTT-AUC变化情况

图1 各组大鼠干预前后OGTT试验曲线图
2.3 各组大鼠血清INS含量及HOMA-IR比较
干预结束后与空白组比较,模型组血清INS含量及HOMA-IR升高,差异有统计学意义(P<0.01);与模型组比较,电针组血清INS含量及HOMA-IR降低,差异有统计学意义(P<0.01)。见表2。

表2 各组大鼠空腹血清INS、HOMA-IR比较
2.4 各组大鼠血清TC、TG、HDL、LDL、vLDL及FFA含量比较
干预结束后与空白组比较,模型组血清TC、TG、HDL、vLDL及FFA含量升高(P<0.01),LDL含量升高(P<0.05);与模型组比较,电针组血清TC、HDL、LDL、vLDL及FFA含量降低(P<0.01),血清TG含量虽有下降趋势,但差异无统计学意义(P>0.05)。见表3。

表3 各组大鼠血清TC、TG、HDL、LDL、vLDL及FFA水平比较
2.5 各组大鼠血清脂肪细胞因子含量比较
干预结束后,与空白组相比,模型组血清ADP含量降低,血清LEP、Resistin及TNF-α含量升高(P<0.01);与模型组相比,电针组血清ADP含量上升,血清LEP、Resistin及TNF-α含量下降(P<0.01)。见表4。

表4 各组大鼠血清脂肪细胞因子水平比较
2.6 各组大鼠肝脏PPARα、GLUT4蛋白表达情况比较
与空白组比较,模型组大鼠肝脏PPARα、GLUT4蛋白表达明显降低,差异有统计学意义(P<0.01);与模型组比较,电针组大鼠肝脏PPARα、GLUT4蛋白表达增高,差异有统计学意义(P<0.05或P<0.01)。见表5、图2。

表5 各组大鼠肝脏PPARα、GLUT4蛋白表达情况比较

图2 各组大鼠肝脏PPARα、GLUT4蛋白表达结果
3 讨论
2型糖尿病及其并发症发病率逐年上升,对人类健康及国家医疗支出形成了极大的威胁,因此T2DM动物模型的选择及安全的治疗方式成为迫切需要解决的全球性难题。ZDF大鼠是高血糖Zucker(Zuker fatty rat)大鼠的1个亚系,与之相比肥胖程度有所减轻而IR更加明显,雄性ZDF大鼠在5%脂肪含量饮食的饲喂条件下,几乎100%会发生糖尿病,饮食脂肪含量的增加可加速这一进程,是理想的糖尿病胰岛素抵抗动物模型之一,而雌性大鼠只有经专门的高脂饮食诱导才能发展为糖尿病;ZL大鼠是瘦型非糖尿病的动物模型,外表与ZDF大鼠无明显差别,常用于ZDF大鼠的空白对照[7-8]。
研究已证明[9-11],电针能够调节糖脂水平,有效治疗T2DM及胰岛素抵抗,不仅无毒副作用,还能大大降低患者医疗开销,缓解社会经济负担,是中医学在现代的继承与发扬。本研究基于导师李瑞教授多年丰富的临床经验及以往科研成果提出滋阴清热穴组治疗T2DM。针对消渴病阴虚燥热之病机,选择“养阴要穴”三阴交以滋阴补肾,足三里以清阳明燥热,脾俞以运化津液,胰俞为治疗消渴病的经验要穴且位于胰腺的同神经节段支配区域,其降糖效果十分明显,优于其他背俞穴[12]。以上四穴清滋并举、扶正祛邪,共奏调理脏腑气血津液失衡之功。本研究经4周干预发现,与模型组比较,电针可控制持续purina#5008饲喂条件下ZDF大鼠血糖的上升趋势,缓解脂代谢紊乱,改善胰岛素抵抗状态。但值得注意的是,在人体内作为保护性因子存在的HDL,在空白组ZL大鼠血清内含量较低,ZDF糖尿病大鼠体内反而是升高的,电针干预可降低其水平,这与Zhou Y、宋姗姗等[13-14]的研究结果一致,其发生机制有待进一步探索。
肝脏是重要的能量代谢场所,也是胰岛素作用的主要靶器官之一,在糖脂代谢中发挥重要功能。从肝脏调节糖脂代谢入手,对探索2型糖尿病的发病及治疗机制具有重要作用。葡萄糖转运子4(Glucose transporter-4, GLUT4)是葡萄糖转运的主要载体蛋白,是胰岛素信号通路下游的重要分子,通过跨膜转运以促进葡萄糖的摄取,在肝脏组织葡萄糖利用中发挥限速作用[15]。T2DM小鼠肝脏中GLUT4表达降低,是肝脏胰岛素抵抗的重要原因之一[16]。本研究发现,ZDF大鼠肝脏GLUT4蛋白表达下降,而电针可提高其表达进而发挥降糖作用,缓解ZDF大鼠的IR状态。过氧化物酶体增殖物激活受体α(Proliferator-activated receptorα,PPARα)属于核受体超家族成员,与IR的发生发展亦密切相关[17]。其作为脂质供给的总感受器,在组织中广泛表达,参与调节脂肪酸的跨膜运输与氧化分解,进而降低游离脂肪酸的堆积以及血脂浓度。PPARα还可调节胰岛素敏感性,研究发现PPARα敲除的小鼠更容易出现IR[18-19]。本研究结果显示,电针可上调ZDF糖尿病大鼠肝脏中PPARα蛋白的表达,进而调节各项血脂水平,从而改善脂代谢、减轻IR。
近年来研究发现,脂肪细胞因子包括脂联素(ADP)、瘦素(LEP)、抵抗素(Resistin)和肿瘤坏死因子(TNF-α)等在内,能够调节血糖血脂水平,调控胰岛素信号通路,介导多种代谢性疾病的进程[2]。其中ADP属于保护性细胞因子,具有胰岛素增敏性,可通过增强胰岛素活性、抑制糖异生关键酶来降低血糖;还可促进脂质分解进而改善脂代谢紊乱[20]。研究发现,脂联素可促进胰岛素信号通路的传导,与胰岛素及血糖的下降关系密切[21]。LEP可增加能量消耗,抑制脂质合成。IR时常伴LEP抵抗,其无法发挥正常功能,对胰岛素的反馈作用减弱,进而加重高胰岛素血症及T2DM的病情[22]。Resistin因升高血糖、拮抗胰岛素作用而命名,不仅能改变胰岛素信号通路受体及其底物的结构而介导IR,还能降低外周组织对胰岛素的敏感性,抑制血糖的摄取利用。此外,抵抗素促进脂肪分解、减弱胰岛素抑制脂解的功能可导致游离脂肪酸增加,进一步促进IR[23]。据研究报道,TNF-α参与促炎、免疫反应外,也可促进脂肪细胞脂解,进而加速肥胖和IR的进程[24]。本研究结果可见,与空白组比较,模型组大鼠血清LEP、TNF-α和Resistin水平上升,ADP水平降低,提示脂肪细胞因子共同参与了ZDF大鼠T2DM糖脂代谢紊乱的发生发展。而电针能够发挥整体调节作用,上调ADP的同时下调LEP、Resistin及TNF-α的含量,进而调节糖脂代谢、缓解IR。
综上所述,电针可提高ZDF大鼠肝脏PPARα、GLUT4蛋白表达,调节血清脂肪细胞因子分泌,进而发挥降糖降脂、缓解IR的作用。而电针是否作用于其他组织、细胞靶点发挥作用,脂肪细胞因子是否能够作用于上下游分子以调节PPARα、GLUT4表达从而改善糖脂代谢,以及不同参数电针降糖降脂的疗效如何,电针预刺激是否能预防、延缓T2DM及IR发生发展,笔者将会在接下来的研究中进一步阐明。

