电针预处理对脑缺血再灌注损伤大鼠TGF-β-Smads信号通路作用机制研究*
全爱君,魏 巍,蔡国锋,焦敏娜,李世伟,尚莉莉
(黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001)
脑缺血一定时间后再次恢复血液供应,机体会出现更加严重的组织损伤和功能障碍,造成大面积的脑梗死,甚至出现致死性脑水肿、脑出血等症状[1]。在溶栓治疗和栓子切除术后常伴随着脑缺血再灌注损伤情况,且脑缺血再灌注损伤尚无特异性的预防和治疗措施[2]。脑缺血核心区细胞缺血缺氧坏死、再灌注过程引发炎症反应等均可引起细胞凋亡,各种不同分子机制最终导致细胞死亡,其过程涉及多条信号通路,其中TGF-β-Smads信号通路为本研究重点[3-5]。TGF-β是一类具有多种生物学活性、多重调控功能的细胞因子,在体内分布广泛,作用明显。在生理情况下,大脑的很多区域都不表达TGF-1β,但是在缺血缺氧的情况下,其表达却大幅上调[6],Caspase3为脑缺血后细胞凋亡信号联级关键蛋白,是细胞杀伤机制中的重要组成部分。
研究表明脑缺血再灌注损伤与炎性损伤和兴奋毒性等机制有关[7-9]。电针预处理用于治疗冠心病、心绞痛、心肌梗塞和脑卒中等心脑血管类疾病。研究发现电针预处理具有改善微循环、抗血栓、抗氧化和促进组织恢复等作用[10-11]。电针预处理对脑缺血再灌注损伤的临床疗效明确,但其作用机制并不清楚,本实验旨在研究电针预处理对脑缺血再灌注损伤具有保护作用,对降低炎性因子及TGF-β/Smads信号通路作用影响最终抑制脑组织细胞凋亡,对脑缺血再灌注损伤起到保护作用。
1 材料
1.1 实验动物
清洁级SD大鼠(许可证号:SYXK黑2016002),体质量(240±10)g,由黑龙江中医药大学实验动物中心提供,饲养温度控制(23±2)℃,相对湿度45%~60%,实验前适应性饲养观察3 d。
1.2 药品与试剂
大鼠白介素1β(IL-1β)ELISA试剂盒(货号abs530002),大鼠肿瘤坏死因子α(TNF-α)ELISA试剂盒(货号abs530007)购自于爱必信生物科技有限公司;Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)双染细胞凋亡检测试剂盒(货号abs50001),TGF-β1抗体(货号abs130620),Smad4抗体(货号abs136955),Caspase3抗体(货号abs119676),均购自于爱必信生物科技有限公司;抗GAPDH抗体购自于苏州瀛睿生物技术有限公司;辣根酶标记山羊抗兔lgG(H+L)购于北京中杉金桥;化学发光仪(Bio-Rad,型号:10017141)。
2 方法
2.1 实验分组
48只健康SD大鼠,体质量(240±10)g,由黑龙江中医药大学实验动物中心提供,实验前适应性饲养观察3 d。将大鼠完全随机分为假手术组、模型组和电针预处理组。模型组、电针预处理组大鼠进行脑缺血再灌注模型制备。所有实验动物操作均符合实验动物伦理学要求。
2.2 脑缺血再灌注损伤模型建立
将连续给药7 d的各实验组动物按照Longa线栓法改良制作大鼠局灶性脑缺血/再灌注损伤模型。称量大鼠体质量并且按体质量麻醉,腹腔注射给予10%水合氯醛进行麻醉,颈前术区脱毛、消毒,沿颈部正中线切开皮肤,逐层分离暴露右侧颈总动脉、颈外动脉和颈内动脉,结扎颈总动脉和颈外动脉,用动脉夹夹闭颈内动脉远心端后,在颈内动脉上距离颈总动脉分叉处约2 mm处做一切口,将备好的线栓经切口处插入大脑中动脉始端,栓塞大脑中动脉,造成局灶性脑缺血。缺血2 h后拔除栓线并实施再灌注24 h。
2.3 干预方法
2.3.1 假手术组 假手术大鼠使用与模型组相同的处理手段,但不插入线栓对大脑中动脉进行阻闭,不进行电针预处理。
2.3.2 模型组 大鼠进行模型制备,不给予电针干预,其他处理方法均与电针预处理组一致。
2.3.3 电针预处理组 造模前先进行电针干预,参照华兴邦等制定的《大鼠穴位图谱的研制》取穴,取百会穴、神庭穴和曲鬓穴,以0.40 mm×0.25 mm毫针,15°角针刺,斜刺进针2 mm,百会穴连正极,神庭穴连负极,连成一组,曲鬓穴连成一组,针刺后施以电针(电流0.3 mA,疏密波,疏波频率20 Hz,密波频率100 Hz);曲池和足三里穴,以0.40 mm×0.25 mm毫针,直刺进针,直刺2 mm,连电针,参数为:疏密波,刺激电流1~2 mA,频率2/15 Hz,波宽0.2~0.6 ms。通电10 min,留针不通电5 min,连续重复4次,共1 h,电针干预结束后观察30 min行造模手术。
2.4 大鼠脑组织炎性因子指标测定
大鼠脑缺血再灌注结束后,采集脑组织,取200 mg脑组织,加入2 mL的PBS(PH=7.4),用组织匀浆机进行充分匀浆,在3 000 r/min 离心20 min收集上清液,按照ELISA试剂盒说明书要求测定IL-1β、TNF-α。
2.5 Western blot检测
取缺血侧大脑组织100 mg置于1 mL组织细胞裂解液中,超声细胞破碎仪低温匀浆。12 000 r/min 4 ℃离心15 min,取上清,取2 μL蛋白溶液利用Direct DetectTMSpectrometer-Sample Measuring红外微定量分析仪直接检测蛋白浓度,取相同蛋白进行上样经SDS-PAGE电泳分离,将蛋白转移至PVDF膜上,转膜结束后,TBS-T洗膜2次,10 min/次,5%脱脂奶粉室温孵育2 h后,加入p-AKT、Caspase3和HIF-1α一抗工作液,4 ℃过夜, TBS-T缓冲液洗膜5次,10 min/次,加入二抗工作液,室温孵育1 h,TBS-T洗膜5次,10 min/次,采用ECL法显色。凝胶成像系统拍照并分析。
2.6 Annexin V-FITC/PI双染色法检测细胞凋亡水平
各组大鼠处死后取脑组织,取缺血侧脑块, 取200 mg脑组织,加入2 mL的PBS(PH=7.4),用组织匀浆机充分匀浆,加入适量PBS液,迅速制成2×106/mL的单细胞悬液。收集细胞悬液,过200目细胞筛,PBS洗3次,1 000 r/min离心10 min,终体积分数70%,预冷乙醇固定过12 h后取单细胞悬液,4℃ PBS洗2次,1 000 r/min离心5 min,取沉淀,在每一个样品管中加入10 μL的Annexin V-FITC,充分混匀后避光的条件下室温孵育15 min,孵育结束后再向每个样品管中加入300 μL的缓冲液,每个样品管中在加入PI进行染色5 min后,立即采用流式细胞仪检测细胞的凋亡率。
2.7 统计学处理
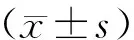
3 结果
3.1 电针预处理对脑缺血再灌注损伤炎性因子影响
假手术组中存在一定量的IL-1β和TNF-α,脑缺血再灌注后模型组脑组织中IL-1β和TNF-α含量明显高于假手术组(P<0.05);与模型组比较,灌胃给予电针预处理能够降低脑缺血再灌注后脑组织中IL-1β和TNF-α含量(P<0.05),表明电针预处理能够明显改善脑缺血再灌注引起的脑组织IL-1β和TNF-α含量的增加。见表1。

表1 脑组织内IL-1β和TNF-α含量变化
3.2 各组脑缺血再灌注损伤脑组织中的细胞凋亡影响
经统计分析显示,各组间细胞凋亡水平差异具有统计学意义(P<0.05),电针预处理组细胞凋亡率为(25.95±0.21)%、模型组凋亡率为(35.22±0.56)%,假手术组凋亡率为(1.02±0.21)%,比较结果发现与模型组比较电针预处理组细胞凋亡水平明显降低。见图1和表2。

图1 各组脑组织中细胞凋亡情况

表2 各组细胞凋亡率比较
3.3 各组脑缺血再灌注损伤脑组织中TGF-β1、Smad4和Caspase3蛋白表达影响
Western blot结果发现,模型组中TGF-β1、Smad4和Caspase3表达明显高于假手术组(P<0.05),与模型组比较,电针预处理组中TGF-β1、Smad4表达明显提高而Caspase3显著降低(P<0.05)。见图2和表3。

注:1.电针预处理组;2.模型组;3.假手术组。图2 Western blot检测脑组织TGF-β1、Smads4和Caspase3蛋白表达

表3 电针预处理对脑缺血再灌注损伤脑组织TGF-β1、Smad4及Caspase3蛋白影响
4 讨论
电针预处理是中医“治未病”理论思想的延伸和发展。针灸可以激发经气,疏通经络,调理阴阳之间的平衡,增强正气抑制邪气能力,从而达到未病先防、既病防变的作用[12]。大量临床研究证实,在常规治疗基础上加用针刺治疗,可以进一步改善脑缺血症状,能降低大鼠脑缺血再灌注后血浆中炎性因子的含量,降低炎症反应,从而实现脑组织保护机制[13]。
目前,电针预处理是临床上针灸常用方法之一,已广泛运用在防治脑缺血、脊髓缺血等多个研究领域,对缺血再灌注损伤后的心脑血管系统具有保护作用。电针预处理在脑缺血过程中可产生的脑组织保护效应,通过启动机体内源性的多种自我保护机制以抵抗随后发生的再灌注损伤[14-16]。百会、神庭穴均为督脉的重要穴位,与脑有着千丝万缕的联系,可以达到醒神开窍、行气活血的治疗作用。曲鬓穴,刺三分,灸三壮。主治颔颊肿引牙车不得开,口噤难言,项强不得顾,头角痛,巅风目眇。之前研究表明针刺“百会透曲鬓”,可显著抑制脑缺血再灌注后血管炎症因子表达,进而减轻白细胞浸润,降低了炎性递质对脑组织的损伤,对脑缺血组织的继续损伤,从而发挥了脑保护作用[17]。脑缺血再灌注损伤过程中常伴随着细胞因子、粘附因子和趋化因子的表达,促发炎症的级联反应,使脑组织由缺血性转变为炎症性损伤,脑缺血再灌注早期产生的炎性因子IL-1β和TNF-α促进了继发性的脑损伤[18-19]。本研究中发现与假手术组比较,模型组脑组织中炎性因子IL-1β和TNF-α含量明显增加,电针预处理干预能够明显降低脑组织中IL-1β和TNF-α表达,说明脑缺血再灌注损伤过程中炎性因子参与其中,电针预处理能够明显降低损伤性炎性因子的表达。本研究与Pradillo[20]和Maddahi[21]等研究结果相似,脑缺血再灌注损伤后给予IL-1受体阻断剂和TNF-α受体阻断剂均可减轻脑缺血再灌注损伤。
哺乳动物TGF-β家族目前已确定有3个亚型(TGF-β1、TGF-β2及TGF-β3),它们由不同的基因编码,但有高度同源性,可和同一型受体通过相同的信号途径发挥功能[22]。TGF-β是一类具有多种生物学活性、多重调控功能的细胞因子,其在体内分布广泛,作用明显。TGF-β能调控细胞增殖组织器官修复等过程。转化生长因子-β(TGF-β)是一种多功能蛋白,具有调节细胞增殖、分化、迁移及凋亡等多种细胞生物学效应[23]。Smads家族蛋白结构相似、功能多样,Smad2、Smad3蛋白激活时相互作用共同调节TGF-β1的信号传导。Smad4蛋白通过调节Smad3蛋白对其目标基因转录的能力,加强Smad3蛋白反应启动子活性,促进组织的形成与发展,在脑部疾病中具有重要作用[24-25]。Caspase3控制着凋亡程序的启动,被称之为凋亡的“分子开关”,其活性高低可反映脑组织部位的细胞凋亡情况。
为明确电针预处理脑缺血再灌注损伤大鼠的分子机制。免疫蛋白印迹实验发现,电针预处理组脑缺血再灌注后脑组织中,对比模型组TGF-β1与Smad4 蛋白表达均有所上调,并且caspase-3显著下调。流式细胞结果显示与假手术组相比模型组中细胞中凋亡显著增加,而电针预处理组可以显著抑制缺血侧大脑组织中细胞凋亡,说明电针预处理对缺血侧大脑组织中细胞抑制凋亡作用。综上所述,电针预处理可以调控哺乳动物中唯一公认的Co-Smad蛋白Smads4,从而激活TGF-β信号通路表达,Smads4充当TGF-β1信号传导途径的中心蛋白影响细胞增殖,并且通过下调caspase-3蛋白从而保护脑组织[26-27]。结合流式细胞分析结果推测证实电针预处理可能通过作用于Smads4从而激活TGF-β信号通路最终抑制细胞凋亡起到保护脑组织的作用。本研究分别从多个角度,系统的对保护脑缺血再灌注损伤大鼠作用进行了分析,明确了电针预处理对治疗缺血性脑组织造成的脑损伤的分子机制,为中医在临床治疗由于缺血造成的脑损伤提供了新的理论基础。

