右归丸对慢性肾脏病大鼠AQPs表达影响的研究
谢希,何清湖,陈平安,黄家望,朱梦晨,李玲
(1.湖南中医药大学中西医结合学院,湖南 长沙 410208;2.湖南中医药大学医学院,湖南 长沙 410208;3.湖南中医药大学中医学院,湖南 长沙 410208)
慢性肾脏病(Chronic Kidney Disease,CKD)已经成为世界范围内的公共卫生问题。据估计,全球CKD的患病率为8%~16%[1]。肾纤维化是各种进行性发展的肾脏疾病的共同归宿,以成纤维细胞和细胞外基质的过度增生为主要特征[2]。TGFβ-Smads信号通路的激活和炎症反应在肾纤维化的过程中发挥着重要作用[1,3]。水通道蛋白(Aquaporins,AQPs)是一类参与水分子运输的蛋白家族,能够介导自由水的跨生物膜转运。目前在哺乳动物体内已经发现了13种AQPs,其中包括AQP1、AQP2和AQP3在内的8种水通道蛋白在肾脏的不同部位表达[4]。肾纤维化动物模型肾组织中AQP1、AQP2和AQP3的表达显著降低,提示上调水通道蛋白的表达可能是延缓和改善肾纤维化的有效途径[5-7]。右归丸出自《景岳全书》,由熟地黄、枸杞、山茱萸、肉桂等药物组成,具有温补肾阳、填精止遗的作用,主要适用于肾阳不足,命门火衰,腰膝酸软等肾阳虚症状,临床应用和基础研究均表明右归丸对慢性肾脏病具有良好疗效[8-10]。但目前对于右归丸是否通过上调水通道蛋白的表达来改善肾纤维化损伤的研究较少。本研究通过腺嘌呤建立CKD大鼠模型,以右归丸为干预因素,探讨其对CKD大鼠肾组织中水通道蛋白表达的影响,以期为右归丸的临床应用提供实验依据。
1 实验材料
1.1 实验动物
SPF级雄性大鼠40只,体质量220~240 g,适应性饲养1周,购自湖南斯莱克景达实验动物公司,动物质量合格证号:SCXK(湘)2016-0002。
1.2 主要实验试剂
腺嘌呤(Sigma-Aldrich贸易有限公司,A8626),右归丸(北京同仁堂股份有限公司同仁堂制药厂,Z11021040),RIPA蛋白裂解液(CWBIO,CW2334S),BCA蛋白浓度测定试剂盒(CWBIO,CW0014S),SDS-PAGE凝胶制备试剂盒(CWBIO,CW0022),彩色预染蛋白marker(Fermentas),ECL发光检测试剂盒(Thermo Fisher,35055),TGF-β1抗体(Abcam,ab27969),Smad-2抗体(Abcam,ab33875),AQP1抗体(Bioss,bs-1506R)、AQP2(Bioss,bs-0261R)、AQP3 (Bioss,bs-1253R),β-actin抗体(Bioss,bsm-33036M),HRP标记羊抗鼠二抗(Proteintech,SA00001-1),HRP标记羊抗兔二抗(Proteintech,SA00001-2),大鼠TNFα Elisa试剂盒(Abcam,ab46070),大鼠IL-10 Elisa试剂盒(Abcam,ab100764)。
1.3 主要实验仪器
微量移液器(德国Eppendorf),水平摇床(北京六一仪器厂),台式高速冷冻离心机(美国Thermo),多功能酶标仪(美国Bio-tek,Synergy2),电泳仪(美国Bio-rad),垂直电泳槽(美国Bio-rad),电转槽(美国Bio-rad),石蜡切片机(美国A0820),化学发光成像分析系统(美国Bio-rad,ChemiDoc XRS+)。
2 实验方法
2.1 CKD大鼠模型建立及实验分组
将40只大鼠随机分为正常组、模型组、左卡尼汀组和右归丸组,参考YOKOZAWA T[11]的方法建立CKD大鼠模型,取腺嘌呤加纯水配制成30 mg·mL-1的混悬液,每只大鼠每日摄入剂量为150 mg·kg-1,正常组给予等量生理盐水灌胃,连续4周。模型建立后,按照动物体表面积换算法,大鼠临床给药剂量分别为左卡尼汀0.323 g·kg-1和右归丸2.913 g·kg-1,灌胃4周,水合氯醛麻醉后处理动物。
2.2 检测指标
2.2.1 HE染色观察大鼠肾组织病理学变化
取大鼠肾组织用4%多聚甲醛固定,乙醇梯度脱水,二甲苯透明,浸蜡,石蜡切片,HE染色,脱水,透明,封片,于显微镜下观察肾组织病理变化。
2.2.2 透射电镜观察大鼠肾组织超微病理学变化
取大鼠肾组织用2.5%戊二醛固定,经过常规电镜处理方法进行脱水、浸泡、包埋、固化、切片和染色等步骤,最后在透射电镜下观察。
2.2.3 免疫组织化学法检测肾组织中AQP1、AQP2和AQP3的蛋白定位与半定量表达情况
取大鼠肾组织用4%多聚甲醛固定,乙醇梯度脱水,二甲苯透明,浸蜡,石蜡切片,脱蜡,抗原修复,一抗孵育,PBS洗涤3次,滴加第二抗体,30 min后洗涤,滴加链霉素-亲和素-生物素复合物,30 min后洗涤,加DAB溶液进行显色,30 min后洗净,苏木素复染,随后脱水,透明,封片,于显微镜下观察肾组织染色情况,染色呈棕黄色为阳性,利用图像分析软件Image Pro Plus 6.0对图像进行信号分析,计算各视野的平均光密度值(IOD/Area)。
2.2.4 Western blot法检测肾组织中TGF-β1、Smad-2、AQP1、AQP2和AQP3蛋白的表达水平
取大鼠肾组织,RIPA裂解液提取肾组织总蛋白,BCA法测蛋白浓度,定量取50 μg蛋白变性,进行SDS-PAGE凝胶电泳。转膜后,5%脱脂奶粉封闭2 h,加入一抗β-actin、TGF-β1、Smad-2、AQP1、AQP2和AQP3多克隆抗体按照1∶1 000的比例稀释,4 ℃过夜,TBST洗3次,二抗1∶3 000比例稀释,37 ℃孵育1 h,洗涤后,加ECL显影,用化学发光成像仪进行显影,用图像分析软件Image J对图像进行信号分析,计算靶蛋白/β-actin的值。
2.2.5 酶联免疫吸附法检测大鼠血清中TNFα和IL-10表达水平
根据Elisa试剂盒说明书,检测各组大鼠血清中TNFα和IL-10的含量。
2.3 统计学方法
3 结果
3.1 右归丸对大鼠肾组织病理变化的影响
如图1所示,正常组大鼠肾小球、肾小管结构完整,大小均匀,肾组织未见坏死、未见炎性细胞浸润及水肿渗出;模型组大鼠肾组织大面积坏死,肾小球硬化,健存肾小球数量减少,肾小球上皮细胞脱落减少,肾小管管腔狭窄,管壁增厚,健存的管腔呈囊性扩张,其中有渗出和炎性细胞浸润,大量腺嘌呤晶体沉积。右归丸组和左卡尼汀组大鼠肾组织炎症反应程度显著好转,肾小球硬化和纤维化情况转轻。
3.2 右归丸对大鼠肾组织超微病理变化的影响
如图2所示,正常组大鼠肾脏肾小球滤过膜(三层:内层为内皮细胞、中间层为基底膜、外层为上皮细胞和足细胞)见高电子密度致密物沉积于肾小球基底膜内侧,内皮细胞下,大小不等的团块状,上皮细胞下偶见少量沉积物,基底膜局部轻微增厚。模型组大鼠肾脏肾小球滤过膜见上皮细胞肿胀,胞浆呈低电子密度,线粒体肿胀,脊断裂、消失呈低电子密度空泡状,细胞核核膜扩张;基底膜弥漫性高度增厚,基底膜中层粗大带状高电子致密物沉积,内皮细胞下、基底膜内侧见高电子致密物沉积,上皮细胞下、基底膜外侧和上皮细胞下见驼峰样高电子致密物沉积。右归丸组和左卡尼汀组的大鼠肾组织上述超微病理改变程度减轻。

图2 各组大鼠肾组织超微病理改变观察结果
3.3 右归丸对大鼠肾组织AQP1、AQP2和AQP3蛋白表达的影响
如图3和表1所示:AQP1主要表达于肾近曲小管,AQP2和AQP3主要表达于肾集合管。模型组大鼠肾组织中AQP1、AQP2、AQP3蛋白的表达水平显著降低(P<0.05)。药物干预后,右归丸组和左卡尼汀组大鼠肾组织中AQP1、AQP2、AQP3的表达水平均显著提高(P<0.05)。

图3 各组大鼠肾组织AQP1、AQP2和AQP3蛋白定位与表达水平

表1 各组大鼠肾组织AQP1、AQP2和AQP3蛋白平均光密度
3.4 右归丸对大鼠肾组织TGF-β1、 Smad-2、AQP1、AQP2和AQP3蛋白表达的影响
如图4和表2所示:模型组大鼠肾组织中TGF-β1、Smad-2蛋白的表达水平显著提高(P<0.05),AQP1、AQP2和AQP3蛋白的表达水平显著降低(P<0.05)。药物干预后,右归丸组和左卡尼汀组大鼠肾组织中TGF-β1和Smad-2的表达水平显著降低(P<0.05),AQP1、AQP2、AQP3的表达水平显著提高(P<0.05)。

图4 各组大鼠肾组织TGF-β1、Smad-2、AQP1、AQP2和AQP3表达水平

表2 各组大鼠肾组织TGF-β1、Smad-2、AQP1、AQP2和AQP3表达水平
3.5 右归丸对大鼠血清IL-10和TNF-α水平的影响
如表3所示:与正常组比较,模型组大鼠血清中TNFα水平显著提高,IL-10水平显著降低。与模型组比较,右归丸组的大鼠血清中TNFα水平显著降低,IL-10水平显著提高,差异均具有统计学意义(P<0.05)。
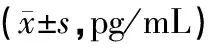
表3 各组大鼠血清TNFα和IL-10水平
4 讨论
慢性肾脏病是一种由肾脏损伤导致的隐匿性疾病,最终可能导致终末肾疾病,预后较差。肾小球滤过率(Glomerular Filtration Rate,GFR)是诊断CKD的最佳指标,当GFR小于60 mL/(min·1.73 m2),并持续3个月以上,即可诊断为CKD。许多慢性肾脏疾病的最终常见病理表现是肾纤维化。肾纤维化是由于慢性、持续性肾损伤后肾组织愈合不成功导致的,其特征是肾小球硬化,肾小管萎缩和间质纤维化。这些病理改变是导致肾小球滤过率下降的直接原因。
AQP1是最先发现的水通道蛋白,其主要分布于近端小管的顶端膜和基底侧膜,参与水的重吸收。AQP2主要位于集合管主细胞的顶端膜上,其重吸收功能主要受精氨酸加压素的调节。AQP3则位于集合管主细胞的基底侧膜[4]。研究表明[5,12],AQP1在肾纤维化中表达是降低的,它与肾纤维化中上皮-间质转化(EMT)密切相关,敲除促EMT相关基因后,AQP1表达显著升高,体外细胞实验则表明,用转化生长因子1(TGF-β1)刺激肾近曲小管上皮细胞后,AQP1蛋白表达水平显著下降,提示AQP1的表达与TGF-β1信号通路相关。AQP2是目前肾脏中研究最多的水通道蛋白,上调AQP2蛋白表达可减少肾纤维化大鼠尿量,改善肾脏功能[13]。AQP3可以通过激活MAPK信号通路,对肾脏和MDCK细胞凋亡起保护作用[14]。敲除AQP3基因后,AQP2蛋白表达也明显下调,小鼠表现出明显的尿液浓缩功能障碍[15],说明AQP2与AQP3表达是相互影响的。本研究通过Western blot、免疫组织化学技术,对大鼠肾组织中的AQP1、AQP2和AQP3蛋白表达水平进行检测,结果显示:与正常组比较,模型组的大鼠肾组织中AQP1、AQP2和AQP3蛋白表达水平均显著下降(P<0.05);与模型组比较,右归丸组和左卡尼汀组的大鼠肾组织中AQP1、AQP2和AQP3蛋白的表达水平均显著提高(P<0.05)。
TGFβ/Smads信号通路的激活是导致肾纤维化最重要的机制之一[3]。TGF-β主要通过诱导细胞凋亡、促进肌成纤维细胞合成细胞外基质、减少细胞外基质的降解和诱导不同类型的细胞转化为肌成纤维细胞从而诱导肾纤维化的产生[3,16]。本研究表明:与正常组比较,模型组的大鼠肾组织中TGF-β1和Smad-2的表达显著提高(P<0.05)。与模型组的大鼠比较,右归丸组和左卡尼汀组的大鼠肾组织中TGF-β1和Smad-2蛋白表达含量显著降低(P<0.05)。
大量证据表明炎症反应在肾纤维化的发生发展过程中起着重要作用[1]。肿瘤坏死因子α(TNFα)对于机体内环境的平衡极为重要,在细胞生存,凋亡,坏死以及细胞间通讯中发挥着重要作用,这些细胞生理功能的紊乱会造成机体的炎症[17]。TNFα可以刺激IL-1β、CCL2、TGFβ1的释放[18]。各种肾脏疾病患者体内的TNFα水平均增加[19-20]。通过降低TNFα的水平可以延缓CKD在各种动物模型中的进展[21]。白介素10(IL-10)作为一种免疫抑制细胞因子主要起限制炎症反应、上调免疫力和促进组织修复的作用,在感染和炎症过程中维持组织稳态[22]。有研究表明[23-24],IL-10可以抑制肾小球肾炎和肾小球硬化的发生,敲除IL-10基因后加重了肾损伤模型中的肾纤维化。本研究发现,与正常组的大鼠比较,模型组的大鼠血清中TNFα的水平显著升高,IL-10的水平显著降低;与模型组比较,右归丸组和左卡尼汀组的大鼠血清中TNFα的水平显著降低,IL-10的水平显著升高,差异具有统计学意义(P<0.05)。
综上所述,右归丸可能是通过抑制TGFβ/Smads信号通路的激活、提高AQP1、AQP2和AQP3蛋白的表达水平、抑制机体炎症反应、提高机体抗炎能力,改善肾纤维化,从而实现对慢性肾脏病大鼠的保护作用。但本研究尚有诸多不足之处,如右归丸对慢性肾脏病干预作用的量效关系,以及右归丸提高肾组织AQPs表达的具体机制及其发挥作用的物质基础等均有待进一步研究。

