南方果园蚁巢土壤微生物群落结构特征分析
肖健 孙妍 陈思宇 任奎瑜 杨尚东 唐小付


摘要:【目的】探究南方果园蚁巢土壤中特有的微生物资源及其功能,为探寻功能微生物资源及南方果园土壤的生态管理提供理论依据和技术支撑。【方法】以南方荔枝园中日本弓背蚁(Camponotus japonicus)的蚁巢土壤和非蚁巢土壤为研究对象,采用高通量测序技术,分析蚁巢和非蚁巢土壤微生物群落的结构特征。【结果】蚂蚁筑巢虽然对果园土壤微生物多样性及丰富度无显著影响(P>0.05),但明显改变了果园土壤中细菌和真菌群落的组成与占比。蓝细菌门(Cyanobacteria)和WPS-2细菌是蚁巢土壤特有的优势细菌门,但缺失了芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)等非蚁巢土壤中拥有的优势细菌门类;同时,与非蚁巢土壤相比,蚁巢土壤中变形杆菌门(Proteobacteria)和酸杆菌门(Acidobacteria)细菌丰度占比下降,放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi)细菌丰度占比提高。蚁巢土壤虽然拥有与非蚁巢土壤完全一致的门类水平真菌群落组成,均由子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)和unclassified_k__Fungi门组成,但优势菌门组成丰度占比发生变化,其中,蚁巢土壤中被孢霉门真菌丰度占比下降,而unclassified_k__Fungi门真菌丰度占比增加。Conexibacter、unclassified_f__Ktedonobacteraceae、norank_o__B12-WMSP1、norank_p__WPS-2、norank_o__ Chloroplast、分枝杆菌属(Mycobacterium)、 FCPS473、 鞘氨醇单胞菌属(Sphingomonas)、 norank_f__JG30-KF-CM45、 间孢囊菌属(unclassified_f__Intrasporangiaceae)和中华单胞菌属(Sinomonas)是蚁巢土壤中特有的优势细菌属;瘦脐菇属(Rickenella)、节丛孢属(Arthrobotrys)、梨孢霉属(Coniosporium)、unclassified_c__Eurotiomycetes、粗糙孔菌属(Trechispora)、 unclassified_o__Pezizales、unclassified_o__Pleosporales、Xepicula、茎点霉属(Phoma)和曲霉属(Aspergillus)是蚁巢土壤中特有的优势真菌属。【结论】蚁巢土壤中蕴含着丰富的具有分泌抗生素和生物修復功能的微生物资源,是一个潜在的生物资源宝藏。
关键词: 蚁巢;果园土壤;微生物群落结构;高通量测序
Abstract:【Objective】To explore the specific microorganisms and theirfunctionsin ant nests inorchards insouthern China,and provide the theoretical basis for seraching fuctional microorganism resourcesandsoil ecological management in orchards in southern China. 【Method】Soil samples, which collected from ant nests(AN) of Camponotus japonicus and non-ant nests(CK) inlychee garden in southern China, their characteristics of microbial community structures were analyzed using high-throughput sequencing technology. 【Result】Even though the microbial diversity and richness in soils of ant nests were not significantly affected by ant nest formation(P>0.05), the composition and proportion of bacteria and fungi in soils of ant nests were changed. Cyanobacteria and WPS-2 were the unique dominant bacterial phyla in soils of ant nests; by contrast, Gemmatimonadetes, Bacteroidetes and Verrucomicrobia were the specific dominant phyla in soils of non-ant nests. Moreover, compared to the non-ant nest, the proportions of soil bacteria at phylum level, such as Proteobacteria and Acidobacteria decreased, but Actinobac teria and Chloroflexi increased in soils of ant nests. In addition, the composition of fungi at phylum level was the samein soils between ant nests and non-ant nests, they were all formed with Ascomycota, Basidiomycota, Mortierellomycota and unclassified_k__Fungi. However, their proportions and abundances were changed in soils of ant nests which compared to non-ant nests. For example, compared to the soils of non-ant nests, the percentages of Mortierellomy cota decreased, but the unclassified_k__Fungi increased at phylum level in soils of ant nests. Meanwhile,Conexibacter,unclassified_f__Ktedonobacteraceae, norank_o__B12-WMSP1, norank_p__ WPS-2,norank_o__Chloroplast, Mycobacterium,FCPS473, Sphingomonas, norank_f__JG30-KF-CM45, unclassified_f__Intrasporangiaceae and Sinomonas were the unique dominant bacteria, and Rickenella, Arthrobotrys, Coniosporium, unclassified_c__Eurotiomycetes, Trechispora, unclassified_o__Pezizales, unclassified_o__Pleosporales, Xepicula, Phoma, Aspergillus were the specific dominant fungi in soils of ant nests at genus level, respectively. 【Conclusion】The abundant resources of benefit microorganisms, which have the functions of excretion of antibiotics and bio-remediation all can be found and accumulated in soils of ant nests. It suggests that the soil of ant nests is a potential treasure of biological resources.
Key words: ant nest; orchardsoil; microbial community structure; high throughput sequencing
0 引言
【研究意义】蚂蚁作为地球上重要的土壤无脊椎动物,几乎占据25%的陆地表面(Bottinelli et al.,2015)。据统计,全球已知约9500种蚂蚁,仍有2万种蚂蚁未知(Sasitorn et al.,2014)。蚂蚁被誉为“生态系统工程师”,影响着土壤中物质循环和能量流通,具有调节生态系统的功能(Drik and Frank,2011;张雪慧等,2020)。蚂蚁的筑巢建穴亦会改变土壤理化性质、微气候条件、元素配比及微生物群落(Juliane et al.,2016)。蚂蚁通过搬运、取食、消化及排泄有机残体直接影响土壤养分含量,对蚁巢地土壤理化性质产生显著影响(Verchot et al.,2003;王邵军等,2016)。因此,研究蚂蚁筑巢对南方果园土壤微生物的影响,对南方果园生态环境的改善具有重要意义。【前人研究进展】近年来,涉及蚂蚁巢穴的研究主要针对土壤有机碳循环、碳矿化过程、土壤理化性质及微生物生物量和巢内真菌多样性等方面。周善义(2001)、李晓玲等(2020)研究发现,蚂蚁可通过直接的物理作用、介导蚜虫侵染和提高蚁巢穴微生物活性等加速凋落物的分解,促进土壤有机碳矿化过程,从而促进土壤改良,提高土壤肥力。贺虹等(2011)研究发现,日本弓背蚁(Camponotus japonicus)、铺道蚁(Tetramorium caespitum)和日本黑褐蚁(Formica japonica)3种蚂蚁蚁巢内的真菌多样性指数均显著低于无蚂蚁栖居的土壤,但在3种蚂蚁蚁巢之间无显著差异;3种蚂蚁及无蚂蚁栖居的土壤其真菌均匀度指数间无显著差异。陈元瑶等(2012)研究发现,蚂蚁的筑巢活动可显著影响蚁巢内土壤的养分含量和微生物量,致使土壤异质性增强,从而对維持生态系统的物质能量循环产生重要影响。Bierbass等(2015)报道,巢穴内异于周围的微气候条件可影响微生物的活性,从而加速有机碳的矿化分解,蚁巢内温度越高越有利于有机碳的矿化。杨析等(2018)、陈闽昆等(2019)研究结果表明,蚁巢穴中排放的CO2显著高于周围土壤与蚁巢穴内较高的微生物活性、食物残渣和排泄物的积累等密切相关。曹乾斌等(2019)研究发现,蚂蚁筑巢主要通过改变有机碳矿化的底物组分(土壤有机碳和土壤微生物生物量碳)来调控土壤有机碳矿化速率。张哲等(2019)发现蚁巢穴中大量有机物富集和混合会刺激土壤微生物的活动,使土壤具有较高的微生物量、活性及功能多样性,致使土壤异质性增强。张雪慧等(2020)报道,蚁巢穴中的有机物主要通过蚂蚁和分解者的呼吸作用及其介导的无机—有机矿化过程以温室气体的形式从巢穴土壤中流失。【本研究切入点】目前,对蚁巢土壤仍缺乏系统的分析,尤其对亚热带地区果园中常见的蚁巢土壤微生物群落结构研究鲜见报道。【拟解决的关键问题】以南方荔枝园蚁巢土壤和非蚁巢土壤为研究对象,基于高通量测序技术,比较蚁巢和非蚁巢土壤细菌和真菌群落结构差异,探究南方果园蚁巢土壤中特有的微生物资源及其功能,为探寻功能微生物资源及南方果园土壤的生态管理提供理论依据和技术支撑。
1 材料与方法
1. 1 试验地概况
试验采样点位于广西钦州市灵山县高李村(东经109°16′31″,北纬22°12′30″)。本区域属亚热带季风气候,阳光充足,雨量充沛,年平均气温21.7 ℃,年无霜期348 d,年均降水量1658 mm。采样地土壤理化性质:土壤pH 4.53,有机质含量43.13 g/kg,全氮2.22 g/kg,全磷0.34 g/kg,全钾11.30 g/kg,碱解氮185.50 mg/kg,速效磷4.07 mg/kg,速效钾73.67 mg/kg。
1. 2 样品采集
蚁巢土壤采自于日本弓背蚁蚁巢。采集时先在果园中查找蚁巢,去除其地表残枝落叶等杂物,然后随机挖取整个蚁巢作为蚁巢土壤(Ant nest,AN),共挖取3个;非蚁巢土壤采集,采用相同方法随机挖取3处距离蚁巢3 m外无蚁巢的土壤作为对照土壤(非蚁巢土壤,CK)。用无菌密封袋收集后混匀,装入内置冰袋的冰盒中带回实验室。将每份土壤样品分成2份,1份在室内风干后过40目筛,用于土壤理化性质测定;1份过10目筛后置于-80 ℃冰柜中保存,用于土壤微生物群落结构分析。
1. 3 土壤理化性质测定
参照鲍士旦(2013)的方法测定土壤理化性质。采用电位法测定土壤pH、重铬酸钾容量法(外加热法)测定土壤有机质、半微量开氏法测定土壤全氮、HClO4-H2SO4消煮法测定土壤全磷和速效磷;火焰光度法测定土壤速效钾、碱解扩散法测定土壤碱解氮。
1. 4 土壤细菌多样性分析
土壤样品总DNA提取、PCR扩增和序列测定均由上海美吉生物医药科技有限公司完成(Lundberget al.,2012;Davide et al.,2015)。测序具体类型及引物序列见表1。
测序步骤:(1)DNA抽提和PCR扩增:总DNA抽提根据E.Z.N.A.? soil DNA kit (Omega Bio-tek,Norcross,GA,USA)操作说明进行,DNA浓度和纯度使用NanoDrop 2000分光光度计(Thermo Fisher Scientific,USA)进行检测。利用1%琼脂糖凝胶电泳检测DNA提取质量,并以提取的土壤微生物DNA为模板,选择338F和806R为引物对细菌V3~V4可变区进行PCR扩增,选用ITS1F和ITS2R为引物对真菌ITS1区进行PCR扩增。常规方法回收PCR产物,并进行纯化、检测定量。(2)Illumina MiSeq测序:将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTM Fluorometer (Promega,USA)对回收产物进行检测定量。基于Illumina MiSeq平台(Illumina,SanDiego,USA)标准操作规程,将纯化后的扩增片段构建文库。利用Illumina公司的MiSeq PE300平台进行测序(上海美吉生物医药科技有限公司)。
数据处理:原始测序序列运用Trimmomatic进行质控;使用FLASH进行拼接,设置50 bp的窗口,去除质控后长度低于50 bp的序列,根据重叠碱基overlap将两端序列进行拼接,根据序列首尾两端的barcode和引物将序列拆分至每个样本;使用UPARSE version 7.1(http://drive5.com/uparse/)根据97%的相似度对序列进行OTU聚类并剔除嵌合体,生成OTU表格;利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。获得分类学信息和各个样本在各分类水平上的群落组成,用图形进行可视化表示,使用Usearch和Mothur分别进行OTU丰度和Alpha多样性计算,得到样品物种信息。
1. 5 统计分析
试验数据采用Excel 2019进行计算,运用IBM SPSS Statistics 21进行方差分析,使用Duncans新复极差法进行显著性检验,并利用上海美吉生物医药科技有限公司的I-sanger云数据分析平台进行在线数据分析。平均数据以平均数±标准差(S.D.)表示。
2 结果与分析
2. 1 蚁巢和非蚁巢土壤微生物OTU聚類分析结果
由表2可知,蚁巢(AN)土壤中细菌群落组成可分为21门、51纲、131目、213科、390属、721种及2107个OTU,非蚁巢土壤(CK)中细菌群落组成可分为23门、61纲、155目、252科、442属、846种及2232个OTU;蚁巢土壤中真菌群落组成可分为10门、33纲、90目、200科、357属、524种及1504个OTU,非蚁巢土壤中真菌群落组成可分为12门、33纲、88目、192科、337属、492种及1490个OTU。与非蚁巢土壤相比,蚁巢土壤中细菌群落组成在不同分类(门、纲、目、科、属、种)水平下的数量均减少,而真菌群落组成除门分类水平的数量减少外,纲分类水平数量保持不变,目、科、属和种分类水平数量均增加。
2. 2 蚁巢和非蚁巢土壤微生物Alpha多样性分析结果
由表3可知,样品分析覆盖率均在99%以上,表明分析数据真实可信。蚁巢土壤中,指示细菌丰富度的ACE和Chao1指数,以及指示细菌多样性的Shannon和Simpson指数均与非蚁巢土壤间无显著差异(P>0.05,下同);蚁巢土壤中真菌ACE和Chao1指数,以及Shannon和Simpson指数亦与非蚁巢土壤间无显著差异。表明蚂蚁筑巢对果园土壤微生物(细菌和真菌)多样性及丰富度无显著影响。
2. 3 土壤微生物群落组成分析结果
2. 3. 1 蚁巢和非蚁巢土壤微生物门分类水平分析
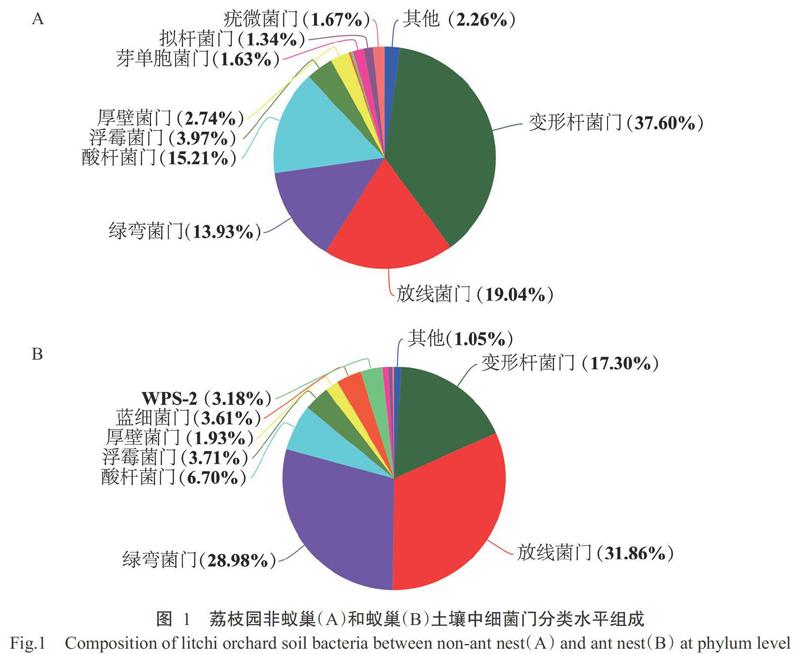
在细菌门分类水平,蚁巢和非蚁巢土壤中丰度占比大于1%的优势细菌门分别有8和9个(图1)。变形杆菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)和厚壁菌门(Firmicutes)是蚁巢土壤和非蚁巢土壤共有的优势细菌门。其中,非蚁巢土壤中优势细菌门丰度占比排序为:变形杆菌门(37.60%)>放线菌门(19.04%)>酸杆菌门(15.21%)>绿弯菌门(13.93%)>浮霉菌门(3.97%)>厚壁菌门(2.74%)>疣微菌门(1.67%)>芽单胞菌门(1.63%)>拟杆菌门(1.34%)及其他(2.26%)(图1-A);蚁巢土壤中优势细菌门丰度占比排序为:放线菌门(31.86%)>绿弯菌门(28.98%)>变形杆菌门(17.30%)>酸杆菌门(6.70%)>浮霉菌门(3.71%)>蓝细菌门(3.61%)>WPS-2(3.18%)>厚壁菌门(1.93%)及其他(1.05%)(图1-B)。综上可知,与非蚁巢土壤相比,蚁巢土壤中变形杆菌门、酸杆菌门和其他门类的细菌丰度占比下降,降幅分别为53.99%、55.95%和53.54%,而放线菌门和绿弯菌门细菌丰度占比升高,升幅分别为67.33%和108.04%;此外,蚁巢土壤中芽单胞菌门、拟杆菌门和疣微菌门等部分优势细菌门类缺失,而蓝细菌门和WPS-2富集成为蚁巢土壤中特有的优势细菌门类。
在真菌门分类水平,蚁巢和非蚁巢土壤中丰度占比大于1%的优势真菌门均有4个,分别是子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)和unclassified_k__Fungi门。其中,非蚁巢土壤中优势真菌门丰度占比排序为:子囊菌门(53.48%)>担子菌门(27.07%)>被孢霉门(14.84%)>unclassified_k__Fungi(4.15%)(图2-A);蚁巢土壤中优势真菌门丰度占比排序为子囊菌门(60.08%)>担子菌门(26.52%)>unclassified_k__Fungi(9.59%)>被孢霉门(2.90%)(图2-B)。综上可知,与非蚁巢土壤相比,蚁巢土壤中被孢霉门真菌丰度占比下降,降幅为80.46%,而unclassified_k__Fungi真菌丰度占比则大幅上升,升幅为131.08%。
2. 3. 2 蚁巢和非蚁巢土壤微生物属分类水平分析
在细菌属分类水平,非蚁巢土壤中丰度占比大于1%的优势细菌属排序为:norank_f__Xanthobacteraceae(15.82%)>norank_c__AD3(5.15%)>嗜酸栖热菌属(Acidothermus,5.05%)>Candidatus_Solibacter(3.28%)>norank_o__Elsterales(3.24%)>norank_ f__Gemmataceae(2.93%)>norank_c__Subgroup_6(2.88%)>慢生根瘤菌属(Bradyrhizobium,2.48%)>norank_o__IMCC26256(2.22%)>norank_o__Acidobacteriales(1.89%)>norank_o__Subgroup_2(1.65%)>norank_c__TK10(1.57%)>norank_o__Gaiellales(1.56%)>Bryobacter(1.55%)>HSB_OF53-F07(1.39%)>norank_f__JG30-KF-AS9(1.17%)>Candidatus_Koribacter(1.14%)>Haliangium(1.02%)及其他(39.95%);非蚁巢土壤中特有的优势菌属有:norank_c__Subgroup_6、norank_o__Gaiellales、no-rank_o__Subgroup_2、Candidatus_Koribacter和Ha-liangium(图3-A)。蚁巢土壤中丰度占比大于1%的优势细菌属排序为:Conexibacter(8.92%)>嗜酸栖热菌属(7.26%)>norank_c__AD3(6.18%)>norank_ o__B12-WMSP1(4.06%)>unclassified_f__Ktedonobacteraceae(3.74%)>norank_o__Elsterales(3.55%)>norank_f__Xanthobacteraceae(3.23%)>norank_o__ Chloroplast(3.21%)>norank_p__WPS-2(3.18%)>HSB_OF53-F07(2.91%)>Bryobacter(2.48%)>norank_f__Gemmataceae(2.46%)>norank_c__TK10(2.33%)>norank_o__IMCC26256(2.13%)>FCPS473(1.74%)>norank_f__JG30-KF-AS9(1.51%)>分枝杆菌属(Mycobacterium,1.34%)>鞘氨醇单胞菌属(Sphingomonas,1.29%)>慢生根瘤菌属(1.23%)>norank_f__JG30-KF-CM45(1.11%)>norank_o__Aci-dobacteriales(1.09%)=间孢囊菌属(unclassified_ f__Intrasporangiaceae,1.09%)>Candidatus_Solibac-ter(1.03%)>中华单胞菌属(Sinomonas,1.02%)及其他(30.72%);蚁巢土壤中特有的优势细菌属有:Conexibacter、unclassified_f__Ktedonobacteraceae、norank_o__B12-WMSP1、norank_p__WPS-2、norank_ o__Chloroplast、分枝杆菌属、FCPS473、鞘氨醇单胞菌属、norank_f__JG30-KF-CM45、间孢囊菌属和中华单胞菌属(图3-B)。
在真菌属分类水平,非蚁巢土壤中丰度占比大于1%的优势真菌属排序为:Saitozyma(17.38%)>被孢霉属(Mortierella,14.15%)>无茎真菌属(Acaulium,12.71%)>unclassified_p__Ascomycota(10.76%)>Apiotrichum(7.04%)>unclassified_k__Fungi(4.15%)>青霉属(Penicillium,3.04%)>unclassified_c__Sordariomycetes(2.57)>unclassified_f__Thyridariaceae(2.24%)>unclassified_f__Chaetomiaceae(2.08%)>木霉属(Trichoderma,1.92%)>镰孢霉属(Fusarium,1.45%)>unclassified_o__Hypocreales(1.24%)>拟棘壳孢属(Pyrenochaetopsis,1.21%)>绿僵菌属(Me-tarhizium,1.01%)及其他(15.06%);非蚁巢土壤中特有的优势真菌属有:无茎真菌属、unclassified_c__ Sordariomycetes、木霉属、unclassified_o__Hypocrea-les、拟棘壳孢属和绿僵菌属(图4-A)。蚁巢土壤中丰度占比大于1%的优势真菌属排序为:瘦脐菇属(Rickenella,13.69%)>节丛孢属(Arthrobotrys,12.25%)>unclassified_k__Fungi(9.59%)>青霉属(7.59%)>镰孢霉属(6.88%)>Saitozyma(6.09%)>unclassified_p__Ascomycota(3.67%)>unclassified_f__ Chaetomiaceae(3.19%)>被孢霉属(2.90%)>梨孢霉属(Coniosporium,2.42%)>unclassified_c__Eurotiomycetes(2.15%)=粗糙孔菌属(Trechispora,2.15%)>Apiotrichum(2.08%)>unclassified_f__Thyridariaceae(1.85%)>unclassified_o__Pezizales(1.79%)>unclassified_o__Pleosporales(1.28%)>Xepicula(1.24%)>茎点霉属(Phoma,1.18%)>曲霉属(Aspergillus,1.14%)及其他(15.06%);蚁巢土壤中特有的真菌属有:瘦脐菇属、节丛孢属、梨孢霉属、unclassified_c__Eurotiomycetes、粗糙孔菌属、unclassified_o__Pezizales、unclassified_o__Pleosporales、Xe-picula、茎点霉属和曲霉属(图4-B)。
2. 4 物种Venn分析结果
基于属、种分类水平的Venn图可知,属分类水平蚁巢和非蚁巢土壤中共有的细菌属为342个,其中,非蚁巢土壤中特有的细菌属达100个,而蟻巢土壤中特有的细菌属仅有48个(图5-A);种分类水平蚁巢和非蚁巢土壤中共有的细菌种为621个,其中,非蚁巢土壤中特有的细菌种达225个,而蚁巢土壤中特有的细菌种仅有100个(图5-B)。表明蚁巢土壤中特有的细菌属和种水平数量均呈下降趋势。
基于属、种分类水平的Venn图可知,属分类水平蚁巢和非蚁巢土壤中共有的真菌属为253个,其中,非蚁巢土壤中特有的真菌属为84个,而蚁巢土壤中特有的真菌属达104个(图6-A);种分类水平蚁巢和非蚁巢土壤中共有的真菌种为352个,其中,非蚁巢土壤中特有的真菌种为140个,而蚁巢土壤中特有的真菌种达172个(图6-B)。表明蚁巢土壤中特有的真菌属和种水平数量均呈上升趋势。
综上结果表明,蚂蚁筑巢不仅改变了果园土壤中细菌属和种分类水平上的群落结构,而且降低了果园土壤中细菌属和种水平的数量;同时,蚂蚁筑巢亦改变了果园土壤中真菌属和种分类水平上的群落结构,提高了果园土壤中真菌属和种分类水平的数量。
3 讨论
一般情况下,果园大多存在立地条件较差、土壤养分含量低、结构不协调及土地生产力较低等问题(史进,2016)。果园土壤理化及生物学性状受气候、土壤类型和栽培管理方式等因素的影响(张超博等,2020)。现代农业中,由于过度依赖化肥、农药及除草剂等人工合成物质,不仅容易导致水果品质下降,果园生态环境亦遭受严重威胁。现阶段,随着生态理念认知的加深,营造多样性丰富的生态果园,生产优质、高产的绿色乃至有机果品已成为当代水果产业发展的必然趋势,其中,果园生草、园下养殖及饲养蚯蚓(蝉)等均是构建生态果园行之有效的手段(侯婷等,2019;朱绍丹等,2019)。
蚂蚁个体总数超过地球上所有其他动物个体数的总和,不仅数量庞大而且分布广泛,除了部分害蚁,如小家蚁属(Monomorium)、大头蚁属(Pheidole)和行军蚁属(Dorylus)对人类造成危害外,大多数蚂蚁对人类有益,改良土壤、提高土壤肥力是蚂蚁的有益功能之一(周善义,2001)。杨建秀等(2020)研究发现,蚂蚁筑巢定居活动能显著增加土壤中营养元素含量,显著提高土壤肥力,蚁巢内土壤氮磷钾含量显著高于蚁巢周围土壤,且不同蚂蚁种类对土壤的影响能力存在差异。但至今人们对蚁巢土壤仍缺乏系统的研究,果园蚁巢形成的利与弊尚无定论,导致当前南方果园的管理者针对果园中常出现的蚁穴多采取喷洒化学农药消灭的措施进行处理,对果园生态环境造成潜在威胁。
众所周知,微生物是生态系统中功能活跃,开发潜力最大、最宝贵的生物资源库(Vannier et al.,2018)。土壤中丰富的微生物多样性在陆地生态系统中发挥着重要作用(冯美利等,2019;杨尚东等,2019)。微生物群落结构越丰富、物种越均匀及多样性越丰富时,植物对抗病原菌的综合能力就越强(杨尚东等,2020)。本研究分析发现,指示微生物(细菌和真菌)丰富度的ACE和Chao1指数,以及指示多样性的Shannon和Simpson指数在蚁巢和非蚁巢土壤中均无显著差异,但蚁巢形成明显改变了果园土壤细菌和真菌不同分类水平的组成,尤其在属、种分类水平上,其中,虽然蚁巢形成降低了果园土壤中细菌属、种分类水平的数量,但提高了果园土壤中真菌属、种分类水平的数量。
本研究中,与非蚁巢土壤相比,在门分类水平下果园蚁巢土壤中变形杆菌门、酸杆菌门和其他门类的细菌丰度占比下降,放线菌门和绿弯菌门细菌丰度占比上升;同时,芽单胞菌门、拟杆菌门和疣微菌门等优势菌门类缺失,蓝细菌门和WPS-2细菌成为蚁巢土壤中特有的优势细菌门。至今研究已发现,放线菌门细菌具有降解纤维素和几丁质的功能,是土壤养分供给的主要来源(靳新影等,2020);绿弯菌门细菌倾向于生活在营养充足的环境中,大量的营养元素有利于绿弯菌门细菌生长繁殖(赵立君等,2020);而酸杆菌门细菌适合在有机碳含量低的贫瘠环境中生存(Sul et al.,2013)。基于优势细菌门类绿弯菌门细菌的特性,进一步证实蚂蚁筑巢有助于提高土壤肥力的观点。另一方面,与非蚁巢土壤中相比,蚁巢土壤拥有与非蚁巢土壤相同的优势真菌门类组成,但被孢霉门真菌占比下降;unclassified_ k__Fungi真菌占比上升。
与非蚁巢土壤相比,在属分类水平下果园蚁巢土壤富集了Conexibacter、unclassified_f__Ktedonobacteraceae、norank_o__B12-WMSP1、norank_p__ WPS-2、norank_o__Chloroplast、分枝杆菌属、FCPS-473、鞘氨醇单胞菌属、norank_f__JG30-KF-CM45、间孢囊菌属和中华单胞菌属等特有优势细菌属,但同时亦缺失了norank_c__Subgroup_6、norank_o__ Gaiellales、norank_o__Subgroup_2、Candidatus_Koribacter和Haliangium等非蚁巢土壤中的优势细菌属。研究已发现,分枝杆菌属细菌是一类具有降解石油烃功能的细菌(葛延妍,2017);鞘氨醇单胞菌属细菌则是降解复杂芳香族污染物的一类细菌(黄海东等,2009),表明蚁巢土壤中富集了具有降解有机污染物功能的优势细菌属。另一方面,与非蚁巢土壤相比,果园蚁巢土壤富集了瘦脐菇属、节丛孢属、梨孢霉属、unclassified_c__Eurotiomycetes、粗糙孔菌属、unclassified_o__Pezizales、unclassified_o__Pleosporales、Xepicula、莖点霉属和曲霉属等特有的优势真菌属,但亦缺失了无茎真菌属、unclassified_c__Sordario-mycetes、木霉属、unclassified_o__Hypocreales、拟棘壳孢属和绿僵菌属等非蚁巢土壤特有的优势真菌属。研究发现,常见的石油烃降解真菌,如青霉属(Velmurugan et al.,2010;丁自立等,2016)、尖孢镰刀菌(Fusarium)(Jacob et al.,2013)和曲霉属(Iram et al.,2015;丁自立等,2016)等具有分泌抗生素以及对重金属污染具有较强抗性等特性(葛延妍,2017),表明蚁巢土壤中富集了具有降解石油烃和抵御土壤重金属污染能力的优势真菌属。
4 结论
蚁巢形成改变了果园土壤中的细菌群落和真菌群落组成,其中,蚁巢土壤中富集的优势细菌倾向于生存在土壤肥力更高的土壤中。蚁巢土壤中蕴含着丰富的具有分泌抗生素和生物修复功能的微生物资源,是一个潜在的生物资源宝藏。
参考文献:
鲍士旦. 2013. 土壤农化分析[M]. 第3版. 北京:中国农业出版社. [Bao S D. 2013. Agrochemical analysis of soil[M]. The 3th Edition. Beijing: China Agriculture Press.]
曹乾斌,王邵军,任玉连,张哲,陈闽昆,李少辉,曹润,王平,左倩倩. 2019. 蚂蚁筑巢对西双版纳热带森林土壤碳矿化动态的影响[J]. 应用生态学报,30(12): 4231-4239. doi: 10.13287/j.1001-9332.201912.034. [Cao Q B,Wang S J,Ren Y L,Zhang Z,Chen M K,Li S H,Cao R,Wang P,Zuo Q Q. 2019. Effects of ant colonization on spatiotemporal variation of organic carbon mineralization in Xishuangbanna tropical forest soils[J]. Chinese Journal of Applied Ecology,30(12): 4231-4239.]
陈闽昆,王邵军,陈武强,曹润,曹乾斌,王平,左倩倩,张哲,李少辉. 2019. 蚂蚁筑巢对西双版纳热带森林土壤微生物生物量碳及熵的影响[J]. 应用生态学报,30(9): 2973-2982. doi: 10.13287/j.1001-9332.201909.036. [Chen M K,Wang S J,Chen W Q,Cao R,Cao Q B,Wang P,Zuo Q Q,Zhang Z,Li S H. 2019. Effects of ant nesting on soil microbial biomass carbon and quotient in tropical forest of Xishuangbanna[J]. Chinese Journal of Applied Ecology,30(9): 2973-2982.]
陈元瑶,魏琮,贺虹,王云果. 2012. 秦岭地区2种蚂蚁巢内土壤理化性质和微生物量的相关性研究[J]. 西北林学院学报,27(2):121-126. doi:10.3969/j.issn.1001-7461. 2012.02.26. [Chen Y Y,Wei C,He H,Wang Y G. 2012. Correlation of physicochemical characteristics and microbial biomass among nest soil of Camponotus japonicus and pachycondyla astute in Qinling mountains[J]. Journal of Northwest Forestry University,27(2): 121-126.]
丁自立,吴金平,游艾青,汪金平,曹凑贵. 2016. 耐镉耐铬丝状真菌菌株的筛选与鉴定[J]. 中国农学通报,32(27): 105-108. [Ding Z L,Wu J P,You A Q,Wang J P,Cao C G. 2016. Screening and identification of resistant filamentous fungi strains to cadmium and chromium[J]. Chinese Agricultural Science Bulletin,32(27): 105-108.]
冯美利,李爱基,曹红星,金龙飞. 2019. 油棕林下养鸡对土壤养分和微生物数量的影响[J]. 江西农业学报,31(11): 43-46. doi: 10.19386 /j.cnki.jxnyxb.2019.11.09. [Feng M L,Li A J,Cao H X,Jin L F. 2019. Effects of raising chicken in oil palm forest on soil nutrients and soil microorganisms[J]. Acta Agriculturae Jiangxi,31(11): 43-46.]
葛延妍. 2017. 不同品种高羊茅对石油污染土壤的修复效果及其根际微生态研究[D]. 芜湖:安徽师范大学. [Ge Y Y. 2017. Study of different of Festuca arundinaceas rhizosphere microecology and remediation effect on petroleum contaminated soil[D]. Wuhu: Anhui Normal University.]
贺虹,魏琮,王云果,高智辉. 2011. 秦岭楼观台油松林地3种土栖性蚂蚁巢内真菌多样性研究[J]. 西北林学院学报,26(2): 129-134. [He H,Wei C,Wang Y G,Gao Z H. 2011. The fungal diversity in nests of three soil-nesting ant species(Hymenoptera: Formicidae) in pine forests of Louguantai national forest park,China[J]. Journal of Northwest Forestry University,26(2): 129-134.]
侯婷,閆鹏科,庞群虎,马婷慧,齐雁冰,王锐. 2019. 行内覆盖对果园土壤特性及酿酒葡萄产量和品质的影响[J]. 河南农业大学学报,53(6):869-875. doi:10.16445/j.cnki. 1000-2340.20191121.006. [Hou T,Yan P K,Pang Q H,Ma T H,Qi Y B,Wang R. 2019. Effects of intra-row co-verage on orchard soil features and wine grape yield and quality[J]. Journal of Henan Agricultural University,53(6):869-875.]
黄海东,刘云,刘如林. 2009. 合成生物聚合物的重要微生物资源——鞘氨醇单胞菌[J]. 微生物学报,49(5): 561-567. doi: 10.13343/j.cnki.wsxb.2009.05.011. [Huang H D,Liu Y,Liu R L. 2009. Sphingomonas sp.: An important microbial resource for biopolymer synthesis[J]. Acta Microbiologica Sinica,49(5): 561-567.]
靳新影,张肖冲,金多,陈韵,李靖宇. 2020. 腾格里沙漠东南缘不同生物土壤结皮细菌多样性及其季节动态特征[J]. 生物多样性,28(6): 718-726. doi: 10.17520/biods.2019298. [Jin X Y,Zhang X C,Jin D,Chen Y,Li J Y. 2020. Diversity and seasonal dynamics of bacteria among different bio-logical soil crusts in the southeast Tengger Desert[J]. Biodiversity Science,28(6): 718-726.]
李晓玲,陈立,方守国. 2020. 红火蚁巢穴土壤中生物碱成分分析[J]. 昆虫学报,63(4):494-501. doi: 10.16380/j.kcxb. 2020.04.012. [Li X L,Chen L,Fang S G. 2020. Analysis of alkaloid components in the soil from the nest of the red imported fire ant,Solenopsis invicta(Hymenoptera: Formicidae)[J]. Acta Entomologica Sinica,63(4): 494-501.]
史进,李文胜,张俊苗. 2016. 两种果园土壤质量综合评价及生物量与土壤元素的关系[J]. 新疆农业科学,53(6): 1081-1090. doi: 10.6048/j.issn.1001-4330.2016.06.015. [Shi J,Li W S,Zhang J M. 2016. Comprehensive evaluation of the soil quality and the relationship between biomass and soil elements in two orchards[J]. Xinjiang Agricultural Sciences,53(6): 1081-1090.]
王邵军,王红,李霁航. 2016. 热带森林不同演替阶段蚂蚁巢穴的分布特征及其影响因素[J]. 生物多样性,24(8): 916-921. doi: 10.17520/biods.2016088. [Wang S J,Wang H,Li J H. 2016. Distribution characteristics of ant mounds and correlating factors across different succession stages of tropical forests in Xishuangbanna[J]. Biodiversity Scien-ce,24(8): 916-921.]
杨建秀,张念念,燕迪,李巧,王庆,卢志兴,陈又清. 2020. 红火蚁营巢对不同生境土壤氮磷钾含量的影响[J]. 林业科学研究,33(2): 161-167. doi: 10.13275/j.cnki.lykxyj. 2020.02.020. [Yang J X,Zhang N N,Yan D,Li Q,Wang Q,Lu Z X,Chen Y Q. 2020. Mound building effects of red fire ants (Solenopsis invicta Buren) on the concentrations of soil nitrogen,phosphorus and potassium across different habitats[J]. Forest Research,33(2): 161-167.]
杨尚东,郭霜,任奎喻,庞师婵,张传进,王帅帅,谭宏伟. 2019. 甘蔗宿根矮化病感病与非感病株根际土壤生物学性状及细菌群落结构特征[J]. 植物营养与肥料学报,25(6): 910-916. doi: 10.11674/zwyf.18484. [Yang S D,Guo S,Ren K Y,Pang S C,Zhang C J,Wang S S,Tan H W. 2019. Soil biological properties and bacterial community structures in rhizosphere soil of canes infected and non-infected by ratoon stunting disease[J]. Journal of Plant Nutrition and Fertilizers,25(6): 910-916.]
杨尚东,任奎瑜,谭宏伟. 2020. 甘蔗宿根矮化病感病与非感病植株养分含量、根系生长及内生细菌群落的差异[J]. 植物营养与肥料学报,26(9): 1591-1599. doi:10.11674/zwyf.20144. [Yang S D,Ren K Y,Tan H W. 2020. Differen-ces in plant nutrient content,root growth and endophytic bacterial community between infected and non-infected sugarcanes by ratoon stunting disease[J]. Journal of Plant Nutrition and Fertilizers,26(9): 1591-1599.]
杨析,邵明安,李同川,贾玉华,贾小旭,黄来明. 2018. 黄土高原北部日本弓背蚁巢穴结构特征及其影响因素[J]. 土壤学报,55(4): 868-878. doi: 10.11766/trxb201711270 565. [Yang X,Shao M A,Li T C,Jia Y H,Jia X X,Huang L M. 2018. Structure characteristics of Camponotus japonicus nests in northern part of Loess Plateau and influencing factors[J]. Acta Pedologica Sinica,55(4): 868-878.]
张超博,邱洁雅,王敏,李有芳,朱攀攀,王彤,邓崇岭,付行政,凌丽俐,刘升球,陈传武,彭良志. 2020. 桂北柑橘园土壤化学性状研究[J]. 土壤,52(6): 1187-1195. doi: 10. 13758/j.cnki.tr.2020.06.013. [Zhang C B,Qiu J Y,Wang M,Li Y F,Zhu P P,Wang T,Deng C L,Fu X Z,Ling L L,Liu S Q,Chen C W,Peng L Z. 2020. Study on soil chemical properties of citrus orchards in northern Guangxi[J]. Soils,52(6): 1187-1195.]
張雪慧,张仲胜,武海涛. 2020. 蚂蚁扰动对土壤有机碳循环过程的影响研究进展[J]. 应用生态学报,31(12): 4301-4311. doi:10.13287/j.1001-9332.202012.033. [Zhang X H,Zhang Z S,Wu H T. 2020. Effects of ant disturbance on soil organic carbon cycle: A review[J]. Chinese Journal of Applied Ecology,31(12): 4301-4311.]
张哲,王邵军,陈闽昆,曹润,李少辉. 2019. 蚂蚁筑巢对不同恢复阶段热带森林土壤易氧化有机碳时空动态的影响[J]. 生物多样性,27(6): 658-666. doi: 10.17520/biods. 2019011. [Zhang Z,Wang S J,Chen M K,Cao R,Li S H. 2019. Effect of ant colonization on spatiotemporal dynamics of readily oxidizable soil carbon across different restoration stages of tropical forests[J]. Biodiversity Scien-ce,27(6): 658-666.]
赵立君,刘云根,王妍,赵蓉,任伟,徐鸣洲. 2020. 典型高原湖滨带底泥细菌群落结构及多样性特征[J]. 微生物学通报,47(2): 401-410. doi: 10.13344/j.microbiol.china.190 270. [Zhao L J,Liu Y G,Wang Y,Zhao R,Ren W,Xu M Z. 2020. Bacterial community structure and diversity of sediments in a typical plateau lakeshore[J]. Microbio-logy China,47(2): 401-410.]
周善義. 2001. 广西蚂蚁[M]. 桂林:广西师范大学出版社. [Zhou S Y. 2001. Ants in Guangxi[M].Guilin: Guangxi Normal University Press.]
朱绍丹,陈丽,焦健,李朝周,刘文兰,赵阳. 2019. 土壤干旱及生草间作对油橄榄光合特性的影响[J]. 江苏农业学报,35(2):282-288. doi:10. 3969 /j. issn.1000-4440. 2019. 02. 006. [Zhu S D,Chen L,Jiao J,Li C Z,Liu W L,Zhao Y. 2019. Effects of soil drought and grass intercropping on photosynthetic charac-teristics of live[J]. Jiangsu Journal of Agricultural Sciences,35(2):282-288.]
Bierbass P,Gutknecht J L M,Michalzik B. 2015. Nest-mounds of the yellow meadow ant(Lasius flavus) at the “Alter Gleisberg”,central germany: Hot or cold spots in nutrient cycling?[J]. Soil Biology and Biochemistry,80:209-217. doi: 10.1016/j.soilbio.2014.09.020.
Bottinelli N,Jouquet P,Capowiez Y,Podwojewski P,Grimaldi M,Peng X. 2015. Why is the influence of soil macrofauna on soil structure only considered by soil ecologists?[J]. Soil and Tillage Research,146:118-124. doi: 10.1016/ j.still.2014.01.007.
Davide B,Ruben G O,Philipp C M,Aaron W,Johannes D,Yao P,Alice C M,Paul S L. 2015. Structure and function of the bacterial root microbiota in wild and domesticated barley[J]. Cell Host & Microbe,17(3):392-403. doi: 10.1016/j.chom.2015.01.011.
Drik S,Frank V F J. 2011. Ecosystem engineering and predation: The multi-trophic impact of two ant species[J]. Journal of Animal Ecology,80(3):569-576. doi: 10.1111/j. 1365-2656.2010.01796.x.
Iram S,Shabbir R,Zafar H,Javaid M. 2015. Biosorption and bioaccumulation of copper and lead by heavy metal-resistant fungal isolates[J]. Arabian Journal for Science and Engineering,40(7):1867-1873. doi: 10.1007/s13369-015- 1702-1.
Jacob J M,Bardhan S,Raj M B. 2013. Selenium and lead tolerance in fungi isolated from sea water[J]. International Journal of Innovative Research in Science,Engineering and Technology,2(7):2975-2981.
Juliane F,Jack H F,Alexei V T,Lijbert B,Jan F,Gerlinde D D,Alexei V U,Matty P B,Patrick L,Michel L,Diana H W,Pascal Q,Herman E,Juan J J. 2016. Soil fauna: Key to new carbon models[J]. Soil,2(4):565-582. doi:10. 5194/soil-2-565-2016.
Lundberg D S,Lebeis S L,Paredes S H,Yourstone S,Gehring J,Malfatti S,Tremblay J,Engelbrektson A,Kunin V,del Rio T G,Edgar R C,Eickhorst T,Ley R E,Hugenholtz P,Tringe S G,Dangl J L. 2012. Defining the core Arabidopsis thaliana root microbiome[J]. Nature,488(7409):86-90. doi: 10.1038/nature11237.
Sasitorn H,Mizue O,Akinori Y,Yoshiaki H,Wattanachai T,Tomonori K,Seiki Y. 2014. CO2 efflux from subterranean nests of ant communities in a seasonal tropical forest,Thailand[J].Ecology and Evolution,4(20):3929-3939. doi: 10.1002/ece3.1255.
Sul W J,Stella A B,Wang Q,Tourlousse D M,Penton C R,Deng Y,Rodrigues J L M,Adiku S G K,Jones J W,Zhou J Z,Cole J R,Tiedje J M. 2013. Tropical agricultural land management influences on soil microbial communities through its effect on soil organic carbon[J]. Soil Bio-logy and Biochemistry,65(5):33-38. doi:10.1016/j.soilbio.2013.05.007.
Vannier N,Mony C,Bittebiere A K,Sophie M C,Biget M,Vandenkoornhuyse P. 2018. A microorganisms s journey between plant generations[J]. Microbiome,6(1):79. doi: 10.1186/s40168-018-0459-7.
Velmurugan N,Hwang G,Sathishkumar M,Choi T K,Lee K J,Oh B T,Lee Y S. 2010. Isolation,identification,Pb(II) biosorption isotherms and kinetics of a lead adsorbing Penicillium sp. MRF-1 from South Korean mine soil[J]. Journal of Environmental Sciences,22(7):1049-1056. doi: 10.1016/S1001-0742(09)60216-3.
Verchot L V,Moutinho P R,Davidson E A. 2003. Leaf-cutting ant(Atta sexdens) and nutrient cycling: Deep soil inorganic nitrogen stocks,mineralization,and nitrification in Eastern Amazonia[J]. Soil Biology and Biochemistry,35(9):1219-1222. doi:10.1016/S0038-0717(03)00183-4.
(責任编辑 麻小燕)

