长链非编码RNA BCYRN1对肺腺癌细胞生物学行为的影响
李世雄,耿华,徐美林△
肺癌是呼吸系统最常见的恶性肿瘤之一。近年来由肺癌造成的死亡人数高于乳腺癌、前列腺癌、结直肠癌和脑肿瘤死亡人数的总和[1]。由于不同地区医疗水平差异和患者的临床病理分期不同,肺癌的5年生存率为4%~17%[2]。肺腺癌是最为常见的一种肺癌亚型,其发生发展的机制尚未完全阐明。长链非编码RNA(LncRNA)是长度超过200个核苷酸,但不编码蛋白质的核酸序列。研究表明,lncRNA的紊乱与人类多种疾病密切相关,其中包括多种癌症[3]。LncRNA脑胞质RNA1(brain cytoplasmic RNA 1,BCYRN1)在食管癌[4]、乳腺癌、结直肠癌[5]和肝癌[6]等肿瘤中高表达。目前关于lncRNA BCYRN1在肺腺癌中作用机制的相关研究鲜见报道。本研究通过多种分子实验技术探究BCYRN1对肺腺癌生物学恶性行为的影响,并结合肺腺癌数据库探究BCYRN1表达与患者临床病理特征以及预后的相关性,旨在探究BCYRN1在肺腺癌细胞中的表达情况及其对肿瘤细胞生物学行为的影响。
比较 PAC吸附和 Fenton试剂降解对 HHCB与AHTN的去除效果可以发现,在适宜的条件下,Fenton试剂比PAC吸附对HHCB与AHTN的去除效果更好,但Fenton试剂反应受pH值的影响更大。
1 材料与方法
1.1 实验材料
1.1.1 细胞株 正常肺上皮细胞BEAS-2B购于上海吉凯基因化学技术公司,293T细胞及肺腺癌细胞系A549、H1299由天津医科大学病理学教研室孙保存课题组赠予。
海德堡对印刷未来图景的描绘让我们充满遐想,忍不住追问,在中国何时能实现自主印刷?黄连光坦率表示,自主印刷在国内只是刚开始,但是相信一定会迎来跳跃式的发展。“我们常常会错误估计中国的发展速度,其实往往在其他国家需要花十几二十年时间才能实现的事情,在国内则会很短。当然,这也是必然的发展方向。”
侵袭实验:步骤大致同前,不同点是实验前4 h需要在Transwell小室内铺一层稀释比为1︰7的martigel胶,在培养箱内水化。48 h后再固定染色。
1.1.3 实验设备及仪器 10 cm培养皿、6孔板、12孔板、24孔板(Invitrogen),离心机(德国Eppendorf),摇床(德国Eppendorf,RT430),生物安全柜(苏州安泰空气技术有限公司,BSC-600IIA2),微量移液器和枪头(Thermo ScientificTMClipTipTM),纯水机(法国Millipore,明澈-D 24 UV),紫外分光光度计(美国Molecular Devices,UPG-723),荧光定量PCR仪(美国Applied Biosystem,ABI7500型),Transwell小室(康宁公司),普通光学显微镜(日本Nikon,Ts2/Ts2-FB),荧光显微镜(日 本Nikon,Ts2/Ts2-FL),流 式 细 胞 仪(美 国BD,FACSCalibur)。
1.2 方法
2.2 转染效率的检测 与对照组相比,慢病毒感染后BCYRN1敲低组的BCYRN1表达水平明显下降,见图2。
1.2.2.5 职业技能训练:每周1次,每次 60 min。通过求职面试技能训练、开放模拟超市、蛋糕烘焙制作、包馄饨、做寿司、手工制作和环境保洁等劳动技能训练和外出社会实践活动等方式,提高患者的劳动技能,改变患者的观念,鼓励患者做力所能及的事。
1.2.2 qPCR检测BCYRN1在不同类型肺癌细胞系中表达 在细胞生长融合度达到80%时消化细胞,离心收集细胞沉淀。采用RNA提取试剂盒提取细胞总RNA,使用紫外分光光度计检测各个样本的浓度和纯度。随后通过反转录得到cDNA,按照qPCR使用说明书进行扩增和荧光定量检测。反转录条件:37℃15 min;85℃5 s;4℃保存。qPCR反应条件:95℃30 s;95℃5 s,60℃30 s,共40个循环。每个样本重复3次,最后所得到的数据经过2-∆∆Ct法分析处理。BCYRN1引物:上游5'-CTGGGCAATATAGCGAGAC-3',下 游5'-TGCTTT‑GAGGGAAGTTACG-3';GAPDH引物:上游5'-GGAGCGA‑GATCCCTCCAAAAT-3',下游5'-GGCTGTTGTCATACTTCT‑CATGG-3'。
直流侧不平衡故障相当有将系统的零电位从换流器上下桥臂中点移向故障点,从而引起交直流电压的偏置。交流侧变压器由于流过直流电流而发生直流偏磁,影响变压器的安全运行;直流电压偏置将对设备的绝缘造成影响,但配网设备的绝缘水平相对容易提高。
2.4 BCYRN1敲低对细胞迁移和侵袭能力的影响 实验12 h和24 h后,BCYRN1敲低组划痕愈合率均较对照组降低,见图4。Transwell迁移实验也显示BCYRN1敲低组H1299细胞穿过小室的细胞显著减少,见图5。
1.2.5 细胞划痕实验观察细胞迁移能力 胰酶消化细胞,1 000 r/min离心5 min,计数相同的细胞数,接种于6孔板培养。当细胞融合度达到95%时,用枪头在6孔板内均匀划线,PBS冲掉划下的细胞,加入含2%血清的低浓度培养基。根据细胞生长速度分别于0、12、24 h拍照记录至任意一组划痕愈合。
1.2.6 Transwell实验检测转染后细胞迁移及侵袭能力 迁移实验:胰酶消化细胞,离心后加入1 mL无血清培养基制成细胞悬液,经PBS稀释后使细胞含量为1×105个/mL。24孔板加入600μL完全培养基,吸取200μL细胞悬液至Transwell小室,继续培养。24 h后,取出小室,用PBS小心冲洗,棉签擦拭掉未穿过的细胞。用预冷过的甲醇固定细胞,PBS冲洗,再用0.4%结晶紫染色1 h,PBS冲洗。选取不同的视野拍照记录。
1.1.2 主要试剂 DMEM培养基、1640培养基(凯基生物科技公司),胎牛血清(Gibco公司),胰酶、嘌呤霉素(Sigma公司),PBS缓冲液(中杉金桥生物技术有限公司),RNA提取试剂盒、无内毒素质粒大提试剂盒(天根生化公司),RNA反转录试剂盒、实时荧光定量聚合酶链反应(qPCR)检测试剂盒(宝日医生物技术公司),引物、慢病毒包装试剂盒(吉凯基因化学技术公司),BCYRN1敲低和对照质粒、转染试剂lipfit3.0(汉恒生物科技公司),碘化丙啶染色液、结晶紫染色液(碧云天生物技术有限公司),聚凝胺Polybrene(索莱宝科技有限公司),基质胶Matrigel(美国Becton&Dickinson公司)。
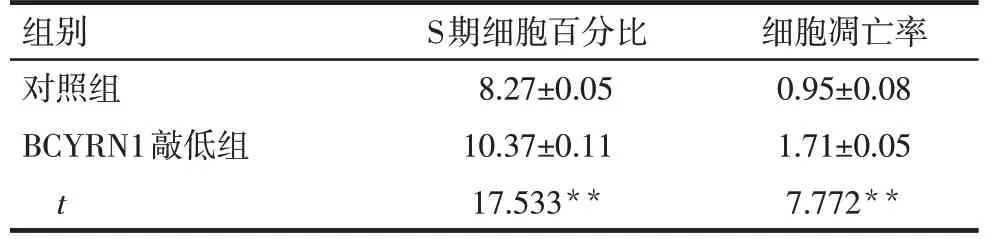
2.3 BCYRN1对肺癌细胞周期和凋亡的影响 G1/G0峰到G2/M峰之间为细胞周期S期,G1/G0峰之前有小段的凋亡峰,见图3。BCYRN1敲低组的S期细胞百分比和细胞凋亡率均高于对照组,见表1。
1.3 统计学分析 采用IBM SPSS Statistics 24软件进行数据分析。计量数据以均数±标准差(x±s)表示,2组样本间数据比较采用t检验,多组间比较采用单因素方差分析,χ2检验分析BCYRN1表达与临床病理特征的关系,Cox回归分析BCYRN1表达与患者预后的关系,P<0.05为差异有统计学意义。
2 结果
2.1 BCYRN1在肺腺癌细胞A549、H1299中的表达 与正常肺上皮细胞BEAS-2B相比,LncRNA BCYRN1在肺腺癌细胞内高表达(P<0.05)。BCYRN1在A549细胞的表达水平约为BEAS-2B细胞的3倍,BCYRN1在H1299细胞的表达水平约为BEAS-2B细胞的11倍,见图1。因此选用H1299细胞进行后续细胞功能实验。
1.2.3 质粒转染以及慢病毒感染目的细胞 计数相同数量的H1299细胞,分为实验组和对照组,分别转染BCYRN1敲低及对照质粒。转染前2 h将293T细胞培养基更换为Opti-MEM培养基,取慢病毒载体质粒、Lenti-Easy Packaging Mix和Opti-MEM混合为A液;Lipfit 3.0和Opti-MEM混合为B液,两者混合形成转染复合物。转染体系加入293T培养液中,8 h后换为正常DMEM培养基。48~72 h收集细胞上清,离心、过滤、纯化收集病毒液。感染目的细胞时,目的细胞换为融合度为50%~60%的6孔板,每孔加入2 mL含有热灭活血清的DMEM培养基,培养过夜,第2天换液加入慢病毒液、完全培养基、Polybrene,晃动混匀后培养12 h,随后换为正常培养基。转染效率通过质粒内的绿色荧光检测,经嘌呤霉素筛选后获得稳定转染的目的细胞株。
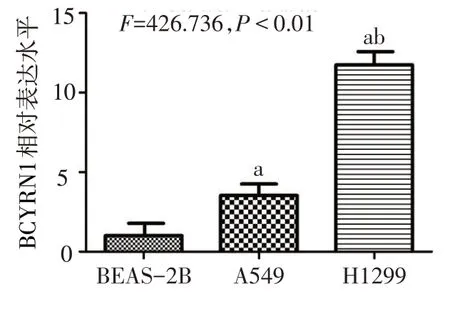
Fig.1 Expression levels of BCYRN1 in lung cancer cells and normal lung epithelium cells图1 BCYRN1在肺腺癌细胞及正常肺上皮中的表达水平
1.2.1 细胞培养 肺腺癌细胞A549、H1299和正常肺上皮细胞BEAS-2B用相适应的培养基加入10%胎牛血清,在37℃、含5%CO2的细胞培养箱内培养。根据细胞生长密度适时进行细胞传代和冻存。使用细胞计数板,按照计上、不计下,计左、不计右的原则计算细胞数目。
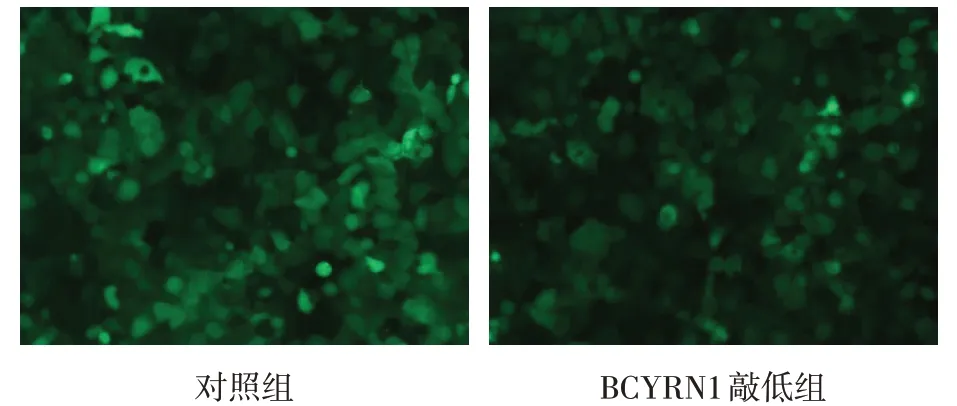
Fig.2 H1299 cells transfected with green fluorescently labeled plasmid venom(×100)图2 绿色荧光标记病毒液转染后的H1299细胞(×100)
1.2.7 LncRNA BCYRN1的生物信息学分析 肺腺癌患者的RNA-seq数据和临床病理特征数据从癌症基因组图谱(TCGA)数据库下载,共包括585个肿瘤样本,所有RNA-seq数据进行log2(x+1)变换。根据BCYRN1的表达水平,将BCYRN1表达高于平均值的患者定义为高表达组,低于或等于平均值患者定义为低表达组。再根据年龄、性别、肿瘤分期、TNM分期对患者进行分层。分析BCYRN1表达水平与患者临床病理特征的关系。从lnCAR网站(http://lncar.renlab.org/)获取BCYRN1在肺腺癌中的表达数据,通过Cox回归分析BCYRN1表达与患者预后的关系。
1.2.4 流式细胞仪检测BCYRN1对细胞周期和凋亡的影响 收集贴壁细胞,1 mL预冷的PBS重悬细胞,离心沉淀细胞后,用70%的预冷乙醇混匀固定细胞12~24 h。再次用PBS重悬细胞,离心沉淀细胞后,每个样本加入0.5 mL的碘化丙啶染色液,37℃避光温育30 min,随后完成流式细胞检测。
虚拟技术应用教学的模式不仅丰富了教学方法,而且通过发挥不同教学手段的优势,突出构建学生的临床空间思维,提高学生的学习兴趣,激励学生提高学习自主性、提高实践操作动手、全面思考问题的能力。为培养优秀的肝胆外科医生提供扎实的基础,激发学生的学习乐趣,达到教学目的。
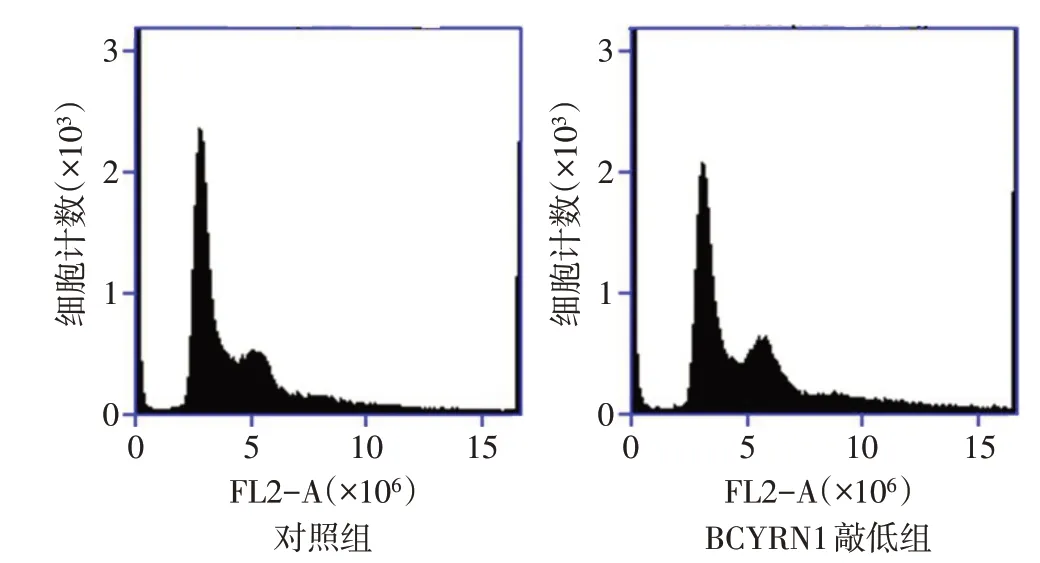
Fig.3 Cell cycle and apoptosis detected by flow cytometry图3 流式细胞仪检测细胞周期和凋亡
Tab.1 Changes of cell cycle and apoptosis in control group and BCYRN1 down-regulated group表1 对照组和BCYRN1敲低组细胞周期和凋亡变化(n=3,%,x±s)
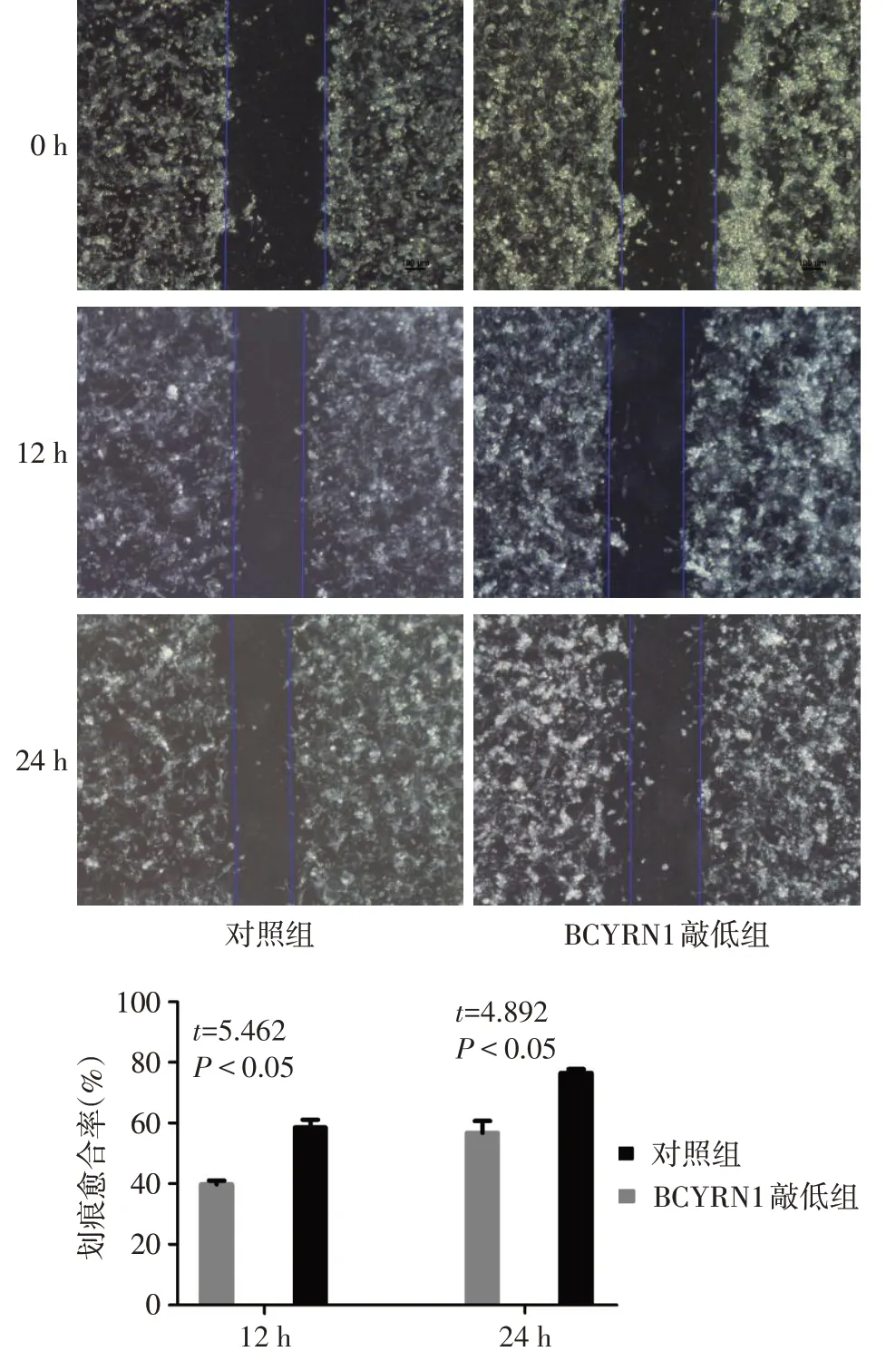
Fig.4 Scratch healing rates in BCYRN1 knockdown group and control group图4 对照组和BCYRN1敲低组的划痕愈合率
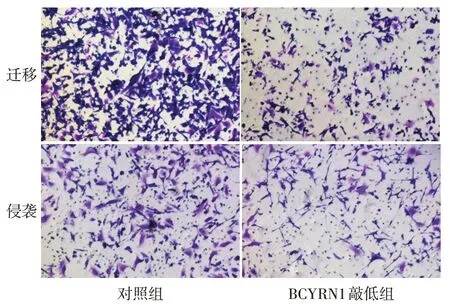
Fig.5 Results of Transwell migration and invasion experiments(Crystal violet staining,×100)图5 Transwell迁移侵袭实验结果(结晶紫染色,×100)
2.5 BCYRN1表达与肺腺癌患者临床病理特征及预后的关系 使用TCGA数据将肺腺癌患者分为BCYRN1高表达组与低表达组,通过χ2检验得到BCYRN1表达水平与肺腺癌患者肿瘤分期和N分期有关(P<0.05),但与年龄、性别以及其他临床病理特征无关(P>0.05),见表2。Cox回归分析结果显示,与BCYRN1低表达组患者相比,BCYRN1高表达组患者的生存时间显著降低(P<0.05),BCYRN1高表达的肺腺癌患者的预后较差,见图6。
(1)测量标准:对于平面式电加热板型的表面温源采用表面温度计测量,表面温度计校准结果扩展不确定度应符合U=2.0℃ k=2。对于干井式或有校准孔型的表面温源采用柔性T型热电偶温度传感器测量,柔性T型热电偶温度传感器连电测仪表整体检测应符合≤0.3℃。
“完成党的十九大提出的目标任务,必须充分发挥工人阶级主力军作用。”10月29日,习近平总书记在同中华全国总工会新一届领导班子成员集体谈话并发表重要讲话时指出,我国广大职工要牢牢把握为实现中国梦而奋斗的时代主题,把自身前途命运同国家和民族前途命运紧紧联系在一起,把个人梦同中国梦紧密联系在一起,把实现党和国家确立的发展目标变成自己的自觉行动,爱岗敬业、争创一流,以不懈奋斗书写新时代华章,共同创造幸福生活和美好未来。
3 讨论
肺腺癌是肺癌最常见的病理亚型,是发病率和死亡率均较高的恶性肿瘤。LncRNA BCYRN1又名BC200、LINC00004,位于染色体2p21,是由RNA聚合酶Ⅲ转录的长度为200个核苷酸的非编码RNA。序列分析显示BCYRN1由3段不同序列的结构域组成,包括一个5'端的Alu片段、一段富含腺嘌呤的结构和一个富含胞嘧啶的区域[7]。笔者试图探究BCYRN1对肺腺癌细胞生物学行为的影响。
3.1 BCYRN1在多种肿瘤中的生物学功能 Gu等[5]研究表明,与癌旁对照组织相比,结肠癌肿瘤组织中BCYRN1表达明显上调,并且BCYRN1的过表达与肿瘤体积增大和晚期病理阶段相关。另有研究显示,BCYRN1的高表达与高度核分裂象相关,而核分裂是癌细胞侵袭行为的指标,提示其作为一种预后指标可评估早期乳腺肿瘤的侵袭能力[8]。Ming等[9]发现,将患者血浆内的BCYRN1和甲胎蛋白表达水平相结合可显著提高肝癌的诊断效能。周亚楠等[10]关于BCYRN1与食管鳞癌关系的研究表明,BCYRN1在食管癌中高表达,抑制其表达后,食管癌细胞的侵袭、迁移能力降低。上述研究揭示了BCYRN1作为一种促癌基因的潜能。
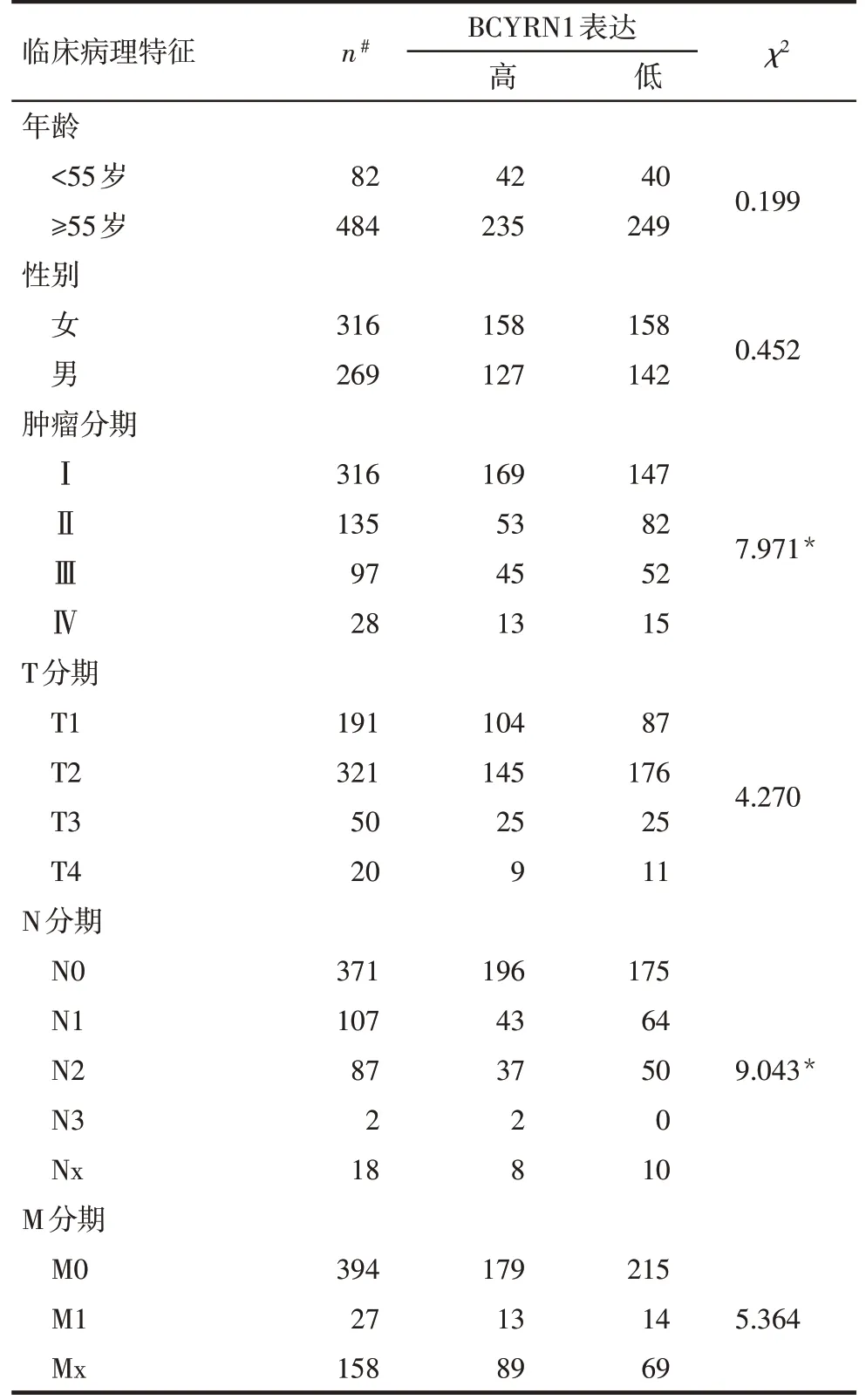
Tab.2 Relationship between expression level of BCYRN1 and clinicopathological characteristics of lung adenocarcinoma patients表2 BCYRN1表达水平与肺腺癌患者临床病理特征间的关系
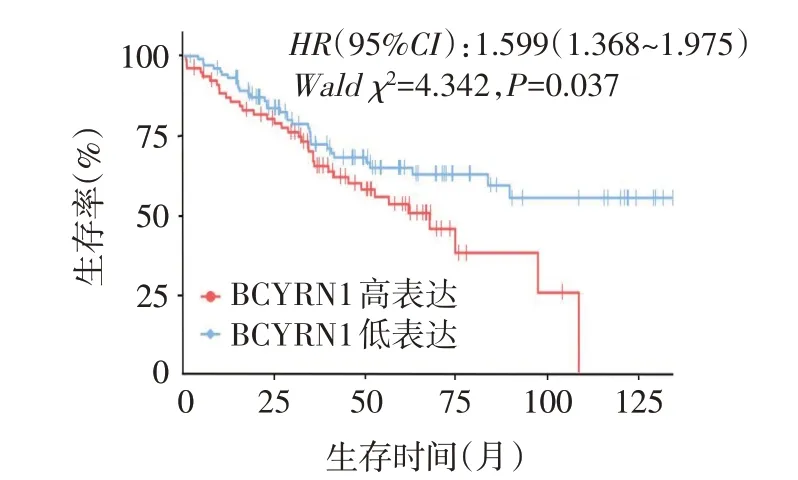
Fig.6 Survival curves of high and low expression groups of BCYRN1 in patients with lung adenocarcinoma图6 肺腺癌患者BCYRN1高、低表达组生存曲线
3.2 BCYRN1的潜在分子作用机制 LncRNA的生物学作用主要表现为顺式或反式转录因子的调控、mRNA的加工、转录后的调节和蛋白激活等功能[11]。此外,lncRNA已被发现在表观遗传以及基因表达调控中发挥重要作用[12]。LncRNA在肿瘤发生发展的多个病理过程中也发挥着积极的作用,参与多种分子通路的调控,可作为非小细胞肺癌(NSCLC)潜在的治疗靶点[13]。有研究显示lncRNA对肺癌有较好的诊断效能,转移相关肺腺癌转录本1(MALAT1)被视为诊断NSCLC的血液生物学标志物[14]。另一项研究表明,NSCLC患者的肌动蛋白丝相关蛋白1-反义RNA 1(AFAP1-AS1)明显高于对照组,患者血清中AFAP1-AS1高表达与远处转移、淋巴结转移、临床分期差、肿瘤体积大相关[15]。LncRNA参与表观遗传机制的调控,其可作为癌症治疗中克服或逆转耐药的新指标和靶点[16]。有研究者在BCYRN1分子机制的相关研究中发现,包含E1的冷激结构域(CSDE1)通过异二聚体作用与BCYRN1结合,并存在相互的调节作用[17]。体内研究显示,五味子乙素(Schisandrin B)通过上调miR-150降低BCYRN1的表达而影响大鼠气道平滑肌细胞的增殖和迁移[18]。3.3 BCYRN1在肺腺癌中的生物学功能 通过上述关于BCYRN1的相关研究,笔者试图探究BCYRN1在肺腺癌细胞中的表达,并进一步研究BCYRN1对肿瘤细胞生物学行为的影响。本研究通过qPCR证实,BCYRN1在肺腺癌细胞内的表达水平显著高于正常肺上皮细胞。流式结果显示,BCYRN1敲低的细胞出现显著的S期阻滞,并且凋亡细胞的比例也明显升高。通过划痕实验和Transwell实验发现敲低H1299细胞BCYRN1降低了细胞的迁移和侵袭能力。结合生物信息学分析结果,BCYRN1的高表达与肺腺癌患者的N分期和肿瘤分期相关。生存分析表明BCYRN1高表达的患者预后较差,与细胞功能实验结果一致。
综述所述,本研究证实BCYRN1在肺腺癌细胞中呈现高表达,肺腺癌中高表达的BCYRN1促进了癌细胞的恶性生物学行为,故推测BCYRN1在肺腺癌进展中可能有重要作用,但潜在分子机制仍有待深入研究和探讨。

