含硅羟基磷灰石调节巨噬细胞极性促进成骨分化机制研究
王志英,杨秋霞,田新利,林雪霞
硅是人体重要的微量元素,参与骨的代谢[1],而羟基磷灰石(HA)是骨的主要无机成分。含硅羟基磷灰石(si-HA)具有良好的骨传导性和骨诱导性,是一种性能优良的无机骨再生修复材料[2],多年来受到生物材料学界的普遍关注。但是,si-HA刺激成骨的确切机制尚未明确。既往研究多采用si-HA直接刺激成骨细胞,观察其成骨分化,实现骨再生修复[3]。然而,体内成骨过程是在由骨骼系统、免疫系统、循环系统等多个系统细胞协同营造的局部微环境中完成的,以往研究往往忽视了炎症反应在材料介导成骨过程中所起的重要作用。随着对宿主与生物材料相互作用研究的深入,学者们逐渐意识到生物材料植入体内,并非只与成骨细胞接触,首先与材料接触的是免疫细胞[4],免疫细胞是骨再生微环境的中心调控者[5]。在所有免疫细胞中,巨噬细胞是启动和维持炎症反应的主要细胞[6]。因此,本研究将巨噬细胞作为研究免疫调节的模型细胞。另据文献报道,巨噬细胞具有极大的功能可塑性[7]。一般认为其存在2种极化状态,即M1型(炎症型)和M2型(修复型)[8]。M1型巨噬细胞启动炎症反应,分泌大量的促炎因子;M2型巨噬细胞参与组织的后期修复[9-11]。在成骨生物材料的作用下,巨噬细胞产生何种极化状态,在其产生的免疫微环境中,前成骨细胞会产生何种成骨能力的改变,鲜有报道。本研究采用小鼠巨噬细胞(RAW264.7,RAW)和小鼠前成骨细胞(MC3T3-E1,3T3)通过体外实验探索该机制。
1 材料与方法
1.1 实验细胞、试剂与仪器 3T3和RAW均购自中国科学院上海细胞库,高糖DMEM培养基、胰酶、双抗、胎牛血清(Gibco,USA),CCK-8(biosharp生物科技公司),BCA试剂盒(Sigma公司,美国),碱性磷酸酶(ALP)活性检测试剂盒(日本WAKO公司),Trizol Reagent(Invitrogen公司),反转录试剂盒(Thermo公司),荧光定量聚合酶链反应(qPCR)试剂盒(Thermo Scientific公司)。CO2细胞培养箱(日本SANYO,MCO-15AC),倒置显微镜(日本OLYMPUS-CX41),低温高速离心机(德国Sartorius-3k30),超净工作台(苏州净化设备有限公司,BCM-1000),多功能酶标仪(美国BioTek公司-ELx808),超微量紫外分光光度计(美国NanoDrop公司,NanoDrop2000)。
1.2 HA和si-HA纳米粒子的制备 利用热化学沉淀法制备HA和si-HA纳米粒子。硝酸钙[Ca(NO3)2·4H2O]为钙源,磷酸氢二铵[(NH4)2HPO4]为磷源,醋酸硅[Si(CH3COO)4]在反应过程中水解提供硅源。据文献报道[3]和本实验室前期研究[12],当掺硅量为0.8%(质量分数)时,si-HA具有最高的生物成骨活性,因此本研究采用此硅含量的si-HA。合成步骤:称取Ca(NO3)2·4H2O 7.04 g和(NH4)2HPO43.094 g,分别溶于80 mL三蒸水中;将Ca(NO3)2·4H2O溶液倒入三口瓶,称取Si(CH3COO)4粉末0.248 g(HA合成时不再加入)加入三口瓶中;调节温度65℃,搅拌加热1 h,直至Si(CH3COO)4溶解;将温度设定为90℃,控制(NH4)2HPO4溶液缓慢均匀滴入三口瓶中,过程中不断加入浓氨水溶液,使pH值稳定在11;反应1 h后,制备样品静置过夜。
1.3 细胞培养及分组 3T3和RAW细胞均采用高糖DMEM培养基,置于恒温37℃、5%CO2培养箱进行培养。当细胞融合度达80%~90%时,3T3细胞采用胰酶消化,1 000 r/min离心6 min,收集细胞后传代。由于RAW细胞贴壁较牢,加入PBS,用细胞刮轻轻刮下,离心去除PBS,按1∶3比例进行传代。取对数生长期的3T3和RAW细胞用于后续实验。(1)RAW细胞分组。实验设Control组、HA组和si-HA组。Control组RAW细胞用含10%FBS的DMEM培养基培养,不加入材料;HA组和si-HA组RAW细胞在DMEM完全培养基中分别加入10 mg/L的HA和si-HA纳米粒子材料悬液进行培养。(2)3T3细胞分组。将完全培养基、HA和si-HA纳米粒子刺激RAW细胞3 d后获得的上清液,以1∶2的比例与完全培养基混合,称为条件培养基(RAW条件培养基、HA+RAW条件培养基和si-HA+RAW条件培养基)。将3T3细胞分别采用3种条件培养基进行培养,分为RAW组、HA+RAW组和si-HA+RAW组;另设空白对照组,采用DMEM完全培养基培养。
1.4 qPCR检测巨噬细胞的极化状态 RAW细胞在完全培养基、10 mg/L HA与10 mg/L si-HA纳米粒子材料悬液中分别培养3 d(Control组、HA组和si-HA组),采用qPCR检测RAW细胞M1极化标志物诱导型一氧化氮合酶(iNOS)、M2极化标志物Arginase基因及各种促炎、抗炎因子肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6、IL-10和IL-1ra的mRNA表达。细胞总RNA提取、cDNA合成、qPCR反应均按照相应试剂盒说明书进行。qPCR反应总体系10μL,包括5μL qPCR mix SYBR green,3.4μL Maxima SYBR Green/ROX qPCR Master Mix和浓度为10μmol/L的上、下游引物各0.4μL,10倍稀释的cDNA 0.8μL。反应条件:预变性95℃10 min;95℃15 s,60℃35 s,40个循环。以GAPDH为内参。采用2-ΔΔCt法计算细胞中基因相对表达量。实验重复3次。引物序列见表1。

Tab.1 Amplification of gene primers by qPCR表1 qPCR扩增基因引物序列
1.5 条件培养基对3T3细胞增殖及成骨分化的影响
1.5.1 3T3细胞在条件培养基中的增殖情况 取对数生长期3T3细胞,按密度3×103个/孔接种于96孔板中,置于37℃、5%CO2、湿度100%的培养箱中培养。待细胞贴壁后分别更换完全培养基(空白对照组)和不同的条件培养基(RAW条件培养基、HA+RAW条件培养基和si-HA+RAW条件培养基),每组均设置5个平行复孔,于培养箱中继续培养1、3和7 d。每孔加入含10%CCK-8的培养液100μL,培养箱中避光孵育1 h;酶标仪检测在450 nm处各孔细胞光密度(OD)值,分析细胞增殖情况。实验重复3次。
1.5.2 3T3细胞在条件培养基中的成骨分化能力(1)3T3细胞ALP活性定量分析。将3T3细胞按密度1×104个/孔接种于24孔板,贴壁培养24 h后,分别更换完全培养基(空白对照组)和不同条件培养基继续培养。培养基每2~3 d更换1次,待培养至7、14 d后终止培养,检测3T3细胞的ALP活性。提取细胞总蛋白,按照BCA试剂盒说明书步骤检测总蛋白浓度。ALP活性定量采用日本WAKO公司的ALP检测试剂盒,按照说明书步骤进行操作:向96孔板中加入100μL底物缓冲液,再分别加入20μL标准液或细胞裂解液,放入37℃烘箱孵育1 h;向96孔板每孔加入80μL反应终止液,于酶标仪中测定每孔在405 nm处的OD值。(2)3T3细胞基质矿化的茜素红染色及半定量分析。3T3细胞培养21 d后,吸去培养基,PBS漂洗3次后,4%多聚甲醛常温下固定20 min,加入1 mL茜素红染液染色15~20 min。镜下观察拍片后采用洗脱法进行半定量分析,步骤如下:在24孔板中,每孔加入1 mL洗脱液并上摇床以120 r/min摇匀至试样上染料充分溶解,每孔取3份150μL洗脱液,转入96孔板中,测定620 nm波长处OD值并使用空白洗脱液调零。(3)qPCR检测3T3细胞成骨相关基因表达。将3T3细胞按密度5×104个/孔接种于6孔板,分别培养7、14 d后提取总RNA,反转录为cDNA,采用qPCR法检测成骨基因ALP、OCN、OPN、Col-1、Runx2mRNA表达水平,以GADPH为内参。操作步骤同1.4,引物序列见表2。按照2-ΔΔCt法计算mRNA相对表达量。实验重复3次。

Tab.2 Amplification of osteogenic gene primers by qPCR表2 qPCR扩增成骨基因引物序列
1.6 统计学方法 采用SPSS 25.0软件对数据进行分析。计量资料以均数±标准差(x±s)表示,2组间比较采用独立样本t检验;多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 HA、si-HA纳米粒子对巨噬细胞极化状态及炎性因子mRNA表达的影响 与Control组相比,HA组巨噬细胞M1表型因子iNOS及促炎因子TNF-α、IL-1βmRNA表达水平升高,M2表型因子Arginase及抗炎因子IL-10mRNA表达水平降低(P<0.05)。si-HA组iNOS、TNF-α、IL-1βmRNA表达水平均低于Control组和HA组,Arginase、IL-10和IL-1ramRNA表达水平均高于Control组和HA组(P<0.05);IL-6mRNA表达水平低于HA组(P<0.05),与Control组差异无统计学意义(P>0.05),见表3。
2.2 巨噬细胞的极化状态对3T3细胞增殖能力的影响 各组3T3细胞在完全培养基和不同条件培养基培养1、3、7 d时的细胞增殖能力依次增强,组间多重比较差异均有统计学意义(P<0.05)。培养1 d时,各组细胞增殖能力差异无统计学意义(P>0.05);培养3、7 d时,si-HA+RAW组3T3细胞增殖能力明显强于空白对照组、RAW组和HA+RAW组(P<0.05),见表4。
2.3 巨噬细胞的极化状态对3T3细胞成骨分化能力的影响
2.3.1 3T3细胞ALP活性的定量分析 3T3细胞在完全培养基和不同条件培养基培养7、14 d时,RAW组3T3细胞ALP活性与空白对照组差异无统计学意义(P>0.05);si-HA+RAW和HA+RAW组3T3细胞ALP活性均显著强于空白对照组和RAW组,si-HA+RAW组3T3细胞ALP活性明显强于HA+RAW组(P<0.05),见表5。
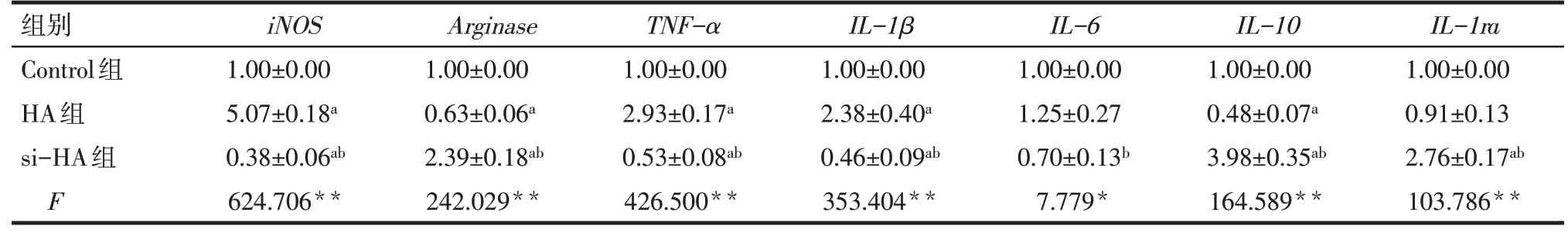
Tab.3 Comparison of the mRNA expression levels of inflammatory factors between the three groups of macrophages表3 3组巨噬细胞炎性因子mRNA表达水平的比较 (n=3,x±s)
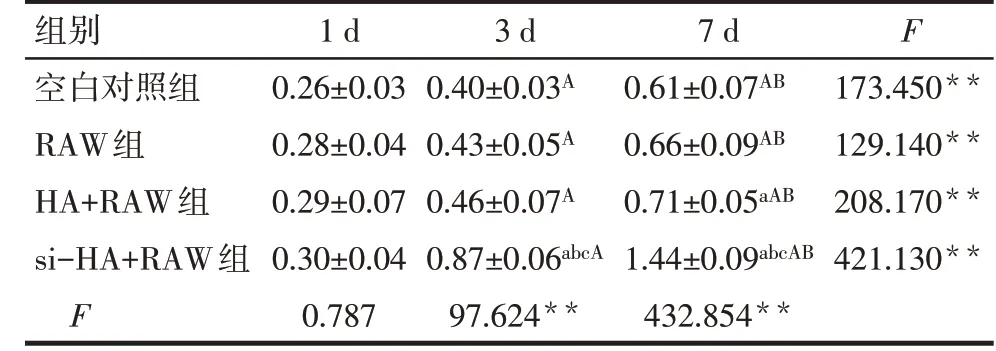
Tab.4 Comparison of the 3T3 cell growth after treatment with different conditioned medium between the four groups表4 不同条件培养基处理后3T3细胞生长情况比较(n=3,OD值,x±s)
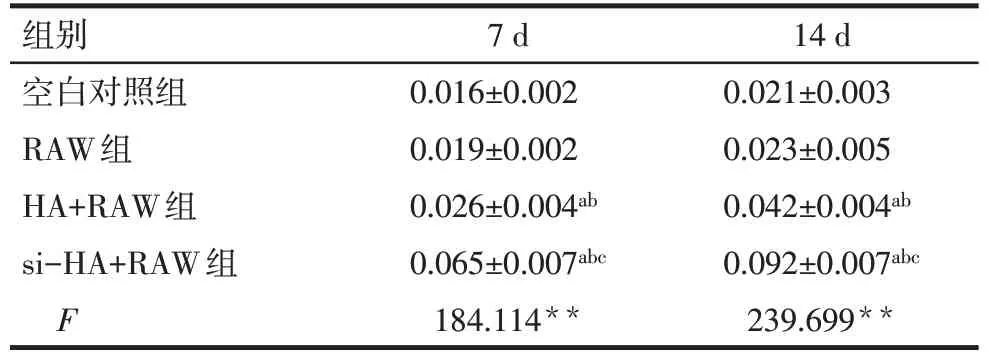
Tab.5 Comparison of the ALP activity between the four groups of 3T3 cells表5 各组3T3细胞ALP活性的比较 (n=3,x±s)
2.3.2 3T3细胞基质矿化的茜素红染色及半定量分析结果 3T3细胞在完全培养基和不同条件培养基培养21 d后,HA+RAW组和si-HA+RAW组均有大量红色钙结节形成,空白对照组和RAW组中几乎无着色的钙结节,见图1。半定量分析结果显示,空白对照组、RAW组、HA+RAW组和si-HA+RAW组OD值分别为0.200±0.030,0.209±0.032,0.933±0.040和1.637±0.061,差异有统计学意义(F=578.606,P<0.01)。si-HA+RAW和HA+RAW组3T3细胞OD值高于空白对照组和RAW组,si-HA+RAW组3T3细胞OD值显著高于HA+RAW组(P<0.05)。RAW组与空白对照组差异无统计学意义(P>0.05)。
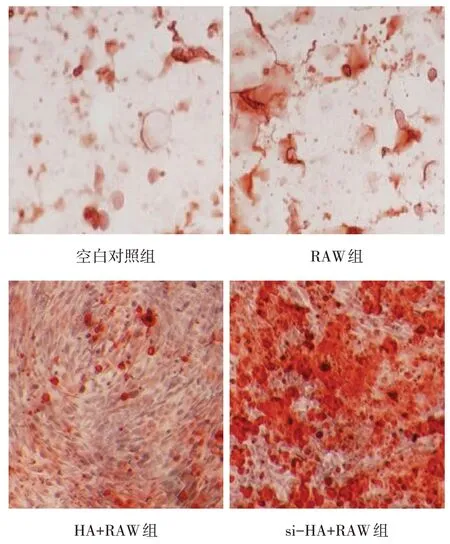
Fig.1 Images of calcium nodules 21 days after osteogenic differentiation(×200)图1 成骨分化21 d后钙结节的茜素红染色(×200)
2.3.3 各组3T3细胞成骨相关基因mRNA表达水平变化 3T3细胞在完全培养基和不同条件培养基培养7 d时,si-HA+RAW组3T3细胞ALP、Col-1、Runx2mRNA表达水平高于空白对照组、RAW组和HA+RAW组(P<0.05),OPNmRNA表达水平与其他3组差异无统计学意义(P>0.05);HA+RAW组ALP、Runx2mRNA表达水平高于空白对照组和RAW组(P<0.05)。培养14 d时,si-HA+RAW组3T3细胞ALP、OCN、OPN、Col-1、Runx2mRNA表达水平均高于其他3组(P<0.05);HA+RAW组ALP、Runx2mRNA表达水平高于空白对照组和RAW组,OCNmRNA表达水平高于空白对照组,Col-1mRNA表达水平高于RAW组(P<0.05),见表6。
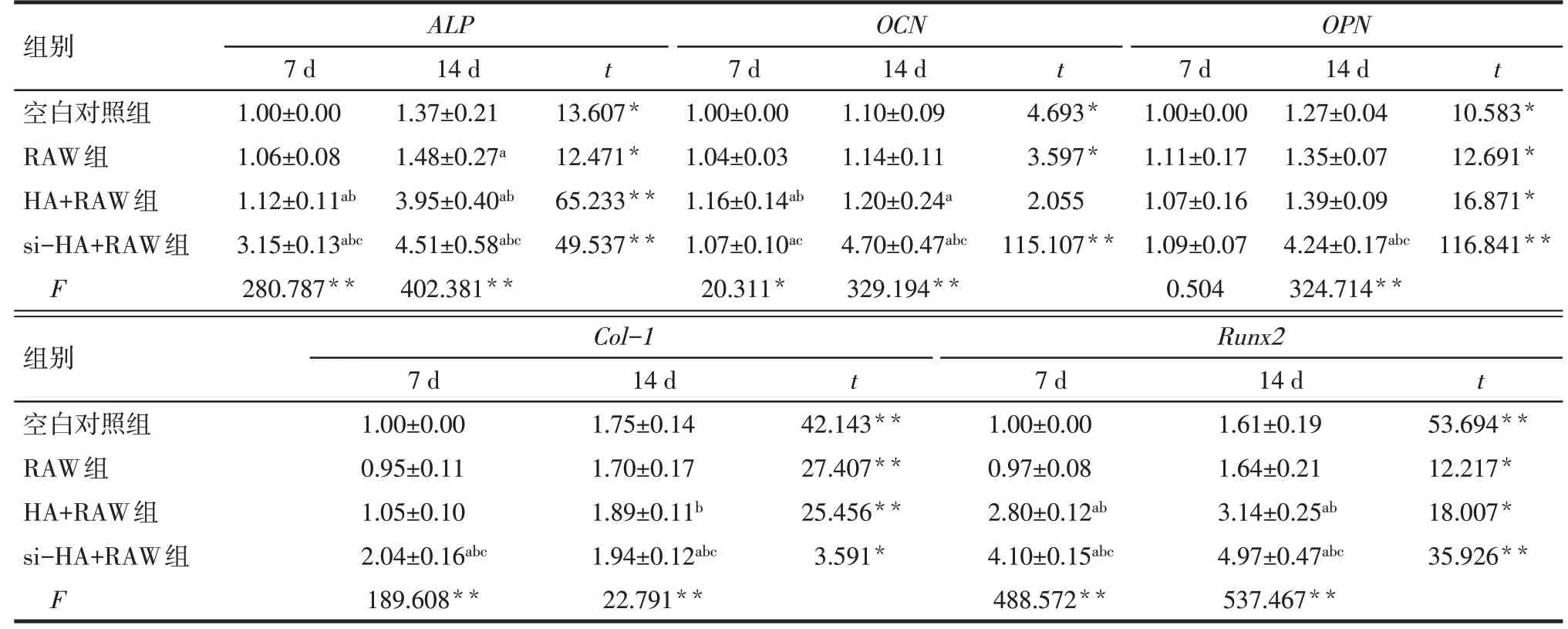
Tab.6 Comparison of mRNA expression levels of bone related genes between the four groups表6 各组成骨相关基因mRNA表达水平的比较 (n=3,x±s)
3 讨论
硅是结缔组织发育和骨代谢中重要的微量元素。多项研究表明含硅的生物材料可促进成骨细胞分化,如含硅的磷灰石、生物活性玻璃和硅酸钙水泥等[13-14],但其刺激成骨的确切机制尚未明确。
有研究发现,免疫系统参与骨缺损部位的骨形成过程,并发挥重要的调节作用[15-16]。外周巨噬细胞主要参与炎症和宿主防御反应,特别是机体固有免疫反应[17]。当骨修复材料植入缺损部位后可导致机体产生固有免疫反应和适应性免疫反应,过度的炎症反应可引起“异物反应”,形成慢性炎症以及纤维包裹,将“异物”与机体隔绝或者排出体外[18]。因此,机体反应既可阻碍生物材料发挥成骨作用,也可通过调节成骨和破骨细胞的活性及分化而促进骨形成[19],适当控制免疫反应是促进成骨的重要手段[20]。本研究从骨免疫学的角度对羟基磷灰石和si-HA纳米粒子进行分析,通过体外细胞实验研究巨噬细胞在不同材料悬液的作用下产生的免疫微环境对成骨过程的影响。
M1、M2是巨噬细胞的2种极化类型。M1又称经典性活化,分泌多种促炎细胞因子,包括炎性因子(TNF-α、IL-1β、IL-6、IL-12、IL-18),趋化因子,活性氧和氮中间产物等[21];M2又称替代性活化,主要通过分泌细胞因子,如纤维连接蛋白、IL-1β、IL-6、IL-10和转化生长因子-β(TGF-β)等,发挥抗炎及维持组织平衡功能[22]。巨噬细胞通过M1、M2极化表型分泌不同的炎性细胞因子调控炎症的发生、发展过程。本研究发现小鼠巨噬细胞在不同纳米粒子的材料悬液中产生不同的极化状态。si-HA能够显著抑制M1表型因子iNOS和促炎细胞因子TNF-α和IL-1β的表达,进而抑制炎症反应。同时si-HA材料悬液显著促进RAW细胞M2表型因子Arginase和抗炎因子IL-10和IL-1ra的表达,提示经si-HA纳米粒子刺激后,RAW细胞表现出向M2极化的趋势。相反,在HA纳米粒子作用下小鼠RAW巨噬细胞的基因表达倾向于促炎型,促炎基因iNOS、TNF-α和IL-1β的表达显著上调,提示HA和si-HA悬液对巨噬细胞M1/M2极化产生了不同的调控作用。
目前对于巨噬细胞的不同表型对成骨的作用尚未达成共识。Chen等[23]研究认为人巨噬细胞上清液可抑制间充质干细胞(MSC)成骨分化的过程,主要是由于上清液中含有大量的TNF-α和IL-1β。Lee等[24]研究发现钛颗粒活化的小鼠巨噬细胞抑制小鼠前成骨细胞成骨分化,主要是由于巨噬细胞分泌的TNF-α可抑制Wnt和BMP2信号通路。M1型巨噬细胞启动炎症反应,分泌大量的促炎因子,可抑制成骨分化;M2型巨噬细胞参与组织的后期修复,巨噬细胞适度地向M2极化可促进骨生成;然而也有研究表明M1型巨噬细胞具有促进骨生成的作用[25]。因此,本研究旨在探究在HA和si-HA纳米粒子刺激下,巨噬细胞不同极化状态所产生的免疫微环境对小鼠前成骨细胞的增殖和成骨分化能力的影响。
本研究结果显示,si-HA+RAW组3T3细胞的增殖能力显著高于其他3组,提示HA中掺入硅所刺激产生的微环境能更好地促进3T3细胞增殖,使细胞具有更高活力。
ALP是成骨细胞表型和早期成骨分化的典型标志物,是检测成骨细胞分化的重要指标。本研究结果显示,3T3细胞采用完全培养基、RAW、HA+RAW和si-HA+RAW条件培养基培养7、14 d时,si-HA+RAW组和HA+RAW组3T3细胞ALP活性显著高于空白对照组和RAW组,且si-HA+RAW组明显高于HA+RAW组,提示si-HA+RAW条件培养基具有较强的刺激成骨作用。3T3细胞在成骨分化后期会出现钙结节现象,这是成骨分化后期的另一重要标志。本研究结果显示,si-HA+RAW组和HA+RAW组3T3细胞的矿化结节形成显著高于空白对照组和RAW组。另外,3T3细胞在完全培养基和不同条件培养基培养7 d时,si-HA+RAW组3T3细胞ALP、Col-1、Runx2 mRNA表达水平高于其他3组;培养14 d时,si-HA+RAW组3T3细胞ALP、OCN、OPN、Col-1、Runx2 mRNA表达水平均高于其他3组。这些结果均提示在si-HA的刺激下,巨噬细胞的极化状态可显著促进3T3细胞的增殖与成骨分化。
综上所述,si-HA纳米粒子可诱导巨噬细胞产生较有利的骨免疫微环境,增强3T3细胞的增殖和成骨分化。

