化学改性沸石对重金属离子去除的研究进展
周娟苹,历新宇,杨 旭,韩顺玉,孟 万,,姜男哲,
(1.延边大学理学院化学系,延吉 133000;2.延边大学工学院高分子材料与工程系,延吉 133000)
0 引 言
随着工业的快速发展,电镀、印染、化工等行业的重金属离子废水被排放到水体中,造成了严重的环境污染,威胁着人类的健康[1-2]。因此,急需寻找一种经济、高效、绿色的处理方法来去除废水中的重金属离子,防治重金属污染[3]。
处理重金属污染的一般方法有:化学法[4]、生物法[5]、膜分离技术[6]、离子交换法[7]。这些方法普遍存在处理成本高、稳定性差、易产生二次污染等问题。吸附法因具有吸附剂种类多、效率高、操作简单、可逆性好等优点,被认为是一种经济、可持续的重金属去除技术[8]。目前,学者们已经制备了不同种类的吸附剂,比如活性炭、壳聚糖、生物吸附剂、纳米材料等[9-11],并研究了其去除性能。然而,上述吸附剂普遍存在研究成本高、制备工艺复杂、二次污染风险大等问题[12-13]。
沸石分子筛是由硅氧四面体和铝氧四面体形成的具有三维晶体结构的多孔硅铝酸盐,硅氧四面体和铝氧四面体由四个顶点氧原子连接在一起[14]。近年来,沸石因来源广泛、制备简单、绿色环保等优点,受到研究者们的广泛关注。沸石表面的硅羟基容易与重金属离子络合,并且沸石中的阳离子具有离子交换的性质,因此,沸石分子筛在重金属离子吸附领域表现出了优异的性能[15]。然而,无论是天然沸石还是合成沸石,均存在孔道内含有杂质、孔道单一、表面活性低等问题,这使其在重金属离子吸附领域无法达到最好的吸附效果[16-17]。为了提高沸石分子筛对重金属离子的吸附性能,需要对其进行改性处理[18-19]。本文总结了沸石的化学改性方法,对比了改性沸石去除重金属离子污染的效果,并对其未来发展方向进行了展望。
1 阳离子交换改性
沸石分子筛的阳离子交换改性是利用不同离子的盐溶液与分子筛骨架外阳离子进行交换,以增强沸石分子筛的离子交换性能,提高其吸附性的一种方法[20-21]。阳离子交换改性操作简单,并且保证了沸石结构的完整性,是较为常用的一种改性方法[22]。Panayotova[23]分别用NaCl和CH3COONa溶液改性天然斜发沸石,提高了沸石中Na+的相对浓度,使其对Ni2+的吸附量提高了25%~30%。分析表明,在单一组分溶液中,改性沸石释放的Na+和Ni2+的吸附量之间有很好的相关性,Na+是其主要的交换离子,而多组分溶液中,Mg2+和Ca2+的存在降低了改性沸石对Ni2+的吸附量。Ates[24]分别用NaCl、NH4Cl、Al2(SO4)3与天然沸石进行离子交换,获得改性沸石。在Mn2+的吸附试验中发现,Al2(SO4)3改性沸石的平衡吸附量为25.1 mg·g-1,吸附性高于其他改性沸石(NaCl改性沸石吸附量为10.0 mg·g-1,NH4Cl改性沸石吸附量为24.3 mg·g-1)。经研究,Al3+的半径、水合能与Mn2+相近,相比于其他阳离子改性沸石,Al3+改性沸石吸附时间更短,吸附量更大。在Li等[25]的研究中,经NaCl溶液改性后的斜发沸石对Zn2+的吸附量为28.12 mg·g-1,当溶液中同时存在Zn2+、Pb2+、Cd2+、Cu2+时,其对Zn2+的吸附量降低到3.60 mg·g-1,但该改性沸石对Pb2+的吸附量始终高达44.40~45.30 mg·g-1。这说明重金属离子中存在竞争吸附,并且改性沸石优先吸附具有特定大小、电荷、水合离子半径、水合能的重金属离子。由此可知,虽然阳离子交换改性沸石更容易从废水中选择性吸附重金属离子,但是阳离子交换改性沸石分子筛的水热稳定性较差,对废水的酸碱性要求较高。同时,竞争吸附会造成重金属离子去除不彻底,因此,此方法在未来将面临巨大的挑战。
2 孔结构改性
沸石孔结构改性是利用酸、碱试剂脱去沸石中的硅或铝原子以增大孔径,同时清除沸石孔道内杂质的一种改性方法[26]。增大沸石的孔径以及修饰孔道结构可以使沸石孔内的位阻变小,内扩散速度加快,增大对重金属离子的交换量[27-29]。酸性试剂通过溶解沸石骨架中的铝原子以形成新的孔道结构,增加比表面积,提高吸附量[30]。Aghel等[31]用5 mol·L-1的盐酸改性沸石,经过15 h的处理得到改性斜发沸石。改性斜发沸石的孔体积提高了2倍,比表面积提高了6倍,在最佳操作条件下,对废水中Cd2+和Pb2+的去除率分别提高至85.9%和98.9%。Adinehvand等[32]用硫酸改性斜发沸石,增大了其比表面积,将Zn2+的去除率提高至93.5%,并且将吸附时间缩短至200 min。经研究发现,酸度影响沸石的吸附效率,在pH值为3~6时,改性沸石对Zn2+的去除率在22.19%~93.52%内浮动。从上述研究中不难发现,酸性试剂增大了沸石的比表面积,修饰了孔道结构,提高了对重金属离子的吸附量,缩短了到达平衡吸附量的时间。但是,酸处理过程较为复杂,耗时长,并且破坏了沸石的酸度和稳定性。
为了弥补酸改性带来的不足,研究人员用碱性试剂处理沸石解决了改性沸石稳定性的问题。碱性溶液通过选择性溶解沸石框架中的硅,改变其结构特征,从而增强其吸附性[33]。张健等[34]用NaOH溶液对ZSM-5沸石处理24 h,在NaOH浓度为0.5 mol·L-1,温度为30 ℃时,碱改性沸石分子筛对Pb2+的吸附量为54.64 mg·g-1,是未改性沸石的1.6倍。经研究发现,介孔孔容增大、比表面积增大、硅铝比降低是提高沸石分子筛吸附性的主要原因。Ates等[35]用NaOH溶液处理天然斜发沸石,并研究了沸石对Mn2+的吸附性能。由于Na+的引入和SiO2的脱除,改性沸石增加了强酸位点,其吸附量是天然沸石的2倍。沸石经1.5 mol·L-1的NaOH溶液处理后,对Mn2+的吸附量达到最大,当NaOH溶液浓度超过该值时,不仅使沸石对Mn2+的吸附能力降低,而且导致沸石结构坍塌。Gili等[36]用400 kGy的γ射线辐照NaOH溶液改性的天然沸石,发现碱改性沸石的稳定性较强,并且γ射线辐照的改性沸石吸附量进一步增大。这说明,无论酸处理还是碱处理,都是对沸石的孔道结构、孔径大小和硅铝比进行调整。但是,碱处理的沸石分子筛稳定性更好,并且脱硅增强了其亲水性,使分子筛易于去除废水中的重金属离子。然而,酸、碱处理都需要耗费大量的时间,并且处理过程中产生的气体和废液难以处理,有二次污染的风险。
3 晶体表面改性
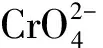
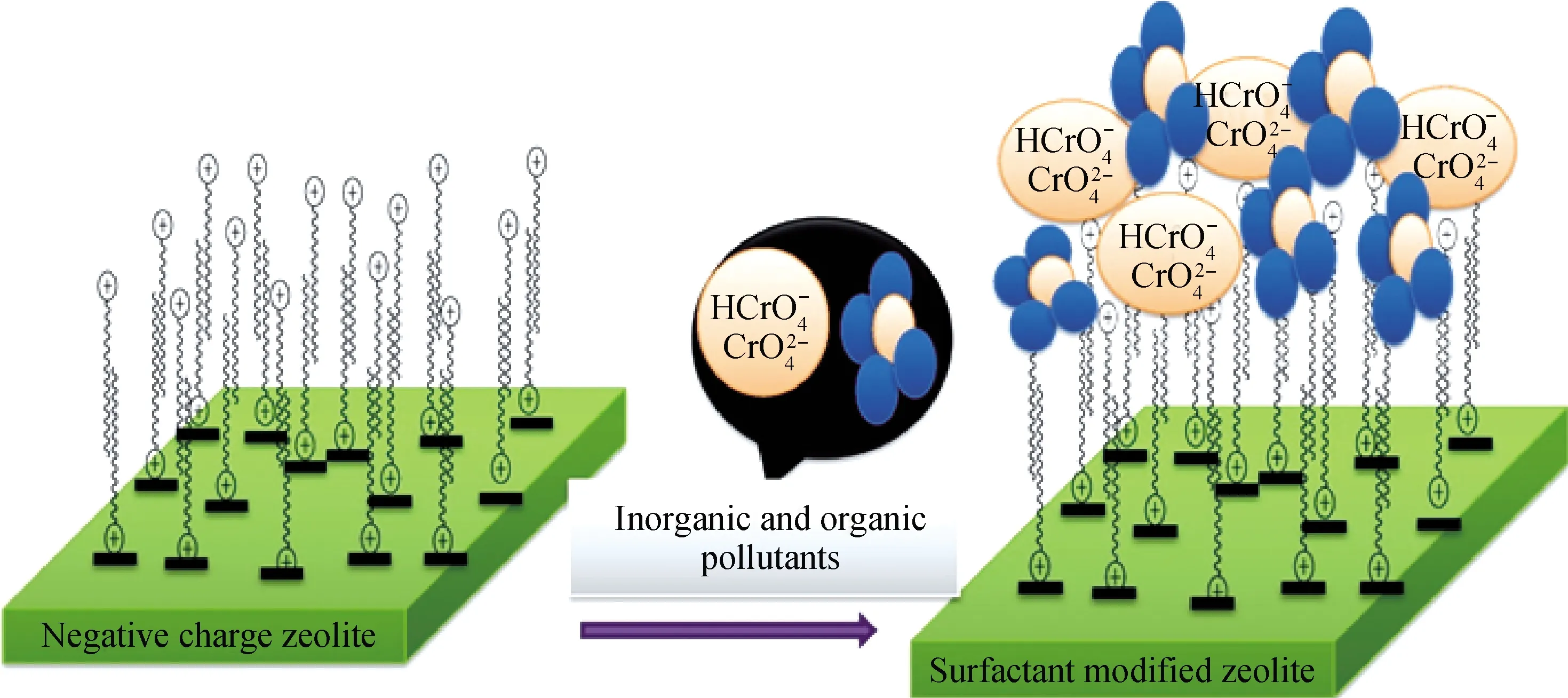
图1 表面活性剂改性沸石吸附重金属离子[39]Fig.1 Adsorption of heavy metal ions by surfactant modified zeolite[39]
图2 HDTMA改性斜发沸石过程[42]Fig.2 Modification of clinoptilolite by HDTMA[42]
除表面活性剂外,含氨和硫的有机试剂也常用于沸石晶体表面改性中。Tilami等[45]用甲硫氨酸为模板合成方沸石,以期提高其对重金属离子的吸附性能。结果表明,改性沸石在Cu2+和Ni2+的吸附过程中形成了铜硫键和镍硫键,将方沸石对Cu2+和Ni2+的最大吸附量由45.4 mg·g-1和32.25 mg·g-1提高至62.5 mg·g-1和40 mg·g-1,进一步优化了沸石的吸附性能。Zhang等[46]在无模板体系中合成了Y沸石、A沸石和丝光沸石,并用硫脲对产物进行了改性。在Cd2+的去除研究中,改性沸石对Cd2+的去除是通过离子交换和络合过程进行的。在25 ℃时,三种改性沸石对Cd2+的吸附量达到最大值,分别为94.3 mg·g-1、103.2 mg·g-1和89.7 mg·g-1。
4 负载改性
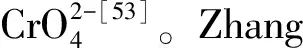
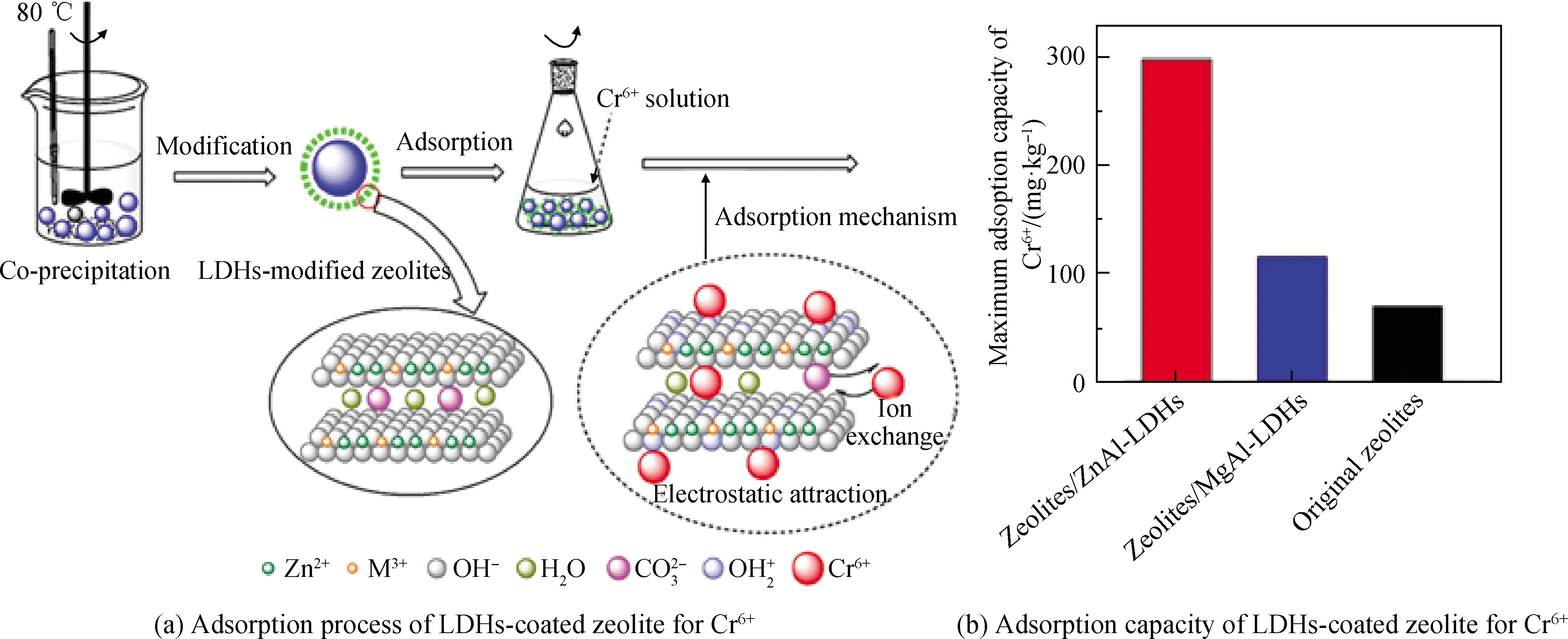
图3 LDHs包覆沸石吸附Cr6+的过程与吸附量[54]Fig.3 Adsorption process and adsorption capacity of LDHs-coated zeolite for Cr6+[54]
5 磁改性

图4 磁铁吸附磁改性沸石[60]Fig.4 Magnet-adsorbed magnetically modified zeolite[60]

图5 磁改性沸石吸附Cd2+[63]Fig.5 Adsorption of Cd2+ by magnetically modified zeolite[63]
6 粒径调控
近年来,广受青睐的纳米材料在不同领域表现出巨大的潜力。粒径逐渐减小的合成沸石作为吸附剂在去除重金属离子方面的优异性也越发明显[65-67]。亢玉红等[68]以粉煤灰为原料,用水热反应两步合成了2 μm的高纯度X型沸石,比表面积高达872.52 m2·g-1,总孔容为0.341 cm3·g-1,经吸附试验发现X型沸石对Cu2+饱和静态吸附量为62.28 mg·g-1。彭利冲等[69]用绿泥石合成了1~2 μm的NaX沸石,进一步提高了X型沸石的比表面积,研究表明,当初始温度从298 K提高到318 K时,对Cu2+的吸附量从125.471 mg·g-1增加到151.745 mg·g-1,并且吸附量随着Cu2+初始浓度的增加而增加。Luo等[70]以高岭土为原料,采用水热法合成了针状纳米沸石,对Cu2+和Pb2+的吸附量增加了近20倍,其中对Cu2+的吸附量为372.18 mg·g-1,对Pb2+的吸附量为431.0 mg·g-1。经研究,针状纳米沸石去除重金属离子的机理是沸石中富集的Na+与重金属离子之间的离子交换。同时,针状纳米结构使沸石总孔隙率、介孔孔隙率、吸附量和比表面积显著增加,增强了其吸附性能。Yilmaz[71]以0.007 μm的SiO2为原料合成出粒径为170 nm的NaX沸石。随着初始金属离子浓度的增加,NaX沸石对Pb2+、Ni2+、Cu2+、Ag+的吸附量均增大,分别达到0.99 mmol·g-1、1.33 mmol·g-1、2.11 mmol·g-1、1.89 mmol·g-1。Goncalves等[72]合成了具有较多可用离子交换位点和高比表面积的八面体沸石,15 nm的粒径使金属离子容易扩散到吸附活性位点。研究发现,该吸附剂在去除Cd2+、Zn2+和Cu2+方面具有优异的性能,吸附量大小顺序为Cd2+(133 mg·g-1)> Zn2+(115 mg·g-1)> Cu2+(99 mg·g-1),这与金属离子水合能绝对值增加的顺序一致。显然,沸石分子筛粒径越小,比表面积越大,对重金属离子的吸附性也越强。因此,纳米沸石分子筛在重金属离子去除领域有较好的发展前景。然而,在研究纳米沸石分子筛吸附性的过程中发现,较小的孔径结构增强了沸石的选择吸附性,对半径较大的重金属离子响应性低,不能彻底去除工业废水中的重金属离子,并且难以回收利用,容易对环境造成二次污染。若想实现纳米沸石分子筛的工业化,可以将其设计成整体式多级孔结构的沸石,解决不同重金属离子的吸附和回收问题。
以上六种化学改性方法的原理、所用试剂、以及优缺点如表1所示。

表1 六种化学改性方法的原理及优缺点Table 1 Principles, advantages and disadvantages of six chemical modification methods
7 总结与展望
随着重金属污染问题日益突出,改性沸石作为吸附剂在重金属废水处理领域的应用越来越广泛。因此,极有必要寻找一种简单、高效的改性方法制备对重金属离子具有高吸附性能的沸石材料。虽然现有的改性方法,如沸石晶体尺寸调控、阳离子交换改性,表面及结构改性、负载改性、磁改性等都可以有效提高沸石对重金属离子的吸附效果,但制备成本较高、改性条件复杂、难以回收,以及易产生二次污染等缺点使其无法走向工业化。因此,如何改性或合成高效处理重金属废水的沸石分子筛值得研究者们进一步探究:
(1)针对性地根据沸石的内部结构和表面性质,探索出绿色、经济、普适性强的改性方法,以期从根本上解决沸石改性耗时长、工艺烦琐等问题,为工业重金属水污染治理提供低成本、高吸附能力的沸石吸附剂。
(2)当前对沸石吸附重金属离子的研究,大部分仅限于影响因素研究,对于吸附机理的探讨还不够深入透彻。若能在分子水平上认识沸石对重金属离子的处理过程,将更有利于改性沸石的定向制备。
(3)纳米沸石分子筛具有较大的比表面积,在重金属离子吸附领域有着较为广阔的应用前景,但是纳米沸石面临着颗粒小、选择性高、无法回收等现实性问题,因此,纳米沸石的设计、制备以及吸附原理等方面需要进一步研究。

