miR-214抑制Livin表达对喉鳞状细胞癌细胞增殖和凋亡的影响
罗德艳,冯俊,彭涛,唐一萍,杨久梅
川北医学院第二临床医学院 南充市中心医院耳鼻喉科,四川南充 637000
喉癌是一种发病率较高的头颈部恶性肿瘤,其中绝大多数是喉鳞状细胞癌(LSCC)。随着环境污染的加重及人口老龄化的加剧,LSCC的发病率一直居高不下[1]。LSCC 与遗传、环境、吸烟、饮酒等诸多因素有关,但具体的发病机制尚不明确。尽管近年来LSCC 在诊断和治疗方面取得了一定的进展,但在过去的三十年,LSCC 患者的5年生存率并没有得到明显改善[2],因此探索新的治疗LSCC 的有效方法意义重大。微小RNA(miRNA)是一类非编码的小分子RNA,在调控细胞发育、分化、增殖和凋亡等过程中发挥重要作用[3]。研究显示,miRNA 可作为癌基因或抑癌基因调控肿瘤的发生发展,这为肿瘤的治疗提供了新的研究方向[4]。基因芯片技术揭示LSCC 组织中存在许多差异表达的miRNA,可能与其发生进展机制有关[5]。miR-214 是近年来发现的与恶性肿瘤有关的miRNA[6],但至今miR-214 在LSCC 中的作用尚不清楚。2020年9月—2021年2月,本研究观察了miR-214 在LSCC 细胞中的表达情况,并进一步探讨miR-214 表达对LSCC 细胞增殖和凋亡的影响及可能的分子机制。
1 材料与方法
1.1 主要试剂 TRIzol 试剂、LipofectamineTM2000(美国Invitrogen 公司);蛋白提取试剂盒(北京康为世纪生物科技有限公司);CCK-8 增殖检测试剂盒(武汉博士德生物工程有限公司);Annexin V/FITC细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司);miR-214模拟物(miR-214 mimics)和模拟物阴性对照(miR-NC)、荧光素酶报告基因质粒(上海吉玛制药技术有限公司);PCR 引物(苏州金唯智生物科技有限公司);反转录试剂盒、实时荧光定量PCR(RT-qPCR)试剂盒(大连宝生物工程有限公司);荧光素酶检测试剂盒(美国Promega 公司);一抗兔抗人Bcl-2、Bax、Livin 和GAPDH 抗体(美国Santa Cruz 公司);HRP标记的二抗羊抗兔IgG(美国Bioworld)。
1.2 方法
1.2.1 细胞培养、转染及分组 人LSCC 细胞FD-LSC-1、TU177及正常永生化表皮细胞Hacat均购自美国ATCC 细胞库,Hep-2由华西医学中心实验室惠赠。 Hep-2、FD-LSC-1、TU177 细胞均培养在含10% 胎牛血清的RPMI1640 培养基中,Hacat 细胞培养在含10% 胎牛血清的DMEM 培养基中。转染操作时,取生长状态良好的对数生长期TU177 细胞接种至6 孔板,细胞分为miR-214 mimics 组和miR-NC组,miR-214 mimics 组每孔加入100 pmol miR-214 mimics 和5 μL 转染试剂,miR-NC 组每孔加入100 pmol miR-NC 和5 μL 转染试剂,按照Lipo⁃fectamineTM2000 试剂说明书操作进行转染,转染后24 h收集细胞进行后续实验。本研究经过我院医学伦理委员会批准。
1.2.2 miR-214 表达检测 采用RT-qPCR 技术。收集Hep-2、FD-LSC-1、TU177、Hacat 细胞以及转染后24 h 的各组TU177 细胞,按照TRIzol 试剂说明书操作提取细胞总RNA,应用反转录试剂盒将提取的总RNA反转录为cDNA。 以cDNA为模板,加入miR-214 及内参U6 引物以及荧光染料,应用RTqPCR 试剂盒配置反应体系进行PCR 反应。PCR 反应条件:94 ℃30 s、94 ℃20 s、60 ℃30 s、72 ℃30 s 40个循环。 miR-214 上游引物序列为5'-TATACAT⁃CAAACAGCAGGCACA-3',下游引物序列为5'-CATTCGATCTTCTCCACAGTCTC-3'。U6上游引物序列为5'-CTCGCTTCGGCAGCACA-3',下游引物序列为5'-AACGCTTCACGAATTTGCGT-3'。采用2-∆∆Ct法计算miR-214 相对表达量。
1.2.3 细胞增殖活性检测 采用CCK-8 实验。取转染24 h 后的各组TU177 细胞,按照1×104/孔的细胞密度接种至96 孔板中,继续培养24、48、72 h 后,各孔分别加入10 μL CCK-8 试剂,继续避光培养4 h,酶联免疫检测仪测定各孔450 nm波长处的光密度(OD)值。
1.2.4 细胞克隆形成能力检测 采用平板克隆形成实验。取转染24 h 后的各组TU177 细胞,常规胰酶消化,调整细胞浓度,制备细胞悬液,分别以1 000个/皿的细胞密度接种,常规培养14 d后,4%多聚甲醛固定20 min,染色20 min。应用显微镜下观察细胞克隆形成情况,计数克隆数(超于50个细胞的集落表示为1个克隆)。
1.2.5 细胞凋亡率测算 采用流式细胞术。取转染24 h 后的各组TU177 细胞,加入结合缓冲液重悬调整细胞浓度为1×106/mL,每组取100 μL细胞悬液,加入流式管,按照细胞凋亡检测试剂盒说明书操作先加入Annexin V-FITC 5 μL混匀后,再加入PI 5 μL混匀,避光孵育。1 h内上流式细胞仪进行检测。
1.2.6 细胞中Bcl-2、Bax 和Livin 蛋白检测 采用Western blotting 法。取转染24 h 后的各组TU177 细胞,应用蛋白提取试剂盒提取总蛋白。取30 μg 总蛋白上样,行10% SDS-PAGE 电泳,将蛋白转印到PVDF 膜,5% 脱脂乳4 ℃泡膜4 h,分别加入适当浓度的Bcl-2(稀释度1∶2 000)、Bax(稀释度1∶2 000)、Livin(稀释度1∶1 000)和GAPDH(稀释度1∶2 000)一抗,4 ℃孵育过夜。洗膜后加入HRP 标记的二抗IgG(稀释度1∶5 000),37 ℃孵育2 h 后,ECL 显影液显影,凝胶成像系统采集图像。
1.2.7 miR-214 和Livin 靶向调控关系检测 采用双荧光素酶报告基因实验。收集TU177细胞接种于24 孔板,将细胞分为miR-214 mimics+WT-Livin组、miR-214 mimics+MUT-Livin组、miR-NC+WT-Livin组、miR-NC+MUT-Livin组。将携带野生型和突变型基因靶点Livin 3' UTR的荧光素酶报告基因质粒WT-Livin和MUT-Livin,应用转染试剂LipofectamineTM2000 分别与miR-214 mimics 和miR-NC 共转染至各组TU177细胞,继续培养24 h 后,裂解各组细胞,按照荧光素酶检测试剂盒说明书操作检测细胞的荧光素酶活性。
1.2.8 统计学方法 采用SPSS22. 0 统计软件。符合正态分布的计量资料以±s表示,组间比较采用单因素方差分析或t检验。P<0. 05 为差异有统计学意义。
2 结果
2.1 细胞中miR-214 表达比较 Hep-2、FD-LSC-1、TU177、Hacat 细胞中miR-214 的相对表达量分别为0. 53 ± 0. 09、0. 46 ± 0. 10、0. 19 ± 0. 07、1. 02 ±0. 03,与Hacat细胞相比,Hep-2、FD-LSC-1、TU177细胞中miR-214的相对表达量降低(P均<0. 05),TU177细胞中最低,故选用TU177细胞进行后续实验。
2.2 两组TU177 细胞miR-214 表达比较 miR-214 mimics 组、miR-NC 组miR-214 相对表达量分别为3. 24 ± 0. 26、0. 98 ± 0. 04,与miR-NC 组 相比,miR-214 mimics 组miR-214 相对表达量升高(P<0. 05)。
2.3 两组TU177细胞增殖活性比较 与miR-NC组相比,miR-214 mimics 组24、48、72 h 的OD 值均降低(P均<0. 05),见表1。
表1 两组TU177细胞不同时点OD值比较(± s)
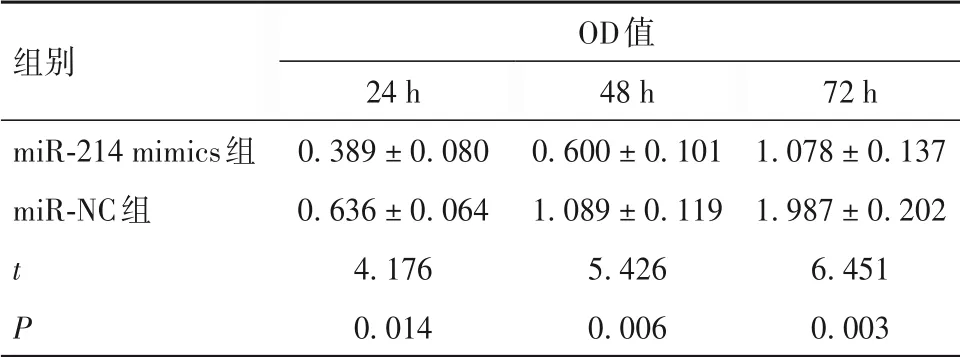
表1 两组TU177细胞不同时点OD值比较(± s)
组别miR-214 mimics组miR-NC组t P OD值24 h 0. 389 ± 0. 080 0. 636 ± 0. 064 4. 176 0. 014 48 h 0. 600 ± 0. 101 1. 089 ± 0. 119 5. 426 0. 006 72 h 1. 078 ± 0. 137 1. 987 ± 0. 202 6. 451 0. 003
2.4 两组TU177 细胞克隆形成情况比较 miR-214 mimics 组、miR-NC 组细胞克隆数分别为(360 ±75)、(890 ± 96)个,与miR-NC组相比,miR-214 mimics组细胞克隆数减少(P<0. 05)。
2.5 两组TU177 细胞凋亡率比较 miR-214 mim⁃ics 组、miR-NC组细胞凋亡率分别为(26. 46 ±5. 73)%、(4. 22 ± 1. 99)%,与miR-NC 组相比,miR-214 mimics组细胞凋亡率升高(P<0. 05)。
2.6 两组TU177 细胞中Bcl-2、Bax 和Livin 蛋白表达比较 与miR-NC 组相比,miR-214 mimics 组细胞中Livin 和Bcl-2 蛋白表达降低(P均<0. 01),Bax 蛋白表达升高(P<0. 01),见表2。
表2 两组TU177细胞中Bcl-2、Bax和Livin蛋白表达比较(± s)
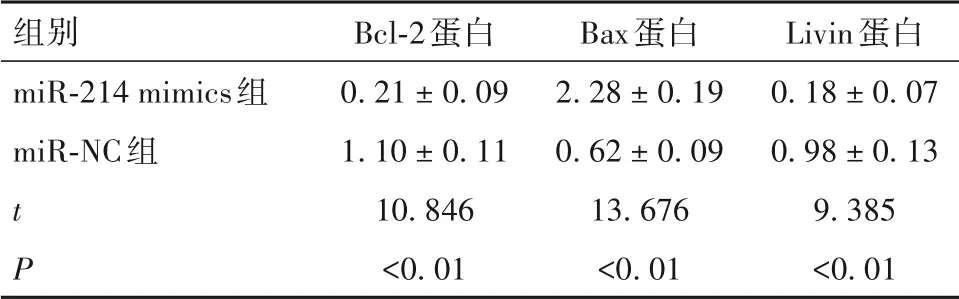
表2 两组TU177细胞中Bcl-2、Bax和Livin蛋白表达比较(± s)
组别miR-214 mimics组miR-NC组t P Bcl-2蛋白0. 21 ± 0. 09 1. 10 ± 0. 11 10. 846<0. 01 Bax蛋白2. 28 ± 0. 19 0. 62 ± 0. 09 13. 676<0. 01 Livin蛋白0. 18 ± 0. 07 0. 98 ± 0. 13 9. 385<0. 01
2.6 各组TU177 细胞相对荧光素酶活性比较 miR-214 mimics+WT-Livin 组、miR-214 mimics+MUT-Livin 组、miR-NC+WT-Livin 组、miR-NC+MUTLivin组细胞相对荧光素酶活性分别为0. 51 ± 0. 10、1. 00 ± 0. 06、1. 03 ± 0. 04、1. 02 ± 0. 06;与miR-NC+WT-Livin 组相比,miR-214 mimics+WT-Livin 组细胞相对荧光素酶活性降低(P<0. 05);miR-214 mimics+MUT-Livin组与miR-NC+MUT-Livin组细胞相对荧光素酶活性比较差异无统计学意义。
3 讨论
喉癌是呼吸系统第二常见恶性肿瘤,病理类型以LSCC为主。虽然早期LSCC患者的治疗效果尚可,但有60%以上的LSCC患者在明确诊断时已经处于疾病晚期,治疗效果不能令人满意[7]。研究表明,LSCC的恶性进展与一系列基因的改变有关,这些改变的基因可能起着类似癌基因或肿瘤抑制基因的作用。尽管近年来LSCC分子生物学方面有了显著的进步,但其恶性转化和进展过程的基本机制仍然不明确。
众所周知,miRNA 是重要的转录后调节因子,参与了不同细胞中基因表达谱的形成。研究发现,许多miRNA 异常表达在促进或抑制包括喉癌在内的恶性肿瘤的发生、发展中起关键作用[8]。miR-214定位于人类染色体1q24. 3 区DNM3 的14 号内含子上,其基因表达异常已经在许多恶性肿瘤的研究中被报道。LIU 等[9]报道,miR-214 在甲状腺乳头状癌组织和细胞中表达降低,在体外恢复甲状腺乳头状癌细胞miR⁃214 的表达可以显著降低癌细胞的增殖和侵袭能力,促进细胞凋亡。在胃癌[10]、宫颈癌[11]、卵巢癌[12]等研究中也发现miR-214起抑癌基因的作用。但值得注意的是,在乳腺癌[13]、口腔鳞癌[14]、肺癌[15]等恶性肿瘤的研究中却发现癌组织和细胞中miR-214表达升高,起着促进癌细胞增殖、转移和抑制癌细胞凋亡的作用。说明miR-214 在不同的恶性肿瘤中具有很强的异质性,可能通过影响不同的信号通路从而起着不同的作用。目前miR-214在LSCC中的作用机制尚不清楚。本研究发现,miR-214 在LSCC 细胞Hep-2、FD-LSC-1、TU177 中的表达降低,提示其在LSCC 的发生和进展过程可能起着类似抑癌基因的作用。 进一步研究发现,体外上调TU177 细胞中miR-214 的表达后,细胞的增殖活性降低,克隆细胞数减少,凋亡率升高,Bcl-2 表达降低,Bax 表达升高,证实miR-214在LSCC中起着抑癌基因的作用。
研究表明,miRNA 在机体细胞生命活动中的调节作用与其对下游靶基因的调控有关。近期,在肾细胞癌[16]和结肠癌[17]的研究中发现,miR-214能够通过调控Livin 基因参与肿瘤的发生进展。Livin 基因是目前研究较多的凋亡抑制蛋白家族成员,属于内源性抗凋亡因子,其在人体正常的组织中表达较低,但在包括LSCC 在内的众多恶性肿瘤组织细胞中均异常高表达,能够调控NF-κB、MAPKs、JNK等众多信号转导通路,对癌细胞的生长转移及化疗抗药均具有明显的促进作用[18]。既往研究已经证实,抑制LSCC 细胞中Livin 表达,可有效抑制LSCC 肿瘤细胞增殖、诱导其凋亡并增加细胞对化疗的敏感性[19-20]。本研究显示,体外上调TU177细胞中miR-214表达后,细胞中Livin蛋白表达降低,并且双荧光素酶报告基因实验显示miR-214 能特异性靶向结合Livin 的3' UTR区,提示Livin是miR-214在LSCC中的靶向作用基因。
综上可见,miR-214 在LSCC 细胞中低表达;在体外,miR-214能够抑制Livin表达从而抑制LSCC细胞的增殖并促进其凋亡,这为LSCC 的靶向治疗提供了新的方向。

