长链非编码RNA生长抑制特异因子5调控微小RNA-137对Aβ诱导大鼠海马神经元损伤的影响
赵美英史文倩汪桂青
(郑州大学附属郑州中心医院老年科,郑州 450007)
阿尔兹海默症(alzheimer’s disease,AD)日益成为全球性疾病,影响患者个人健康,淀粉样蛋白假说是目前主流的AD发病理论,淀粉样β蛋白(amyloid-βprotein,Aβ)聚集影响神经元功能,是导致认知功能障碍和痴呆的诱因,且临床上尚无根治药物[1]。靶向分子治疗成为近年来研究热点,长链非编码RNA(long non-coding RNA,LncRNA)参与神经元发育、增殖、凋亡、神经可塑性、认知、运动等多种功能[2];生长抑制特异因子5(growth arrestspecific 5,GAS5)作为一种LncRNA,最早在增殖抑制的细胞中被发现,且可促进多种细胞凋亡,在胶质瘤细胞中表达升高可促进胶质瘤细胞的凋亡,但其在AD中发挥何种作用,尚未发现研究[3]。研究报道,GAS5可以靶向微小RNA(microRNA,miRNA)影响疾病[4-5]。miR-137可抑制细胞外Aβ沉积,从而调控下游靶基因,抑制神经元死亡、缓解凋亡过程,从而缓解AD[6]。且研究发现,GAS5可靶向miR-137影响缺血再灌注损伤,但在神经元损伤中尚未发现相关研究[7]。因此,本研究采用Aβ诱导大鼠构建AD模型,探讨GAS5调控miR-137对大鼠神经元损伤的影响。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
60只6周龄SPF级雄性健康SD大鼠购自中科院上海斯莱克实验动物有限公司[SCXK(沪)2017-0005],体重(160±10)g。大鼠在温度(24±1)℃、湿度(50±5)%、12 h昼夜节律。黑暗条件下自由摄食饮水,正常饲养,饲养于郑州大学(药物研究院)[SYXK(豫)2018-0004],1周后开始实验。本研究经本院伦理协会审核并通过(IACUC-20190106),实验动物符合3R原则。
1.1.2 细胞
大鼠海马神经元购自中国医学科学院基础医学研究所基础医学细胞中心。
1.2 主要试剂与仪器
Aβ购自美国Sigma公司;si-NC、si-GAS5、anti-miR-NC、anti-miR-137、GAS5 MUT、GAS5 WT、miR-137 mimic、miR-137 mimic NC均购自广州锐博生物科技有限公司;双荧光素酶报告基因检测试剂盒购自北京索莱宝科技有限公司;一抗B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl2)、Bcl2相关X蛋白(Bcl2 associated X protein,BAX)、半胱氨酸天冬氨酸蛋白酶3(cystein-asparate protease 3,caspase3)均购自英国abcam公司,货号ab194583、ab32503、ab184787。7500实时荧光定量逆转录多聚酶链反应(Real-time quantitative PCR,RT-qPCR)仪购自美国ABI公司;Tanon 4100全自动凝胶成像分析系统购自上海天能科技有限公司。
1.3 实验方法
1.3.1 实验分组及处理
实验分为对照(control)组、Aβ组、Aβ+si-NC组、Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组、Aβ+si-GAS5+anti-miR-137组,每组10只。对照组和Aβ组海马CAI区(具体位置:Bregma后3 mm、中线旁开2.2 mm、深度2.5 mm)注射10μL PBS液,Aβ+si-NC组注射10μL si-NC,Aβ+si-GAS5组注射10μL si-GAS5,Aβ+si-GAS5+anti-miR-NC组注射si-GAS5、anti-miR-NC各10μL,Aβ+si-GAS5+antimiR-137组注射si-GAS5、anti-miR-137各10μL,15 min后除对照组外将10 nmol/μL Aβ31-35注入海马CAI区[8],对照组注射等量生理盐水。14 d后进行研究。
1.3.2 Y迷宫实验检测大鼠行为
14 d实验结束后,Y型迷宫刺激器检测大鼠学习能力。根据Martyn等[9]方法,对大鼠重复测试,大鼠连续10次测试中出现9次及以上做出正确反应即作为学会标准。实验结束后记录大鼠正确反应次数;计算正确反应次数比例(%)=(正确反应次数)/总实验次数×100%,重复Y迷宫实验,20次实验中达到正确反应次数作为记忆成绩,学会次数比例(%)=(达到正确反应次数的次数)/总实验次数×100%。
1.3.3 样本收集
结束后立即收集海马CAI区组织,部分置于4%多聚甲醛中固定,部分置于-80℃冰箱保存待检。
1.3.4 RT-qPCR法检测海马CAI区GAS5、miR-137水平
部分海马CAI区组织RNA提取试剂盒提取总RNA,cDNA第一链合成试剂盒将其逆转录成第一链cDNA。设计上下游引物,引物序列见表1。20μL反应体系:2×SYBR qPCR Mix 10μL,cDNA(50 ng/μL)1μL,F/R(10μmol/L)0.5μL/0.5μL,ddH2O 8μL;反应条件:94℃、60 s;95℃、30 s(GAS5:61℃、40 s,miR-137:59℃、35 s),40个循环。2-ΔΔCt法计算GAS5、miR-137相对表达水平。

表1 引物序列Table 1 Primer sequence
1.3.5 尼氏染色观察神经元形态
4%多聚甲醛中固定的海马CAI区组织经石蜡包埋后切片,切片厚度6μm,石蜡切片经二甲苯脱蜡、梯度乙醇浸润,切片进入A液(Cresyl violet Stain)56℃染色60 min,PBS漂洗,置于B液(Nissl Differentiation)分色数秒至2 min直至背景色接近无色,显微镜下观察神经元形态、尼氏小体情况。
1.3.6 Tunel染色观察大鼠神经元凋亡的影响
切片脱蜡处理,加2%蛋白酶K室温孵育20 min,PBS清洗后滴加50μL Tunel反应混合溶液,湿盒孵育60 min,抗荧光猝灭液(含DAPI)封片后荧光显微镜下观察,其中绿色荧光显示凋亡阳性细胞。
1.3.7 Western blot实验检测海马CAI区Bcl2、BAX、caspase3蛋白水平
-80℃取部分海马CAI区组织,蛋白裂解液冰上裂解,4℃10000 r/min离心20 min,上清为总蛋白。凝胶电泳分离蛋白、NC转膜;5%脱脂奶粉室温封闭;对应加入一抗Bcl2、BAX、caspase3、GAPDH,4℃孵育过夜;加入对应二抗,室温孵育1 h;DAB显色试剂盒避光显色,全自动凝胶成像分析系统拍照和定量分析。
1.3.8 双荧光素酶鉴定miR-137与GAS5的靶向位点
Starbase分析发现miR-137与GAS5存在互补的结合位点;将miR-137与GAS5结合位点及突变位点的序列克隆重组至pGL3-basic荧光素酶报告载体上构建GAS5野生型(GAS5 WT)及突变型(GAS5 MUT)荧光素酶报告载体,分别与miR-137 mimic或miR-137 mimic NC共转染海马神经元中,双荧光素酶报告基因检测试剂盒检测各组荧光素酶相对活性。
1.4 统计学方法
采用统计学软件GraphPad Prism 8进行数据分析,计量数据以平均数±标准差(±s)描述,多组间比较行单因素方差分析,进一步采用SNK-q法进行两两比较。P<0.05时,差异有统计学意义。
2 结果
2.1 Y迷宫检测大鼠行为
与对照组相比,Aβ组、Aβ+si-NC组、Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组、Aβ+si-GAS5+anti-miR-137组大鼠正确反应次数比例、学会次数比例降低(P<0.05);分别与Aβ组、Aβ+si-NC组相比,Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组大鼠正确反应次数比例、学会次数比例升高(P<0.05);分别与Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组相比,Aβ+si-GAS5+anti-miR-137组大鼠正确反应次数比例、学会次数比例降低(P<0.05)。见图1。
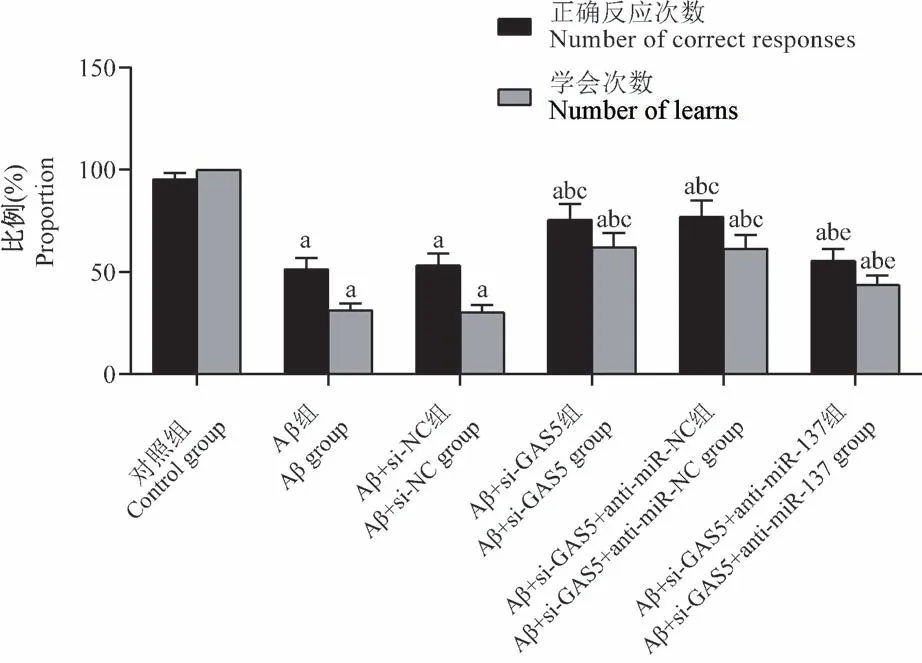
图1 Y迷宫检测大鼠行为Figure 1 Y maze to detect rat behavior
2.2 RT-qPCR检测海马CAI区GAS5、miR-137水平
与对照组相比,Aβ组、Aβ+si-NC组海马CAI区GAS5 mRNA水平升高(P<0.05)、miR-137水平降低(P<0.05);分别与Aβ组、Aβ+si-NC组相比,Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组海马CAI区GAS5 mRNA水平降低(P<0.05)、miR-137水平升高(P<0.05);分别与Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组相比,Aβ+si-GAS5+anti-miR-137组海马CAI区GAS5 mRNA水平升高(P<0.05)、miR-137水平降低(P<0.05)。见图2A、B。

图2 RT-qPCR检测海马CAI区GAS5、miR-137表达水平Figure 2 Expression of GAS5 and miR-137 in hippocampal CA1 area by RT-qPCR
2.3 尼氏染色观察海马CAI区神经元形态
与对照组相比,Aβ组、Aβ+si-NC组海马CAI区神经元死亡率升高(P<0.05);分别与Aβ组、Aβ+si-NC组相比,Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组海马CAI区神经元死亡率降低(P<0.05);分别与Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组相比,Aβ+si-GAS5+anti-miR-137组海马CAI区神经元死亡率升高(P<0.05)。见图3A、B。
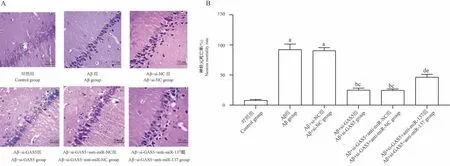
图3 海马CAI区神经元情况Figure 3 Neurons in the hippocampal CAI area
2.4 Tunel染色观察海马CAI区神经元凋亡情况
与对照组相比,Aβ组、Aβ+si-NC组海马CAI区神经元凋亡率升高(P<0.05);分别与Aβ组、Aβ+si-NC组 相 比,Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组海马CAI区神经元凋亡率降低(P<0.05);分别与Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组相比,Aβ+si-GAS5+anti-miR-137组海马CAI区神经元凋亡率升高(P<0.05)。见图4A、B。
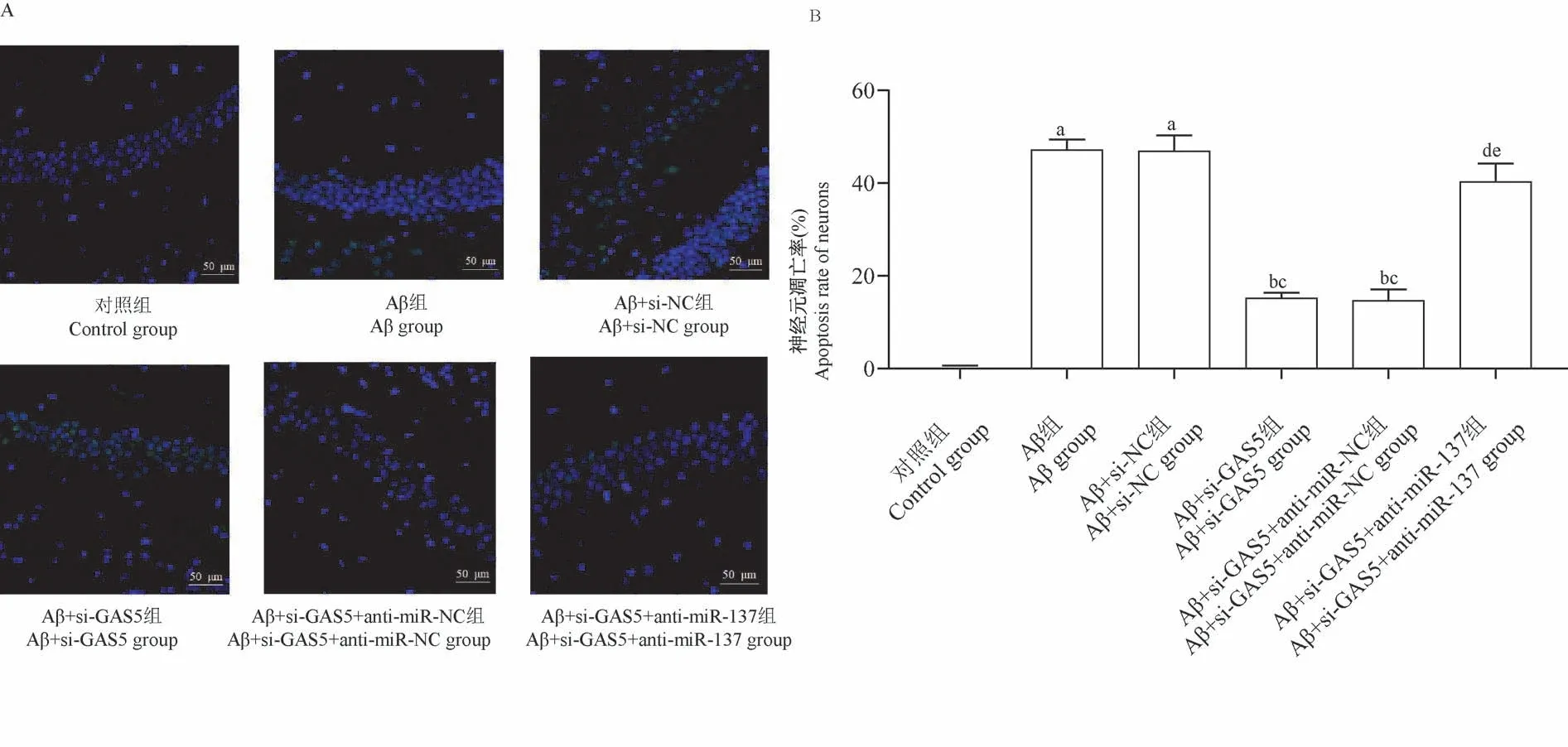
图4 海马CAI区神经元凋亡情况Figure 4 Apoptosis of hippocampal CAI Neurons
2.5 Western blot实验检测海马CAI区Bcl2、BAX、caspase3蛋白表达情况
与对照组相比,Aβ组、Aβ+si-NC组海马CAI区Bcl2蛋白水平降低(P<0.05),BAX、caspase3蛋白水平升高(P<0.05);分别与Aβ组、Aβ+si-NC组相比,Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组海马CAI区Bcl2蛋白水平升高(P<0.05),BAX、caspase3蛋白水平降低(P<0.05);分别与Aβ+si-GAS5组、Aβ+si-GAS5+anti-miR-NC组相比,Aβ+si-GAS5+anti-miR-137组海马CAI区Bcl2蛋白水平降低(P<0.05)、BAX、caspase3蛋白水平升高(P<0.05)。见图5A、B。
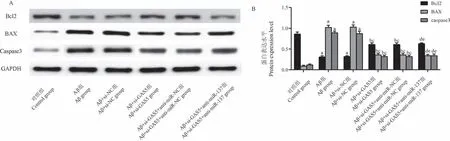
图5 Western blot检测海马CAI区Bcl2、BAX、caspase3蛋白表达水平Figure 5 Expression of Bcl2,BAX,caspase3 protein in hippocampal CA1 area by Western blot
2.6 miR-137与GAS5的靶向关系
miR-137与GAS5之间存在靶位点。见图6A。与miR-137 NC+GAS5 WT相比,miR-137 mimic+GAS5 WT荧光素酶相对活性下降(P<0.05);与miR-137 NC+GAS5 MUT相比miR-137 mimic+GAS5 MUT荧光素酶相对活性差异无统计学意义(P>0.05)。见图6B。

图6 miR-137与GAS5的靶向关系Figure 6 Targeting relationship between miR-137 and GAS5
3 讨论
AD中Aβ沉积是作用机制之一,Aβ沉积造成神经元损伤,可加速神经细胞凋亡,导致神经元损伤严重,对动物行为和认知功能产生影响[10]。神经元病变与细胞凋亡关系异常密切,在AD发生发展过程中,Aβ的诱导可导致神经凋亡,因此,抗神经元凋亡已经成为AD研究的重要方向[11-12]。在公认的内源性凋亡通路中,Aβ可诱导抗凋亡蛋白Bcl2蛋白水平降低,促凋亡蛋白BAX、caspase3蛋白水平升高,从而激活内源性凋亡途径[13]。而在本研究中大鼠正确反应次数比例、学会次数比例降低,相比正常大鼠,Aβ大鼠学习和记忆功能出现明显抑制,存在认知障碍。尼氏染色检测海马CAI区神经元形态时发现,Aβ导致神经元死亡严重;Tunel染色发现,Aβ导致神经元凋亡严重,蛋白检测发现海马CAI区Bcl2蛋白水平降低,BAX、caspase3蛋白水平升高,提示在大鼠脑组织中注射Aβ导致Aβ沉积,从而促进神经元凋亡、死亡,影响认知功能。
LncRNA广泛存在于神经系统中,在神经元损伤中可观察到LncRNA显著变化,并参与转录、翻译过程从而调控基因组印迹、染色体修饰、mRNA的翻译等过程,从而影响神经损伤及修复过程[14]。GAS5在缺血性脑卒中中呈高表达,具有神经毒性作用,下调GAS5可以减轻神经元损伤,从而实现对脑缺血性卒中的保护作用[15];敲除GAS5可以抑制创伤性脑损伤导致的Bax升高从而发挥对神经元的保护,因此有望成为治疗神经元损伤的治疗靶点[16]。在本研究中,发现添加Aβ后导致海马CAI区GAS5 mRNA水平均升高,提示海马CAI区GAS5转录和翻译受Aβ沉积的影响均处于激活状态,而高表达的GAS5具有神经毒性作用,加重神经元损伤。与Aβ组相比,Aβ+si-GAS5组正确反应次数比例、学会次数比例升高,神经元死亡、神经元凋亡率均降低,海马CAI区Bcl2蛋白水平升高,Bax、caspase3蛋白水平降低,提示干扰GAS5后可通过抑制神经元凋亡减少神经死亡,实现对神经元损伤的保护,学习和记忆功能有所缓解。
miRNA作为非编码小RNA,LncRNA上存在miRNA结合位点,miRNA又可沉默靶基因,从而影响生物学功能[17-18]。脑神经元中富含miR-137,特别是在皮层区和海马区,Aβ经过淀粉样前体蛋白分解成蛋白质,而miR-137可调控该类蛋白质从而降低Aβ水平,且miR-137与Aβ在脑神经元中呈负相关关系[19]。在Aβ积累和神经炎症导致的AD中miR-137水平降低,可能是诱导蛋白1的水平从而诱导细胞毒性、凋亡,促进caspase3活化[20]。本研究发现,添加Aβ可降低miR-137水平,而miR-137水平降低对Aβ的降解作用减弱,导致Aβ在神经元处积累,诱发神经元损伤。而GAS5与miR-137关系密切,且GAS5下调可明显增加miR-137表达[21],干扰GAS5后miR-137水平升高,而升高后的miR-137实现对神经元的保护作用加强,减缓神经元凋亡降低。添加anti-miR-137后可逆转干扰GAS5对神经元的保护作用。
综上所述,干扰GAS5后可上调miR-137表达来降低Aβ诱导的神经元损伤,实现对神经元的保护作用,下调miR-137可逆转上述过程。本研究首次验证了GAS5在Aβ诱导的神经元损伤中起促进作用,且进一步发现高表达GAS5可下调miR-137促进神经元凋亡进而引发神经元损伤,但miR-137靶基因较多,通过哪些具体信号通路发挥作用尚需进一步验证。

