VEGF抑制剂对糖尿病性视网膜病变模型大鼠的干预效果及对CRA血流动力学的影响
侯立亭郭 洋胡红霞
(开封市中心医院眼科,河南 开封 475000)
糖尿病视网膜病变(diabetic retinopathy,DR)是一种糖尿病微血管并发症,是一种特异性眼底病变,其主要的病理改变为视网膜微血管变化[1]。DR患者的发病率主要与糖尿病病程相关,患者常出现的临床症状主要有硬性渗出、IRMA、出血斑点、微动脉瘤等,缺血广泛可降低患者视力,致视网膜脱离,严重情况下可致盲[2]。DR的发生机制尚未完全明确,较为复杂,目前相关研究主要表明其与高血糖引起的代谢紊乱有关,包括蛋白质非酶糖基化终末产物的形成和己糖胺途径的激活。蛋白激酶C激活,造成血管功能紊乱及氧化应激炎症反应,导致血管闭塞、局部缺血及血管渗透性增强[3-4]。VEGF抑制剂可阻止脉络膜新生血管形成,解除视网膜水肿,防治血管成分渗漏,改善视力,贝伐单抗属于一种典型的VEGF抑制剂,在治疗多种晚期肿瘤中效果明显,目前已经有研究显示通过玻璃体注射贝伐单抗,能治疗眼部新生血管性疾病,但是患者会出现并发症,其作用机制也尚不明确[5]。本文将研究VEGF抑制剂对糖尿病性视网膜病变模型大鼠的干预效果及对CRA血流动力学的影响。
1 材料和方法
1.1 实验动物
选取40只SPF级、健康雄性大鼠,4~6周龄,平均年龄(4.8±0.9)周,体重为170~190 g,平均体重(171.0±9.5)g,由广东斯嘉景达生物科技有限公司提供[SCXK(粤)2020-0052],经开封市中心医院伦理委员会审批批准(IACUC-201805-K1)。实验开始前,所有大鼠在我院动物研究实验中心[SYXK(粤)2021-0251]适应性饲养1周,自由饮水,12 h昼夜节律,温度为20~25℃,湿度为40%~50%。
1.2 主要试剂与仪器
贝伐单抗(上海麦克林生化科技有限公司,货号:B873505-1);无菌柠檬酸(中国药品生物制品检定所,批号:2003-10);LBY-HJ四通道血小板聚集仪(上海寰熙医疗器械有限公司,货号:79028);Laser Doppler Flowmetry激光血流仪(瑞典perimed,型号:P457);血糖仪(美国强生);双抗体夹人酶联免疫法试剂盒(上海西唐生物公司,货号:F26260)。
1.3 实验方法
1.3.1 糖尿病性视网膜病变大鼠模型建立
对照组大鼠10只给予标准饲料喂养,模型组、无菌柠檬酸组、VEGF抑制剂组各10只大鼠给予高脂饲料喂养。在8周后,对照组给予生理盐水,模型组、无菌柠檬酸组、VEGF抑制剂组大鼠给予腹腔注射40 mg/kg链脲佐菌素。3 d后尿糖3+,采集大鼠尾静脉血测血糖,血糖≥16.7 mmol/L,糖尿病大鼠造模成功。各组大鼠饮食情况如前,继续喂养4周后,行眼底血管荧光造影检查,确立大鼠出现糖尿病视网膜病变,建模成功。
1.3.2 干预
无菌柠檬酸组给予0.05 mL的无菌柠檬酸腹腔干预;VEGF抑制剂组大鼠给予玻璃体腔内注入0.05 mL贝伐单抗干预;对照组、模型组给予等体积的生理盐水干预,四组均连续给药每天1次,各组均连续干预2周。
1.3.3 CRA血流参数检测
应用飞利浦IU22型彩色多普勒检查,探头频率:10 MHz。腹腔注射麻醉,在获取连续5个以上稳定心动周期时,检测干预2周后大鼠右眼CRA各项血流参数。根据多普勒超声血流指标测定峰值血流速度:EDV、PSV、RI及PI。重复上述操作3次,取各项指标的平均值。
1.3.4 血液流变学指标检测
采用激光血流仪检测大鼠干预2周后全血粘度。大鼠心腔采血2.5 mL,血小板聚集率检测用四通道血小板聚集仪。大鼠心腔采血1.5 mL,血小板黏附率检测用体外血栓形成、血小板黏附两用仪。
1.3.5 脂联素、空腹血糖(FBG)、细胞间黏附分子-1(ICAM-1)、白介素-1β(IL-1β)水平检测
血糖测试前对动物禁食12 h,使用血糖仪检测FBG水平。抽取大鼠尾部静脉血2 mL,采用PBS缓冲液进行洗涤处理,转速为2000 r/min离心干预10 min,摒弃上清液,采用双抗体夹心酶联免疫法试剂盒检测各组大鼠血浆中脂联素、ICAM-1、IL-1β水平。
1.3.6 病理学观察
采用LDF激光血流仪及眼球固定象限测定法检测干预2周后各组大鼠双眼血流。检查完成后将大鼠处死,摘取每只大鼠左侧眼球,10%甲醛固定24 h,经脱钙、脱水、透明以及包埋等处理制成石蜡块,保存待用。将组织进行切片,HE染色,光镜下观察病理学变化。
1.3.7 Western blot检测Ras、Raf-1及ERK表达量检测
将所采集到的大鼠左侧眼球组织标本,进行研磨,然后加入蛋白缓冲液,常规蛋白提取,BCA法定量分析。50μg蛋白样品上样后SDS-PAGE电泳,电转到PVDF膜,在TBST中将5%的脱脂奶粉避光封闭1 h,洗涤后加入一抗稀释溶液(Ras、Raf-1及ERK按照1∶1000比例进行稀释),在4℃的环境中保存过夜,洗涤后加入二抗稀释溶液(Ras、Raf-1及ERK按照1∶5000比例进行稀释),在温床中孵育1 h后再次洗涤,加入发光液ECL,使软件分析蛋白条带灰度值,内参蛋白是GAPDH。
1.4 统计学方法
采用SPSS 19.0统计软件包进行统计分析处理。计量资料采用平均数±标准差(±s)描述,多组间比较采用齐性方差检验,两组间比较采用独立样本t检验,P<0.05具有统计学意义。
2 结果
2.1 各组大鼠CRA血流参数比较
如表1所示,与正常大鼠相比,模型组、无菌柠檬酸组、VEGF抑制剂组EDV、PSV水平降低,RI及PI水平升高,具有显著性差异(P<0.05);与模型组相比,无菌柠檬酸组、VEGF抑制剂组EDV、PSV水平升高,RI及PI水平降低,具有显著性差异(P<0.05);与无菌柠檬酸组相比,VEGF抑制剂组EDV、PSV水平升高,RI及PI水平降低,具有显著性差异(P<0.05)。
表1 各组大鼠CRA血流参数比较(±s,n=10)Table 1 Comparison of CRA blood flow parameters of rats in each group

表1 各组大鼠CRA血流参数比较(±s,n=10)Table 1 Comparison of CRA blood flow parameters of rats in each group
注:与对照组相比,a P<0.05;与模型组相比,b P<0.05;与无菌柠檬酸组相比,c P<0.05。Note.Compared with the control group,a P<0.05.Compared with the model group,b P<0.05.Compared with the sterile citric acid group,c P<0.05.
组别Groups 舒张期最低流速(mm/s)EDV 收缩期峰值血流速度(mm/s)PSV 阻力指数RI 搏动指数PI对照组Control group 108.12±20.25 178.83±25.14 0.41±0.11 0.50±0.13模型组Model group 31.53±8.42a 58.92±11.37a 1.12±0.32a 1.35±0.35a无菌柠檬酸组Sterile citric acid group 47.46±10.29ab 84.16±14.52ab 0.85±0.20ab 0.91±0.22ab VEGF抑制剂组VEGF inhibitor group 90.26±16.55abc 155.57±18.67abc 0.68±0.10abc 0.69±0.12abc F 16.566 20.614 9.953 10.799 P 0.001 0.001 0.001 0.001
2.2 病理学观察
如图1所示,对照组大鼠细胞内外节形态规整,视网膜各层细胞排列整齐。模型组大鼠视网膜内血管扩张,视网膜各层细胞结构排列紊乱,细胞间水肿。无菌柠檬酸组大鼠周细胞轻度水肿,各层细胞结构排列紊乱。VEGF抑制剂组视网膜各层细胞排列较完整。
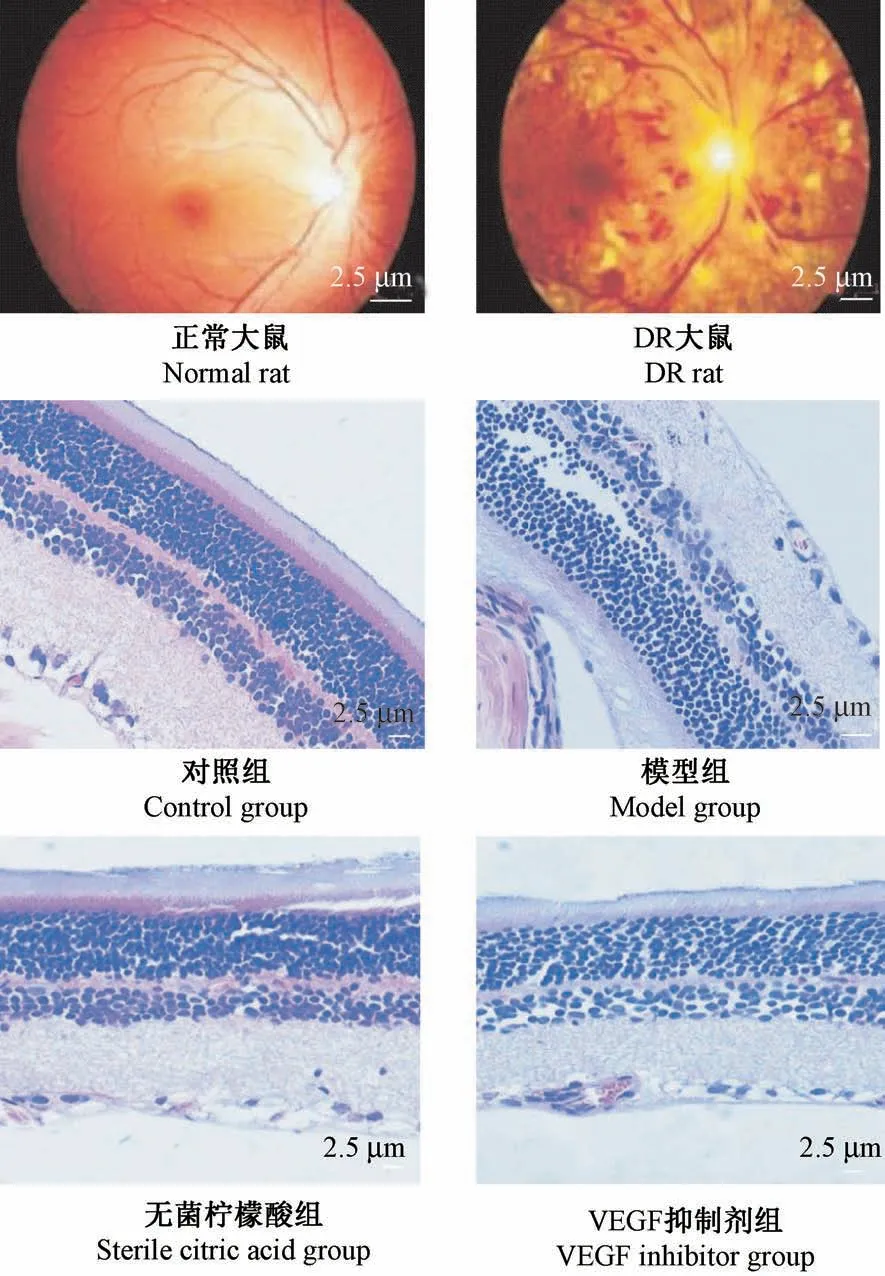
图1 大鼠视网膜组织病理学观察(HE染色)Figure 1 Histopathological observation of retina in rats(HE staining)
2.3 各组大鼠血液流变学指标比较
如表2所示,与正常大鼠相比,模型组、无菌柠檬酸组、VEGF抑制剂组全血粘度、血小板聚集率及血小板黏附率水平升高,具有显著性差异(P<0.05);与模型组相比,无菌柠檬酸组、VEGF抑制剂组全血粘度、血小板聚集率及血小板黏附率水平降低,具有显著性差异(P<0.05);与无菌柠檬酸组相比,VEGF抑制剂组全血粘度、血小板聚集率及血小板黏附率水平降低,具有显著性差异(P<0.05)。
表2 各组大鼠血液流变学指标比较(±s,n=10)Table 2 Comparison of hemorheological indexes of rats in each group
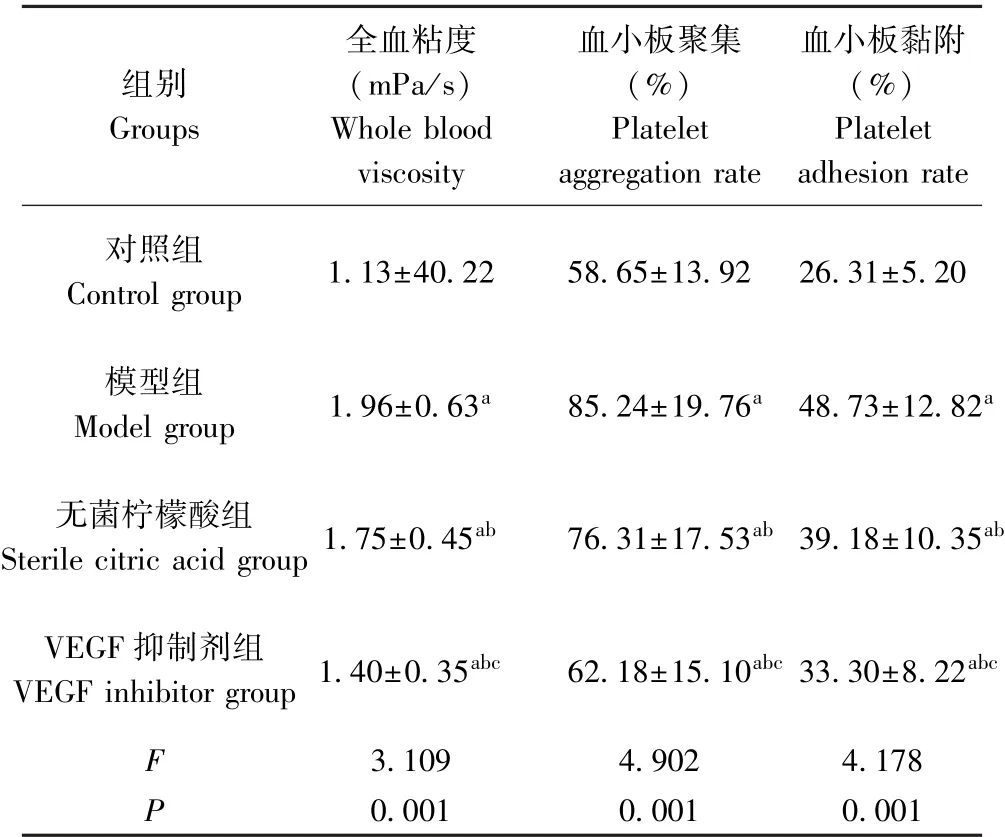
表2 各组大鼠血液流变学指标比较(±s,n=10)Table 2 Comparison of hemorheological indexes of rats in each group
注:与对照组相比,a P<0.05;与模型组相比,b P<0.05;与无菌柠檬酸组相比,c P<0.05。Note.Compared with the control group,a P<0.05.Compared with the model group,b P<0.05.Compared with the sterile citric acid group,c P<0.05.
组别Groups全血粘度(mPa/s)Whole blood viscosity血小板聚集(%)Platelet aggregation rate血小板黏附(%)Platelet adhesion rate对照组Control group 1.13±40.22 58.65±13.92 26.31±5.20模型组Model group 1.96±0.63a 85.24±19.76a 48.73±12.82a无菌柠檬酸组terile citric acid group 1.75±0.45ab 76.31±17.53ab 39.18±10.35a VEGF抑制剂组VEGF inhibitor group 1.40±0.35abc 62.18±15.10abc 33.30±8.22ab 3.109 4.902 4.178 P 0.001 0.001 0.001 F Sbc
2.4 各组大鼠脂联素、空腹血糖水平比较
如表3所示,与正常大鼠相比,模型组、无菌柠檬酸组、VEGF抑制剂组脂联素水平降低,FBG水平升高,具有显著性差异(P<0.05);与模型组相比,无菌柠檬酸组、VEGF抑制剂组脂联素水平升高,FBG水平降低,具有显著性差异(P<0.05);与无菌柠檬酸组相比,VEGF抑制剂组脂联素水平升高,FBG水平降低,具有显著性差异(P<0.05)。
表3 各组大鼠脂联素、FBG水平比较(±s,n=10)Table 3 Comparison of adiponectin and FBG levels of rats in each group
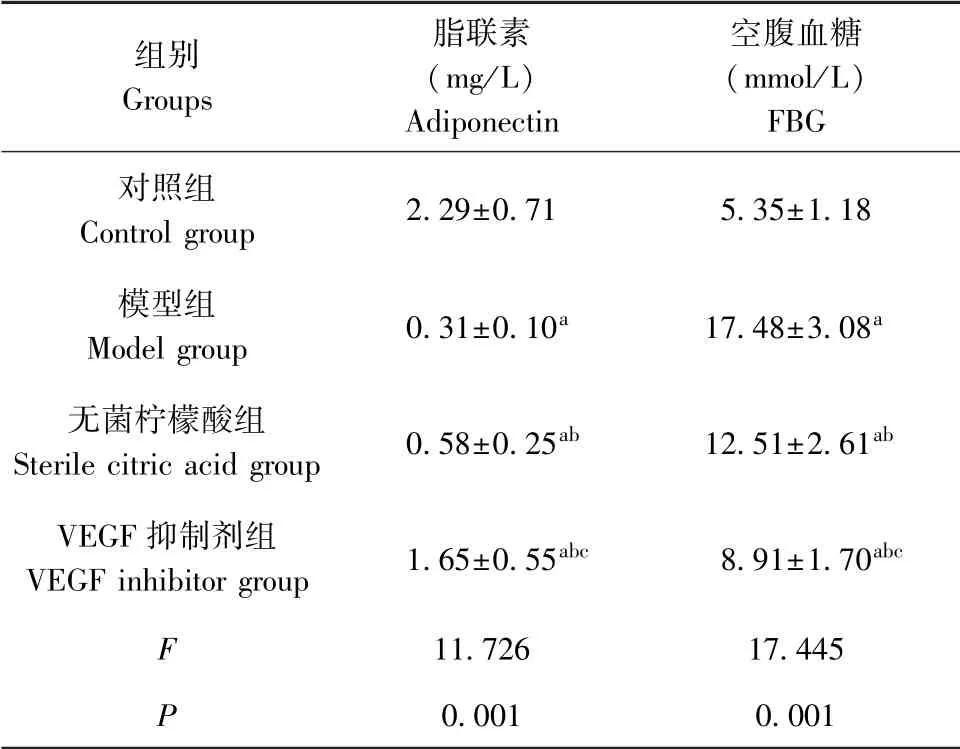
表3 各组大鼠脂联素、FBG水平比较(±s,n=10)Table 3 Comparison of adiponectin and FBG levels of rats in each group
注:与对照组相比,a P<0.05;与模型组相比,b P<0.05;与无菌柠檬酸组相比,c P<0.05。Note.Compared with the control group,a P<0.05.Compared with the model group,b P<0.05.Compared with the sterile citric acid group,c P<0.05.
组别Groups脂联素(mg/L)Adiponectin空腹血糖(mmol/L)FBG对照组Control group 2.29±0.71 5.35±1.18模型组Model group 0.31±0.10a 17.48±3.08a无菌柠檬酸组Sterile citric acid group 0.58±0.25ab 12.51±2.61ab VEGF抑制剂组VEGF inhibitor group 1.65±0.55abc 8.91±1.70abc 11.726 17.445 P 0.001 0.001 F
2.5 各组大鼠VEGF、ICAM-1及IL-1β水平比较
如表4所示,与正常大鼠相比,模型组、无菌柠檬酸组、VEGF抑制剂组VEGF、ICAM-1及IL-1β水平升高,具有显著性差异(P<0.05);与模型组相比,无菌柠檬酸组、VEGF抑制剂组VEGF、ICAM-1及IL-1β水平降低,具有显著性差异(P<0.05);与无菌柠檬酸组相比,VEGF抑制剂组VEGF、ICAM-1及IL-1β水平降低,具有显著性差异(P<0.05)。
表4 各组大鼠VEGF、ICAM-1及IL-1β水平比较(±s,n=10)Table 4 Comparison of VEGF,ICAM-1 and IL-1β levels of rats in each group
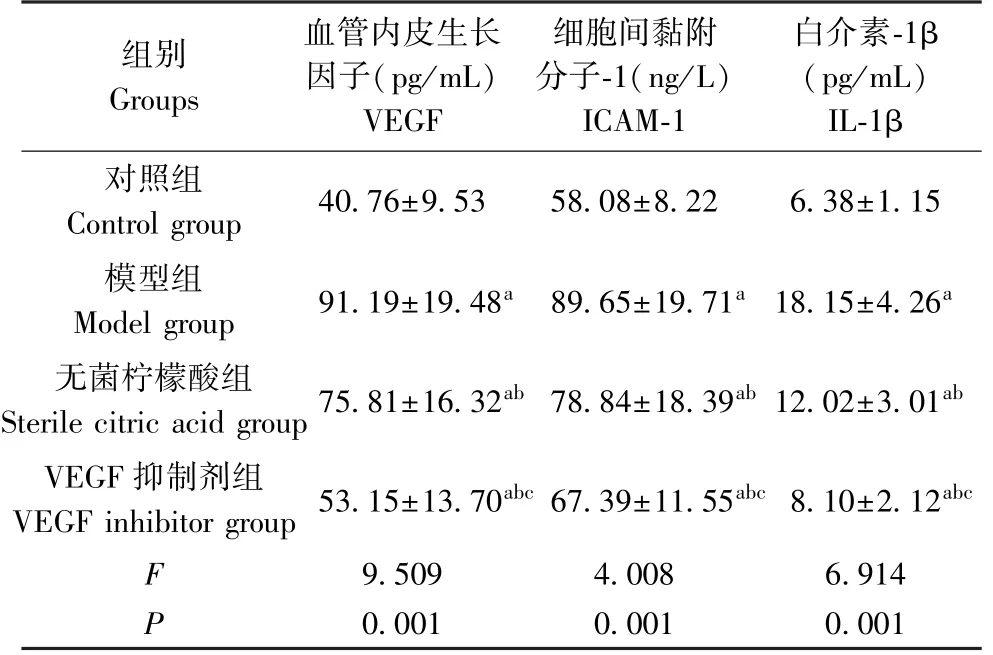
表4 各组大鼠VEGF、ICAM-1及IL-1β水平比较(±s,n=10)Table 4 Comparison of VEGF,ICAM-1 and IL-1β levels of rats in each group
注:与对照组相比,a P<0.05;与模型组相比,b P<0.05;与无菌柠檬酸组相比,c P<0.05。Note.Compared with the control group,a P<0.05.Compared with the model group,b P<0.05.Compared with the sterile citric acid group,c P<0.05.
组别Groups血管内皮生长因子(pg/mL)VEGF细胞间黏附分子-1(ng/L)ICAM-1白介素-1β(pg/mL)IL-1β对照组Control group 40.76±9.53 58.08±8.22 6.38±1.15模型组Model group 91.19±19.48a 89.65±19.71a 18.15±4.26a无菌柠檬酸组Sterile citric acid group 75.81±16.32ab 78.84±18.39ab 12.02±3.01ab VEGF抑制剂组VEGF inhibitor group 53.15±13.70abc 67.39±11.55abc 8.10±2.12abc 9.509 4.008 6.914 P 0.001 0.001 0.001 F
2.6 各组大鼠Ras、Raf-1及ERK表达量比较
如表5、图2所示,与正常大鼠相比,模型组、无菌柠檬酸组、VEGF抑制剂组Ras、Raf-1及ERK表达量升高,具有显著性差异(P<0.05);与模型组相比,无菌柠檬酸组、VEGF抑制剂组Ras、Raf-1及ERK表达量降低,具有显著性差异(P<0.05);与无菌柠檬酸组相比,VEGF抑制剂组Ras、Raf-1及ERK表达量降低,具有显著性差异(P<0.05)。
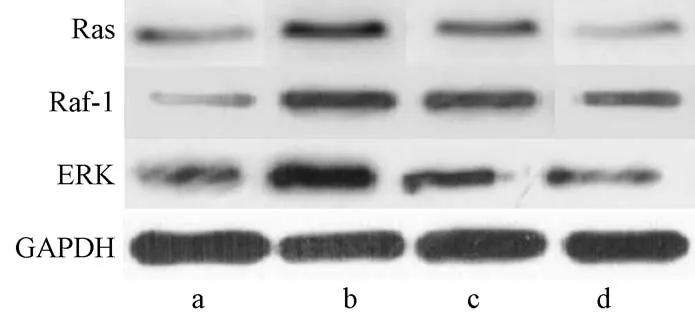
图2 Ras、Raf-1及ERK蛋白表达Western blot图Figure 2 Western blot of Ras,Raf-1 and ERK protein expression
表5 各组大鼠Ras、Raf-1及ERK表达量比较(±s,n=10)Table 5 Comparison of the expression levels of Ras,Raf-1 and ERK in each group of rats
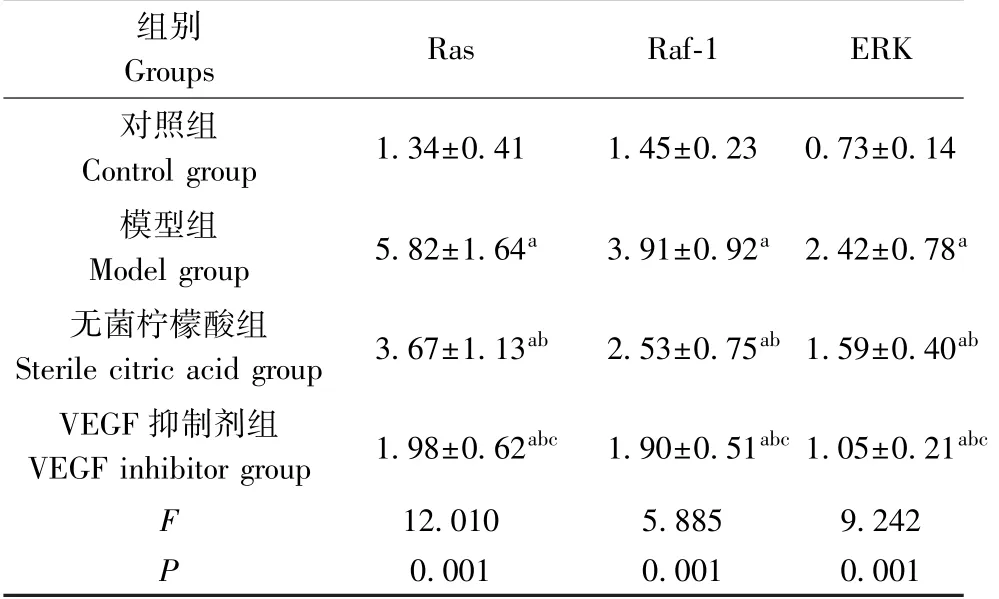
表5 各组大鼠Ras、Raf-1及ERK表达量比较(±s,n=10)Table 5 Comparison of the expression levels of Ras,Raf-1 and ERK in each group of rats
注:与对照组相比,a P<0.05;与模型组相比,b P<0.05;与无菌柠檬酸组相比,c P<0.05。Note.Compared with the control group,a P<0.05.Compared with the model group,b P<0.05.Compared with the sterile citric acid group,c P<0.05.
组别Groups Ras Raf-1 ERK对照组Control group 1.34±0.41 1.45±0.23 0.73±0.14模型组Model group 5.82±1.64a 3.91±0.92a 2.42±0.78无菌柠檬酸组Sterile citric acid group 3.67±1.13ab 2.53±0.75ab 1.59±0.40 VEGF抑制剂组VEGF inhibitor group 1.98±0.62abc 1.90±0.51abc 1.05±0.21 12.010 5.885 9.242 P 0.001 0.001 0.001 Faababc
3 讨论
在我国DR的发病率逐年上升,其主要是由多种因素共同作用导致的,是目前国内外导致低视力及致盲的重要疾病,不及时的有效治疗会随着病情发展导致失明,寻找有效的治疗方法尤为重要[6]。随着病程的不断进展,DR促使其局部缺血缺氧,促使毛细血管通透性增加,促使新生血管生成等,新生血管会导致结缔组织增生及玻璃体出血等,进一步增加视力丧失及视网膜脱离风险[7]。较多学者为临床治疗提高新的靶点,发现血管生成抑制因子与血管生成刺激因子之间的动态平衡在其发展与发生过程中具有重要作用[8]。VEGF其生物活性可以被抑制剂阻断,是最重要的眼内新生血管生长因子,达到抑制新生血管生成的目的[9-10]。
视网膜CRA是供应视网膜内参的主要血管,属于终末动脉,是眼动脉的分支,在维持视觉功能方面起重要的作用。视网膜动脉参数可用来反映视网膜的血液供应状况,与视网膜微循环的状态[11]。本文研究显示,VEGF抑制剂能提高大鼠EDV、PSV水平升高,降低RI及PI水平,从而改善视网膜CRA血流动力学状况。机体长时间处于高血糖状态易造成血-视网膜屏障受损,血小板聚集性增强,同时视网膜毛细血管闭塞,视网膜血管弹性下降,促进新生血管形成,引起视网膜毛细血管增生与微血管瘤[12-13]。本文结果指出,VEGF抑制剂能降低大鼠全血粘度、血小板聚集率及血小板黏附率水平。脂联素是脂肪细胞特异性分泌的一种蛋白质,在糖尿病合并症的发展中具有重要的作用,其水平增高可引起微循环障碍[14]。本文中,与无菌柠檬酸组相比,VEGF抑制剂组脂联素水平升高,FBG水平降低。
VEGF是血管内皮细胞特异的促有丝分裂素,过度表达会增加血管的渗透性,促进血管的异常增殖,其与组织中新生血管数量具有密切联系,能特异性的作用于视网膜血管内皮细胞[15]。炎性细胞黏附与血管内皮细胞是由ICAM-1介导的,损害局部血管,导致活化氧自由基、炎症递质等,引起血管通透性增加,加重视网膜的损伤[16-17]。IL-1β在DR中加重视网膜病变,诱导ICAM-1等黏附因子,起关键作用的一种致炎因子[18]。本文指出,VEGF抑制剂通过能降低糖尿病性视网膜病变模型大鼠VEGF、ICAM-1及IL-1β水平,在抑制糖尿病性视网膜病变模型大鼠炎症方面作用显著。Ras/Raf-1/ERK通路是调控细胞增殖、凋亡与分化的重要途径,是一个蛋白激酶级联反应,在VEGF介导的血管生成信号通路上起促进VEGF表达的作用[19]。VEGF抑制剂相对分子量小,能够穿透视网膜,与血管内皮生长因子特异性结合,加快缓解水肿,防治视网膜新生血管发生渗漏,阻止血管新生、再生,减轻炎症反应,改善视网膜功能[20]。本文研究结果显示,VEGF抑制剂对糖尿病性视网膜病变模型大鼠Ras、Raf-1及ERK蛋白表达有一定的调控作用,为其作用机制提供研究方向。本文研究的局限性主要体现在,本文研究实验仅做了一个时间点的视网膜病变的观察,在抑制糖尿病性视网膜病变发展这一结论研究方面,数据不充分,仍需要后续多试验点加以证实。
综上所述,VEGF抑制剂可改善糖尿病性视网膜病变模型大鼠CRA血流动力学与血液流变学指标,降低VEGF、ICAM-1及IL-1β水平,抑制血管新生。

