血小板微粒介导miR-4306调控糖尿病大鼠主动脉血管内皮细胞损伤的作用及机制研究
王瑞青郑彩虹朱 巍郭彩红
(1.北京航天总医院内分泌科,北京 100076;2.山西白求恩医院内分泌科,太原 030000)
糖尿病患者所引起的心血管疾病风险大约是正常人群的3倍,动脉粥样硬化是糖尿病性心血管疾病的主要病理疾病,其中主动脉血管内皮功能损伤在糖尿病所致的早期动脉粥样硬化中起关键作用[1],一氧化氮(notric oxide,NO)水平降低及内皮通透性增加等是糖尿病致心血管病变的重要原因。以往研究糖尿病与内皮功能损伤之间机制多集中于炎症、氧化应激、高血糖及胰岛素抵抗等。近年来,研究发现糖尿病(diabetic metillus,DM)、冠心病等疾病血小板激活明显增强,激活的血小板具有促凝作用,导致血管内皮损伤;血小板激活后能够产生血小板微颗粒(platelet microparticles,PMPs),PMPs黏附到血管壁释放花生四烯酸,介导炎症因子和黏附分子附着于内皮细胞,减少一氧化氮的合成和一氧化氮合酶的活性,损伤内皮功能,此外PMPs与低密度脂蛋白、脂肪酸相关,加重对内皮损伤,加速动脉粥样硬化的进展[2-3]。DM患者血浆中PMPs表达量明显升高,但DM合并早期动脉粥样硬化患者血浆中PMPs是否参与DM主动脉血管内皮损伤,其具体的作用机制是什么是尚不清楚。本研究通过探讨分析PMPs在DM主动脉血管内皮损伤的作用及机制研究,以期为临床治疗糖尿病大血管并发症提供依据。
1 材料和方法
1.1 实验动物
60只8~12周龄健康雄性SD大鼠,SPF级,体重(200±20)g,购自北京华阜康生物科技股份有限公司[SCXK(京)2015-0123],所有实验动物均饲养于中国医学科学院实验动物研究所屏障动物房SYXK号(京)2019-0023],饲养环境为:温度20℃~25℃,内外环境气压差≥10 Pa,相对湿度在40%~70%,照明强度在15~20 lx,动物自由取食饮水。本实验经过北京航天总医院IACUC的批准(MAM17039);本研究依照3R原则(the rules of 3R)实施。
1.2 主要试剂与仪器
CD61流式抗体(美国BD公司);凝血酶、阿司匹林、Hepes(美国Sigma公司);RNA提取试剂盒Biozol、脱 氧 核 糖 核 酸(dNTP)、VEGFA、ERK、p-ERK、IκBα、p-IκBα、NF-κBp65及GAPDH鼠抗人单克隆抗体(美国Santa Cruz公司);鼠抗人单克隆抗体eNOS、兔抗人多克隆抗体Caspase-3(Cell Signaling technology公司)。FACSCalibur流式细胞仪(美国BD公司);HT7700透射电镜(日本Hitachi公司);实时定量PCR仪(德国eppendorf公司);LKB-Bromma 2197型电泳仪(瑞典LKB公司);microlab 300半自动化分析仪(荷兰威图公司)。
1.3 实验方法
1.3.1 实验动物造模及分组
60只大鼠随机分为对照组(NC组,n=30)和DM组(DM组,n=30)。其中NC组、DM组均给予等体积的生理盐水。DM组大鼠造模:高脂高糖饲料(普通饲料中加入10%蔗糖、5%蛋黄及10%炼猪油)喂养,4周后禁食12 h,按照45 mg/kg经腹腔注射STZ(溶于pH=4.4、浓度为0.1 mmol/L的柠檬酸-柠檬酸钠缓冲液中),NC组腹腔注射等体积柠檬酸-柠檬酸钠缓冲液。于注射第3天通过尾静脉取血测定各组随机血糖。注射STZ后随机血糖仍高于16.7 mmol/L表明造模成功[4]。所有动物待造模成功后,继续饲养8周。
1.3.2 PMPs分离提取及鉴定
造模成功8周后,禁食12 h,于第2天按照50 mg/kg腹腔注射2%戊巴比妥钠麻醉处理,将收集的血液置于含有柠檬酸盐的BD管中,采用渐进性离心法制备无血小板血浆,以缺乏血小板血浆校准富血小板血浆,调整血小板计数在10.0×1010/L。采用ADP(10μmol/L)20μL刺激富血小板血浆15 min,3700 r/min离心5 min。弃去上清液,加入PBS 80μL后将PMPs进行重悬,制得PMPs悬液。取20 μL PMPs液和20μL富血小板血浆液于2个流式管中,分别加入5μL APC-FITC-CD61鼠抗人抗体。震荡摇匀后,室温避光孵育30 min,采用1%多聚甲醛进行固定。流式细胞术检测之前加入0.82μm标准微球5μL进行定位。每组PMPs通过分光光度计法测定PMPs中蛋白含量,调整每组PMPs蛋白含量在0.25 mg/L,用于后续各项实验。
1.3.3 大鼠主动脉VECs培养、鉴定
选取正常SD大鼠3只,无菌条件下打开胸腔,取胸主动脉置于无菌D-Hanks液中,取出外周结缔组织、残留血液。制备VECs,将获得主动脉组织置于含有20%胎牛血清的DMEM/F12培养液中,培养6 d左右,弃去主动脉并换液。细胞原代培养至融合80%,即传代,每隔1 d换液1次。细胞传第2代后,待细胞爬片生长融合至70%左右,用4%多聚甲醛固定,加入3%过氧化氢室温孵育,PBS冲洗后加入非免疫山羊血清封闭1 h,滴加Ⅷ因子抗体(1∶100稀释),4℃过夜。冲洗掉一抗后加入辣根过氧化酶标记的兔抗鼠IgG(1∶500稀释),经乙醇梯度洗脱,二甲苯透明后,中性树脂封片,采用PBS代替一抗作为阴性对照。每张盖玻片随机选择5个视野计数细胞。
1.3.4 VECs与PMPs共培养
在12孔板中培养VECs至细胞融合80%左右,经PBS冲洗后,每孔加入1 mL不含抗生素的高糖DMEM/F12,将不同组别的PMPs加入到细胞中,摇匀后放置于37℃、5%CO2培养箱中,分别共培养2、4、8、12 h后收集细胞。采用CCK-8法检测不同时间VECs细胞增殖活性,以细胞活性抑制率达到50%左右[(某一作用时间点-刚加药后)/刚加药后]为最佳作用时间。
1.3.5 免疫荧光激光共聚焦检测内皮型一氧化氮合酶(eNOS)、半胱氨酸蛋白酶3(Caspase-3)表达
取对数生长的VECs,调整细胞数5×104/L并接种于置有盖玻片的12孔培养板中,待细胞贴壁以后按照各组别分别给予PMPs预处理,根据1.3.4项所确定的最佳作用时间孵育细胞后,经3.5%的多聚甲醛固定10 min,0.2%Triton X-100冰上破膜15 min,采用3.0%牛血清蛋白封闭抗原封闭30 min,冲洗后加入鼠抗人单克隆抗体eNOS、兔抗人多克隆抗体Caspase-3后4℃孵育过夜,次日采用FITC二抗孵育1 h,再经DAPI染核后在激光共聚焦显微镜下随机选取视野进行拍照,实验重复3次。
1.3.6 流式细胞术检测VECs凋亡情况
取对数生长的VECs,调整细胞数为5×104/L并接种于置有盖玻片的6孔培养板中,待细胞贴壁以后按照各组别分别给予PMPs预处理,根据1.3.4项确定的最佳作用时间孵育细胞,培养结束后消化细胞,将细胞转移至EP管中离心(12000 r/min离心10 min),PBS冲洗后加入binding buffer,调整细胞为每mL 106个,从中吸取500μL并加入2.5μL AnnexinV和5.0μL PI,孵育5 min后,过300目筛上机检测。
1.3.7 qRT-PCR检测miR-4306表达情况
将0.5μL Has-micro-4306-mimics、microRNAinhibitor-NC以及Has-micro-4306-inhibitor分别与100μL DMEM/F12以及2μL Lipofectamine混合,将混合液按照每孔15μL接种于培养有VECs的12孔板上,培养6 h后更换培养基。加入不同组别PMPs后,后续按照1.3.4项中最佳最用时间继续培养细胞。按照处理方式不同分为正常PMPs组(Ctrl组)、正常PMPs+MicroRNA-inhibitor-NC组(miR-NC组)、正常PMPs+Has-micro-4306-mimics组(mimic-NC组)、正常PMPs+Has-micro-4306-inhibitor组(inhibitor-NC组)、模型PMPs组(M组)、模型PMPs+MicroRNA-inhibitor-NC组(miR-M组)、模型PMPs+Has-micro-4306-mimics组(mimic-M组)、模型PMPs+Has-micro-4306-inhibitor组(inhibitor-M组)。培养结束后,收集细胞。按照试剂盒要求提取各组细胞中总RNA,严格按照PrimeScriptTMRT reagent Kit逆转录cDNA。反应体系:SYBR Premix Ex TaqTMⅡ10μL,PCR引物2μL,DNA模板2μL,DEPC水6μL,总反应体系为20μL。每个样本设置3个复孔,PCR反应条件:95℃预变性20 s,94℃变性5 s,55℃退火45 s,共进行40个循环。以U6作为内参,反应结束后计算每个基因的循环阈值(Ct),同时与内参基因U6比较,确定各组基因表达水 平。 miR-4306上游引物序列: 5’-GCTAACCCGCCGGACACTTTTCACCTTA-3’;下游引物序列:5’-CGGTTCGACAACTATTTAGCTACA-3’,基因片段大小212 bp。内参U6上游引物序列:5’-GTCGCATCAGCTAGCTTTTCAGGCTA-3’;下游引物序列:5’-GCCTATACGCTCGTCATCGGTAGT-3’,基因片段大小124 bp。
1.3.8 蛋白免疫印迹法(Western blot)检测VEGFA/ERK1/2/NF-κB信号通路相关蛋白
取各组细胞悬液经离心沉淀后,收集细胞后加入200μL细胞裂解液(含有蛋白酶抑制剂)至冰上裂解45 min,再以12000 r/min离心30 min,取上清液,采用考马斯亮蓝进行总蛋白质定量。上清液中加入1/4倍量5×SDS上样缓冲液混合,煮沸7~8 min,以10%SDS-PAGE胶体,在120 V电压,200 mA恒定电流下电泳2 h,湿转至硝酸纤维膜上。采用5%的脱脂奶粉TBST缓冲液封闭(4℃过夜),洗去封闭液,加入鼠抗人VEGFA、ERK、p-ERK、IκBα、p-IκBα、NF-κBp65,TBST洗膜3次后,加入标记有辣根过氧化物酶二抗(山羊抗小鼠IgG)室温孵育1 h,经TBS洗膜3次后,将化学荧光发光底物均匀地加到膜的表面,置于曝光试剂盒中曝光,显影、定影等,采用凝胶图像处理系统分析条带灰度值。扫描目标蛋白灰度值与GAPDH比较所得的灰度值比进行定量分析。
1.4 统计学方法
采用SPSS 17.0统计软件包进行分析处理。正态分布资料以平均数±标准差(±s)表示,组间数据采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni’s postt检验,基因检测结果ΔCt值作图,采用2-ΔΔCt行非参数检验,△Ct值=Ct(miR-4306均值)-Ct(U6均值),2-△△Ct中 的 △△Ct =[( Ct(实验样本miR-4306均值)-Ct(实验样本U6均值)]-[(Ct(对照样本miR-4306均值)-Ct(对照样本U6均值)]。以P<0.05为差异有统计学意义。
2 结果
2.1 PMPs与VECs分离、鉴定
采用Western blot及流式细胞检测法分析鉴定,结果显示,与富血小板血浆比,PMPS中CD61表达明显升高(P<0.05),见图1A、1B。原代培养VECs结果显示,细胞为“铺路石”样结构,细胞经免疫组化染色后,细胞质颜色明显加深,Ⅷ因子呈高表达,因此鉴定细胞为VECs,见图1C。
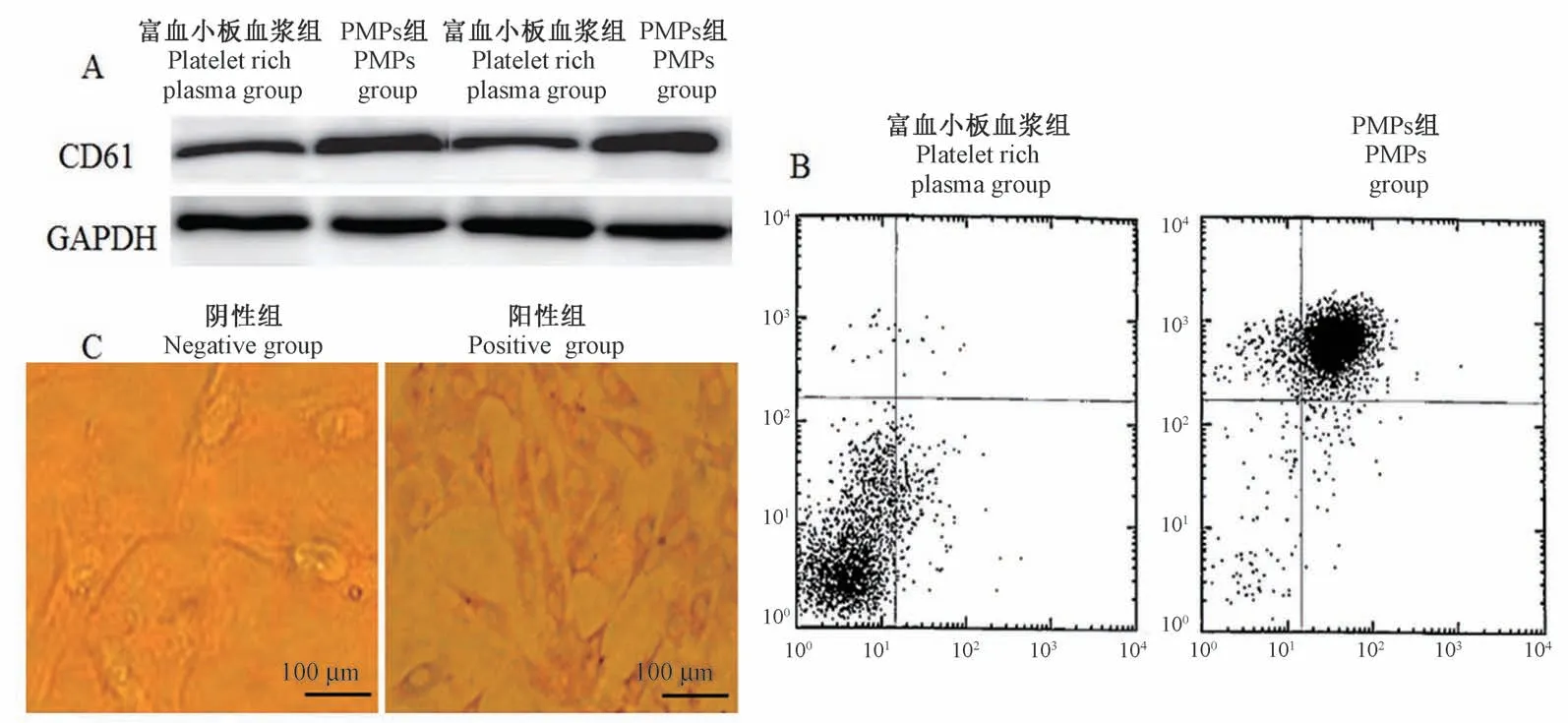
图1 PMPs及VECs的鉴定结果Figure 1 Identification results of PMPs and VECs
2.2 CCK-8法检测PMPs对VECs细胞增殖活性的影响
研究结果显示,DM组在PMPs作用2 h后,与0 h比差异无统计学意义(P>0.05),VECs与PMPs共培养4 h后,细胞出现明显的固缩变形,细胞形态不完整,有内陷,结构破坏严重。当作用4、8、12 h,细胞抑制率分别为48.44%(40.27%~54.37%)、63.41%(57.69%~72.33%)、66.26%(58.60%~74.24%),与0 h比差异有统计学意义(P<0.01),因此选择作用4 h为最佳作用时间,见图2。
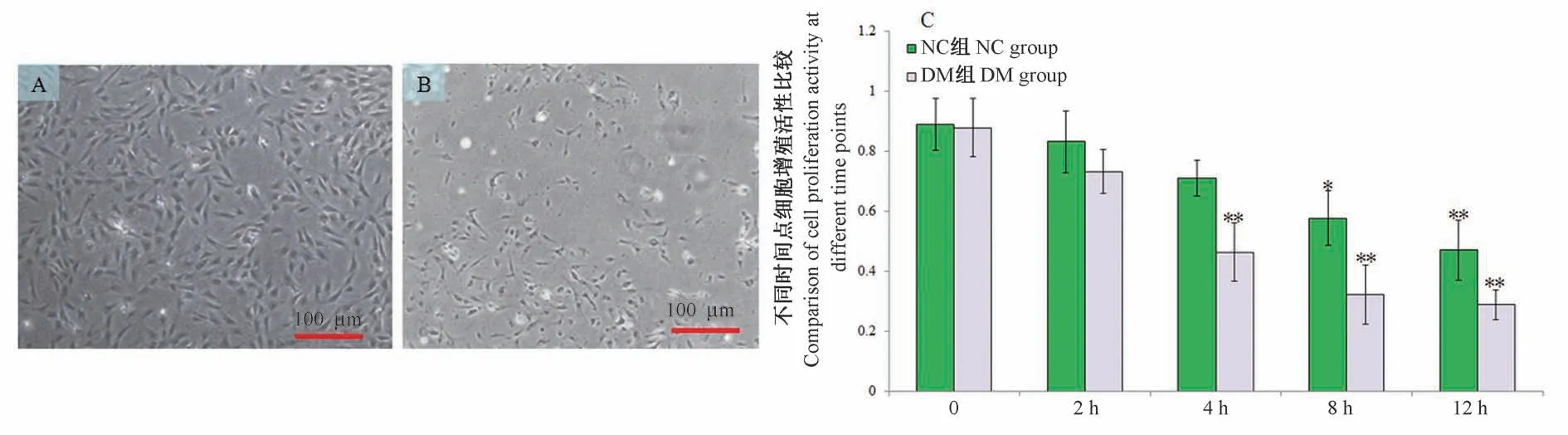
图2 CCK-8法检测不同时间各组PMPs对VECs细胞增殖活性的影响Figure 2 CCK-8 method to detect the effect of PMPs in each group on the proliferation activity of VECs at different times
2.3 细胞凋亡情况分析
研究结果显示,DM组细胞凋亡率(51.23±12.14)%,与NC组(9.27±3.04)%比差异有统计学意义(t=12.547,P<0.01),见图3。
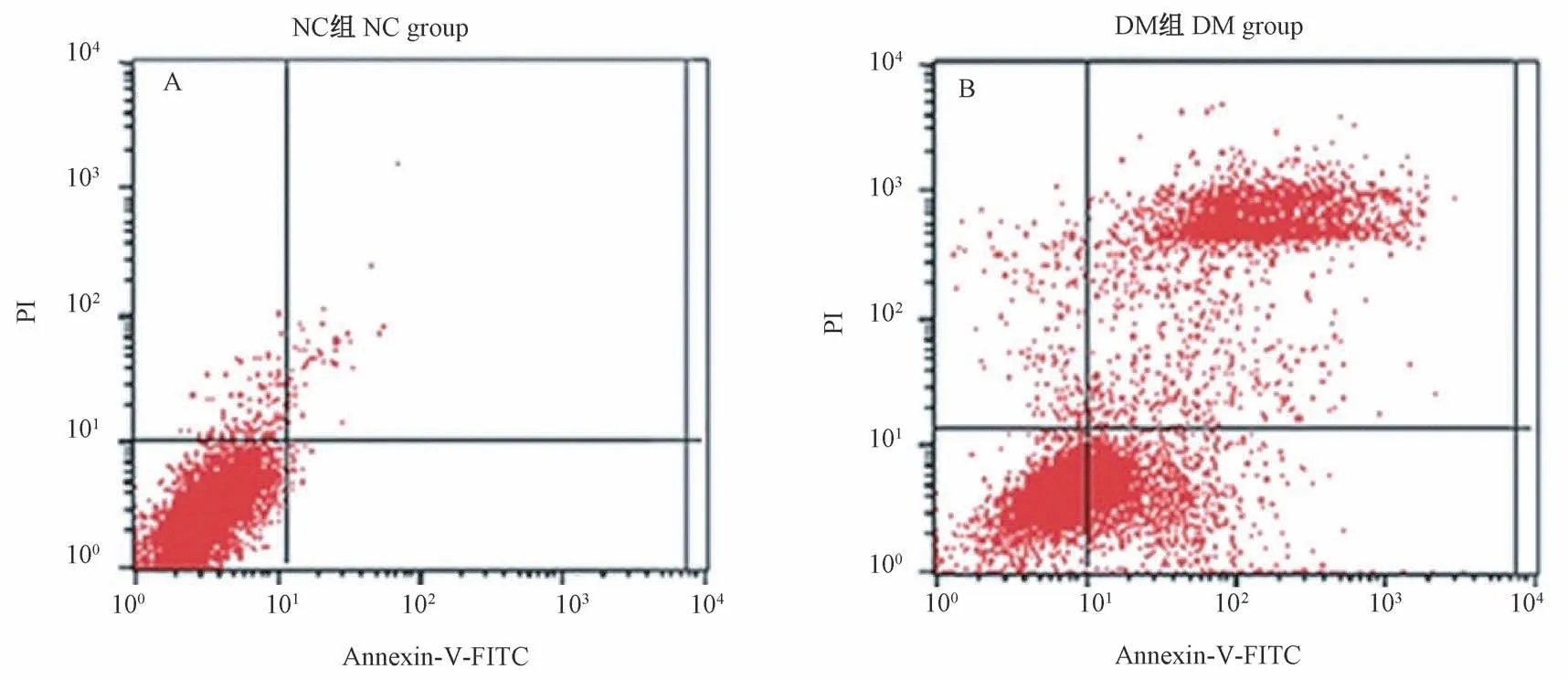
图3 流式细胞术检测不同组别细胞凋亡情况Figure 3 Flow cytometry to detect cell apoptosis in different groups
2.4 免疫荧光激光共聚焦检测eNOS、Caspase-3表达
免疫荧光激光共聚焦结果显示,DM组eNOS阳性表达率(82.54±19.58)%,与NC组(42.55±19.58)%比差异有统计学意义(t=12.336,P<0.01)。DM组Caspase-3阳性表达率(26.39±7.91)%,与NC组(54.32±11.07)%比差异有统计学意义(t=8.034,P<0.01),见图4。
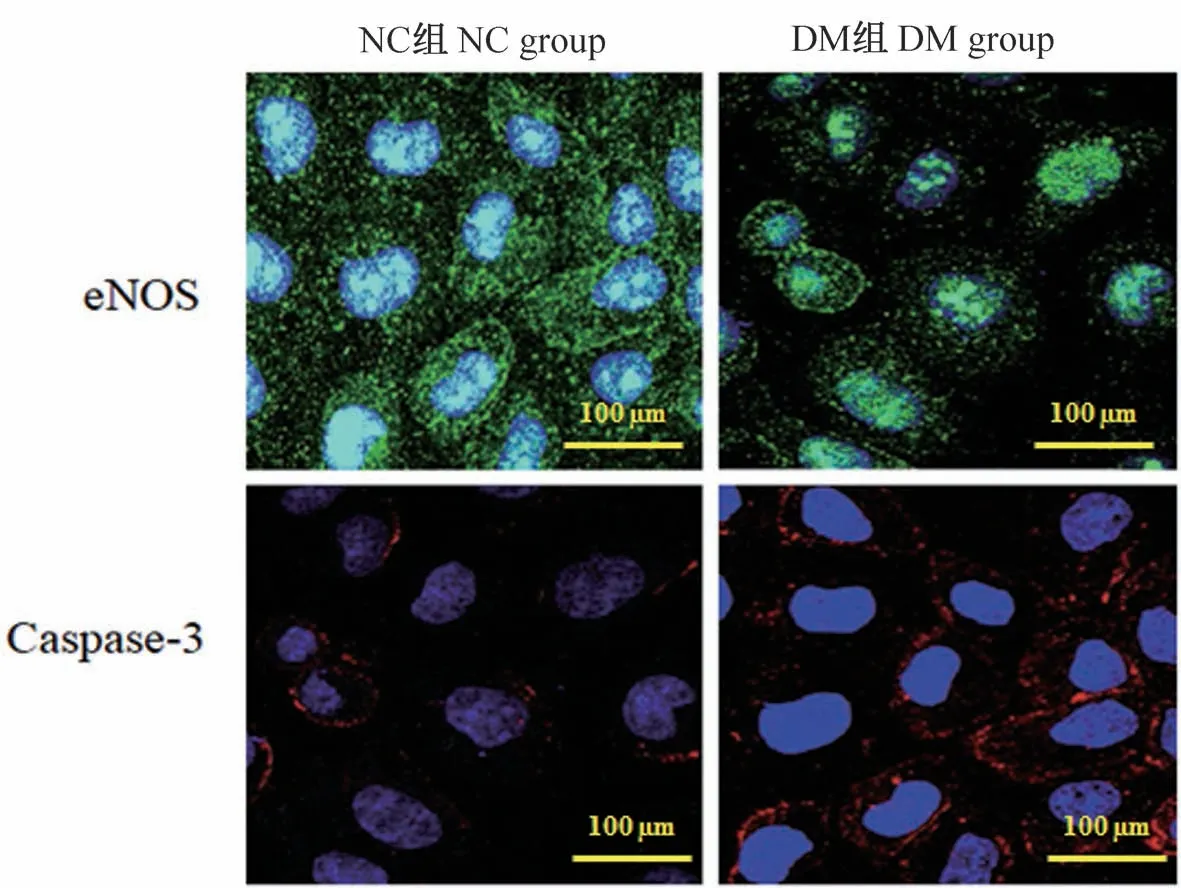
图4 免疫荧光激光共聚焦显微镜检测eNOS、Caspase-3表达情况Figure 4 Expression of eNOSand Caspase-3 detected by immunofluorescence laser confocal microscope
2.5 Western blot检测VEGFA/ERK1/2/NF-κB信号通路相关蛋白表达
研究结果显示,mimic-NC组、inhibitor-NC组、M组、miR-M组、mimic-M组VEGFA、NF-κBp65、p-IκBα及p-ERK相对表达量与Ctrl组比,差异有统计学意义(P<0.05或P<0.01)。mimic-M组、inhibitor-M组VEGFA、NF-κBp65、p-IκBα及p-ERK相对表达量与M组比,差异有统计学意义(P<0.05或P<0.01),见图5。
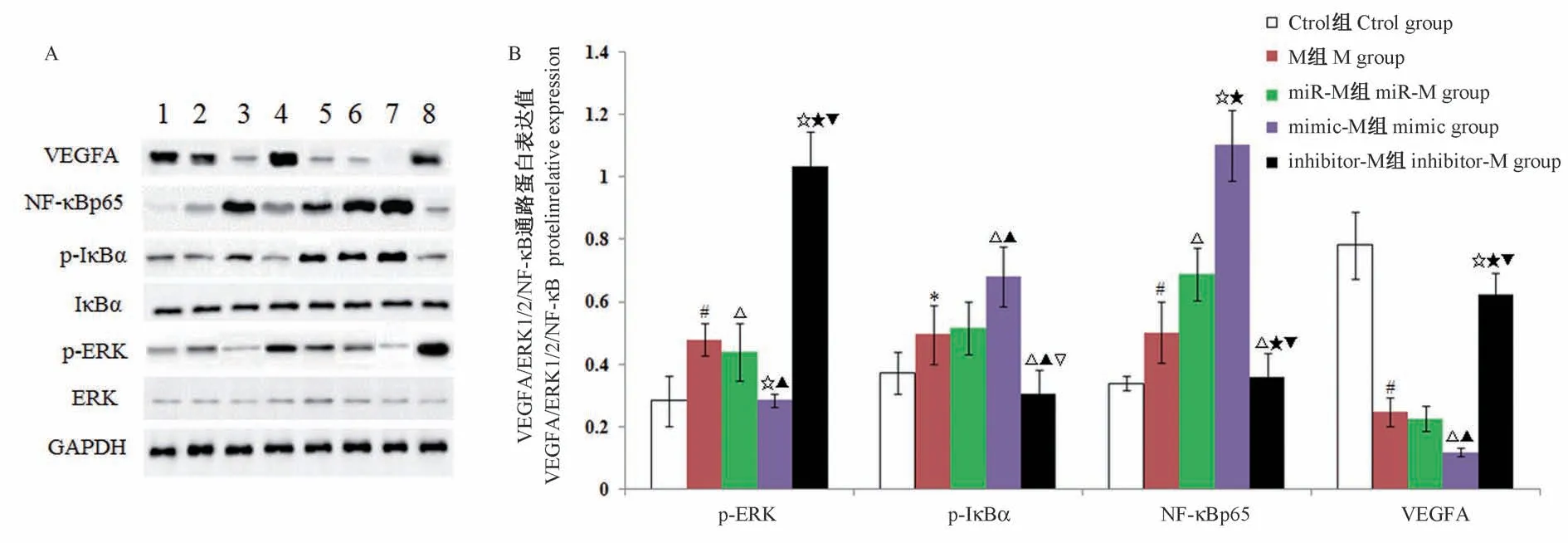
图5 Western blot检测VEGFA/ERK1/2/NF-κB信号通路相关蛋白表达Figure 5 Western blot detects the related proteins expression of VEGFA/ERK1/2/NF-κB signaling pathway
2.6 qRT-PCR检测miR-4306转染率情况
研究结果显示,mimic-NC组、inhibitor-NC组miR-4306相对表达量与miR-NC组比,差异有统计学意义(t=3.792、4.496,P<0.05或P<0.01);mimic-M组、inhibitor-M组miR-4306相对表达量与miR-M组比,差异有统计学意义(t=3.821、4.597,P<0.05或P<0.01)。mimic-NC组miR-4306相对表达量与inhibitor-NC组比,差异有统计学意义(t=6.794,P<0.01);mimic-M组miR-4306相对表达量与inhibitor-M组比,差异有统计学意义(t=8.115,P<0.01)。M组miR-4306相对表达量与Ctrl组比,差异有统计学意义(t=5.032,P<0.01),见图6。
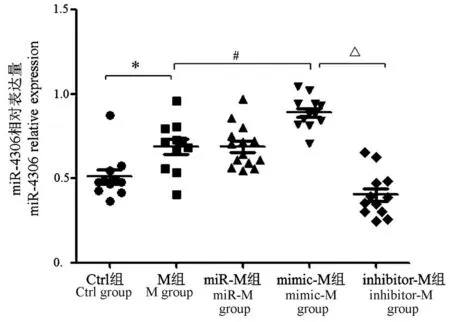
图6 qRT-PCR检测不同组别miR-4306相对表达情况分析Figure 6 Relative expression of miR-4306 in different groups detected by qRT-PCR
3 讨论
DM及其血管并发症的发病率逐年上升,已成为全球亟待解决的热点课题。研究显示,DM患者心血管死亡风险发生率较一般人员高三倍[5]。动脉粥样硬化是糖尿病心血管疾病的病理生理障碍基础,内皮功能损伤在早期动脉粥样硬化中起关键作用[6]。血小板活化后导致血小板收缩、变形以及形成伪足,变形后的一些细胞膜会以出芽的方式形成小泡且脱落形成PMPs[7]。PMPs水平异常与冠心病、DM、类风湿性关节炎、肿瘤等多种疾病的发生发展密切相关[8]。研究显示,PMPs主要通过PMPs携带的RNA和膜蛋白发挥免疫调节和生物信息传递作用,降低内皮的增殖、分化及迁移,已证实与动脉粥样硬化有关[9-10]。DM模型PMPs对血管内皮细胞增殖的影响及其作用机制如何值得研究。通过本研究发现,DM模型PMPs与内皮细胞共孵育后,增殖活性随着时间明显降低,且在培养4 h后出现明显的细胞凋亡,细胞出现固缩边缘,细胞完整性明显被破坏,提示DM血浆中PMPs可能造成内皮细胞损伤。
研究发现,PMPs能够降低细胞内一氧化氮表达从而介导炎症因子的表达,而这一作用与eNOS表达量显著相关[11]。为了探讨DM模型血浆中PMPs造成血管内皮细胞损伤的原因是否与eNOS表达量有关,本研究采用激光共聚焦技术显示,经DM患者血浆PMPs处理的内皮细胞(DM组)中eNOS阳性表达率显著低于正常大鼠血浆PMPs处理组(NC组),提示DM模型血浆中PMPs可能通过降低主动脉血管内皮细胞中eNOS表达量,导致NO水平降低,诱发细胞凋亡。已有研究显示,PMPs能够诱导血管内中性粒细胞活化,而中性粒细胞中释放多种因子引起内皮细胞损伤,进而导致血管内皮通透性升高以及Caspase-3高表达,内皮细胞凋亡率则明显升高[12],Caspase-3的升高能激活核酸内切酶切割DNA并最终诱发细胞死亡。本研究发现,经DM患者血浆PMPs处理的内皮细胞(DM组)Caspase-3阳性率显著高于正常大鼠血浆PMPs处理组(NC组),这一结果提示DM模型中PMPs参与了DM动脉血管内皮损伤,其主要原因可能与内皮细胞凋亡因子Caspase-3高表达及血管内皮细胞生长因子低表达存在明显关系。
微小RNA(miRNAs)在多种疾病的发生发展中起着重要作用[13]。miR-4306是近年来新发现的一种miRNAs,有研究发现,在冠状动脉疾病中人单核细胞衍生的巨噬细胞中miR-4306显著上调,而miR-4306表达上调可以通过Akt/NF-κB信号通路导致血管内皮损伤[14-15]。NF-κB是已经被证实为炎症诱发的关键因子,其调控信号通路被激活后将促进炎症因子等的高表达;VEGFA是一种具有促进血管内皮细胞增殖作用的细胞因子,其能够激活ERK信号通路,促进血管细胞的生长、增殖。为了探讨DM模型中PMPs引血管内皮细胞凋亡原因是否与miR-4306表达有关,本研究采用RT-PCR技术检测不同组别中miR-4306表达情况。本研究加入了miR-4306模型剂和抑制剂,结果显示加入mimic-4306后,通过分析研究显示,经DM患者血浆PMPs处理的内皮细胞(DM组)中miR-4306相对表达量显著升高,而Has-micro-4306-mimics和Has-micro-4306-inhibitor具有促进和抑制miR-4306表达的作用,提示DM模型血浆PMPs可能作用于miR-4306,且该miRNAs对内皮细胞生长、凋亡产生作用。
为了进一步分析PMPs介导的miR-4306是否对下游VEGFA/ERK1/2/NF-κB信号通路中相关蛋白产生作用,本研究通过Western blot检测分析显示,与正常PMPs组(Ctrl组)比较,DM组(M组)中p-IκBα、NF-κBp65表达量显著升高,而p-ERK及VEGFA则显著降低,加入mimic-micro-4306后,无论是正常PMPs组还是DM中PMPs组p-IκBα、NFκBp65升高量更高,而加入inhibitor-micro-4306后p-IκBα、NF-κBp65降低明显、p-ERK及VEGFA升高显著,同时inhibitor-M组与inhibitor-NC组具有统计学差异,提示DM血浆中PMPs能够通过miR-4306诱导p-IκBα、NF-κBp65升高,而降 低p-ERK及VEGFA的作用,进而引起内皮细胞凋亡损伤,诱发动脉粥样硬化的发生发展,以上提示DM模型血浆PMPs可能一方面引起miR-4306高表达,进而促进p-IκBα、NF-κBp65水平升高,诱导炎症反应、引起细胞凋亡,另一方面降低促进血管内皮细胞生长因子表达量的降低,进而导致细胞生长受阻,引起细胞凋亡。
综上,DM模型血浆中PMPs具有引起主动脉血管内皮损伤的作用,其作用机制可能为PMPs作用于miR-4306,进而激活VEGFA/ERK1/2/NF-κB信号,从而诱导细胞凋亡、引起内皮细胞生长因子表达下降。

