仿生人工肛门括约肌系统生物相容性及便意感知实验研究
丁紫凡 颜国正 姜萍萍 姚盛健 华芳芳 周泽润
0 引言
肛门失禁(fecal incontinence,FI)是指肛门括约肌丧失对直肠内容物的蓄控能力,是排便功能紊乱的一种症状。据美国国家胃肠道调查显示,18岁以上成年人中FI的发病率约为14.4%,且发病率随年龄增长显著增高[1]。随着我国人口老龄化的加剧,FI将愈发成为严重的社会公共健康问题。
目前FI的治疗手段主要有两类[2],即非手术治疗和手术治疗。非手术治疗,主要有增加纤维膳食、服用止泻药、生物反馈等,此类治疗方法疗效不确切[3];手术治疗方法,主要有括约肌修补术、括约肌移植、电刺激和肠造口术等,其中肠造口术是目前治疗重度肛门失禁的主要手术方法,该手术导致患者便意感知能力完全丧失,且术后多伴有严重的并发症[4]。
人工括约肌(artificial anal sphincter,AAS)是一种用于治疗FI的原位植入控便设备,是目前FI治疗研究的热点[5]。最早的人工肛门括约肌是美国Christiansen等[6]设计的水囊式人造肠道括约肌(artificial bowel sphincter,ABS)。ABS以挤压手动泵使假体膨胀的方式实现控便,无便意感知能力,临床应用存在肠道缺血、手动泵埋置处皮肤溃烂等问题[7-8]。英国Finlay等[9]设计的睡枕式假体肛门括约肌(prosthetic anal sphincter,PAS)通过睡枕型假体提升了肠道血供安全性。日本东北大学Shintaro设计的形状记忆合金式人工括约肌(artificial sphincter-shape memory alloys,AS-SMA)以两片施压均匀的形状记忆合金夹持直肠,存在温度过高而灼伤肠道及组织增生等问题[10]。德国Doll等[11]设计的智能型人工肛门括约肌系统(German artificial sphincter system,GASS)虽结构紧凑且实现了部分自动化控制,但不具备便意感知能力且生物相容性不佳。法国学者Lehur等[12]基于磁珠治疗胃食管反流症的方法设计了磁珠式肛门括约肌(magnetic anal sphincter,MAS),仅适用于轻度肛门失禁患者,无法感知便意,且仍不能避免增生不可控的问题[13]。意大利学者Litta等[14]设计的SphinKeeperTM是一种可植入括约肌间隙中的自膨胀假体,可作为增强肛门自制能力的FI辅助治疗方式。此外,国内的南方医科大学和上海交通大学也进行了AAS的长期研究[15-18]。上述研究以不同的括约肌假体结构实现了对肠道的夹持和释放,提供了宝贵的技术应用及临床实践经验,但AAS的生物相容性不佳、缺乏便意感知能力和血供安全性的问题限制了其大规模临床应用。
为解决现有AAS的上述问题,本文提出改进的BAAS系统,在对括约肌假体结构及封装、压力检测与便意感知进行了深入研究的基础上,设计了封闭连杆式“三环”括约肌假体及其一体化医用硅橡胶薄膜的封装方案,建立了基于向量相似度的便意智能感知模型,并通过体外实验、动物实验验证了系统的血供安全性、生物相容性和便意感知准确性,证明了BAAS系统具备长期稳定工作并进行准确便意预警的能力。
1 仿生人工肛门括约肌系统
1.1 系统整体结构
BAAS系统由体内部分和体外便携装置组成,其中,体内部分包括括约肌假体和与之相连的无线能量接收端;体外便携装置包括手持控制端、无线能量发射器和与之相连的无线能量发射端,如图1所示。当BAAS在体内工作时,位于括约肌假体内的微型控制器将压力、温度和电池电压信息发送给体外手持控制端,手持控制端实时接收并存储、显示信息。随着肠道内容物的积累,便意智能感知模型结合体内压力数据给出排便判断,手持控制端报警提醒患者排便。

图1 BAAS系统组成
如图2所示,系统设计了封闭连杆式“三环”括约肌假体,通过夹持肠道形成肛肠角实现控便,相比传统的环形挤压式假体,提高了血供安全性。系统创新地采用一体化医用硅橡胶薄膜括约肌假体封装方案,提升了系统生物相容性,并通过10路压力传感模块建立便意智能感知模型,提供准确可靠的便意感知能力。

图2 括约肌假体封装与传感器布置方案
1.2 括约肌假体封装方案
为提升括约肌假体的生物相容性,其封装方案需要优化假体的材料特性,并进行模块化集成设计。
硅橡胶从1954年开始用于临床植入,是目前应用最为广泛、技术最为成熟且生物相容性佳的医用有机硅高分子材料,具有无毒、生理惰性、耐生物老化[19]等优点。聚醚醚酮是一种特种热塑性聚合物,具有良好的力学性能和生物相容性[20],作为金属植入物的替代品被广泛应用于骨科和创伤等领域[21]。如图2所示,封闭连杆式“三环”括约肌假体表面贴覆均匀且生物相容性良好的医用硅橡胶薄膜,无线充电接收端外壳材料采用聚醚醚酮,括约肌假体与无线充电接收端之间通过医用硅胶软管连接。
如图3所示,括约肌假体采用模块化的集成方式,内置微型控制器、电机及其驱动模块和压力传感模块,无线能量接收端内置充电管理模块和可充电锂电池,该设计对括约肌假体内部空间的利用率很高,且便于无线能量接收端的插拔调试。同时,拆卸灵活的“三环”设计使得在机构植入手术时,括约肌假体上下臂和中环臂可分别穿过肠道后再通过医用钛合金螺钉连接,避免了肠吻合手术,减小了对肠道组织的影响。

图3 括约肌假体内部结构
1.3 肠道压力检测模块
为检测肠道压力,BAAS系统设计了C29湿介质绝压传感器裸片的二次开发方案,以硅凝胶为传感介质进行肠道柔性压力检测。10路压力传感模块分别布局在“三环”轴向、径向,可实现对肠道压力全面、精准的测量,如图2所示。其中,上环径向、上环轴向、中环轴向的传感模块用于构建便意智能感知模型,中环径向用于保障肠道血供安全性,下环径向用于辅助排便检测。
封装完毕后,将系统的体内部分放入位于恒温水浴槽的密封罐内,密封罐内部插入温度计(Fluke, 1502型温度读数计,USA)和压力控制器(DHI,A350K型压力标定仪,USA)。标定实验中,维持密封罐内部温度在39 ℃(模拟动物的肛门温度),以5 kPa步长调整压力值从100 kPa至130 kPa,在10路压力传感模块标定结束后,得到线性拟合曲线的通式方程为:
Pi=F(Xi)
(1)
F(Xi)=aiXi+bi
(2)
式中:i表示传感模块的编号;Pi表示压力传感模块的示数;Xi表示压力值,kPa;ai和bi分别表示拟合曲线的斜率和截距。
拟合曲线如图4所示。
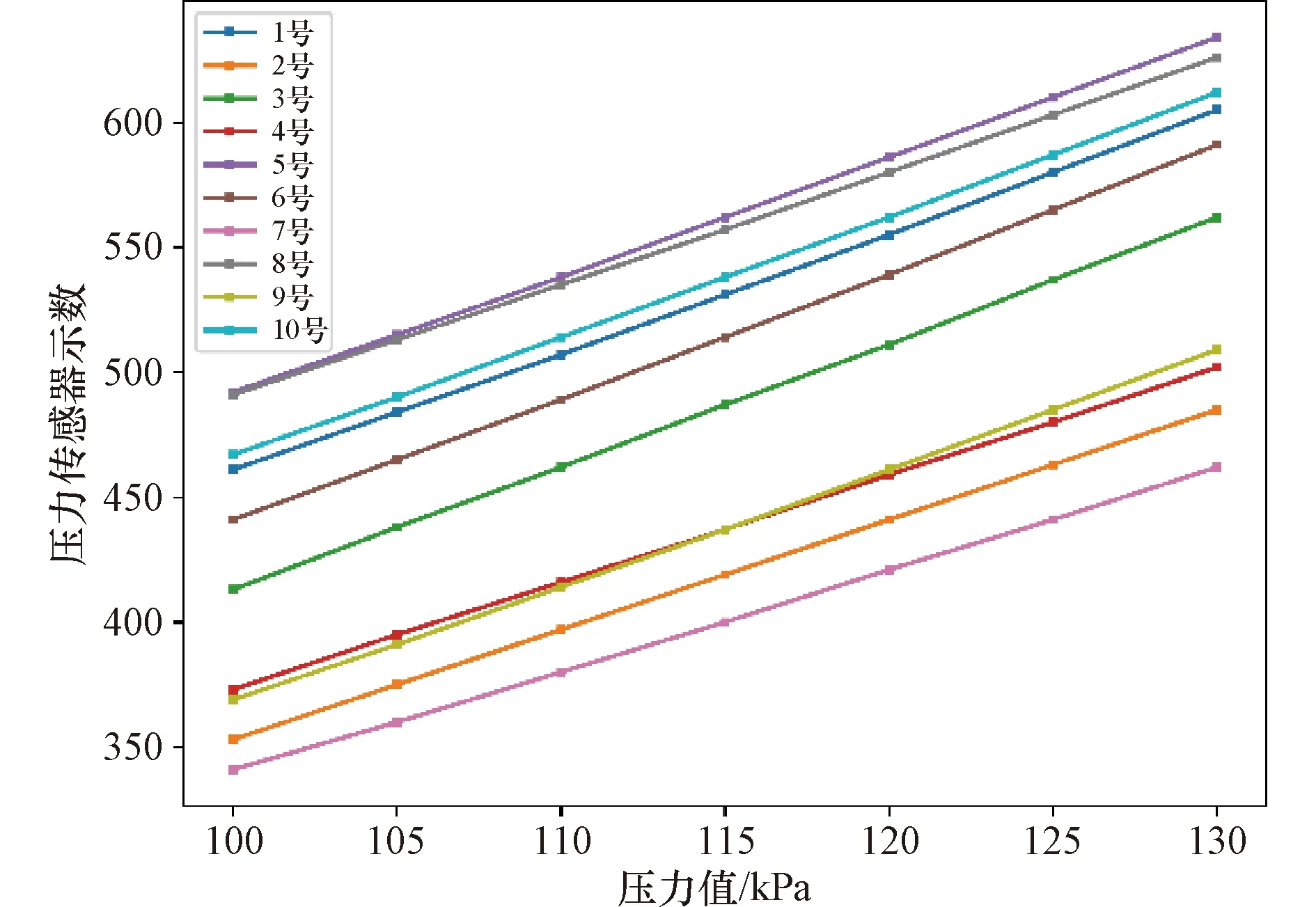
图4 10路压力传感模块的最佳拟合曲线
计算可得拟合曲线的斜率和截距用于对肠道压力的测量。在后续实验过程中采用相对压力X′i的表述:
X′i=Xi-B
(3)
式中:B为标准大气压(101.325kPa);X′i表示i号压力传感模块示数为Pi时所对应的肠道相对压力。
2 体外实验
体外实验的目的是初步评估括约肌假体的控便能力与血供安全性,并建立便意智能感知模型,为动物实验做准备。
2.1 实验平台
实验平台搭建如图5所示,选用新鲜猪大肠,取其末端附近粗细均匀的20 cm直肠模拟人体直肠;采用波纹管模拟直肠上端肠道,以保证肠内压力伴随液位而均匀上升;采用10 mm厚度充电隔板模拟无线能量接收端植入人体后的无线传输距离。物料备齐后,将波纹管固定在支撑架上,将猪大肠固定在波纹管末端,将括约肌假体固定在支撑板上,并使之夹持于直肠末端。

图5 体外实验平台
2.2 控便能力与血供安全性
研究表明,人体开始产生便意时肠道内相对压力(标准大气压101.325 kPa)达到1.185 8 kPa(H=12.1 cm),如果压力上升到2.410 8 kPa(H=24.6 cm),就会产生持续便意[22-23]。同时,若要保证肠道的血供安全,括约肌假体的最大夹持压力不能超过60~70 mmHg[24](8.00~9.33 kPa)。因此括约肌假体至少需要蓄控高度为24.6 cm的肠道内容物,并保持夹持压力始终小于9.33 kPa。
操作手持控制端使括约肌假体完全关闭,夹持肠道形成的肛肠角角度为85°~95°,如图6所示,采用此时括约肌假体能蓄控的内容物液位高度来衡量其控便能力;采用位于机构中环径向的5号、6号压力传感器的平均值作为假体关闭时的夹持压力。分别往猪大肠内加入纯净水(ρ=1 g/cm3)和糊状模拟粪便(ρ=1.3 g/cm3),依次读取内容物高度值,并根据压力传感器示数计算对应的夹持压力,重复实验3次并计算平均值,实验结果见表1。

图6 肛肠角
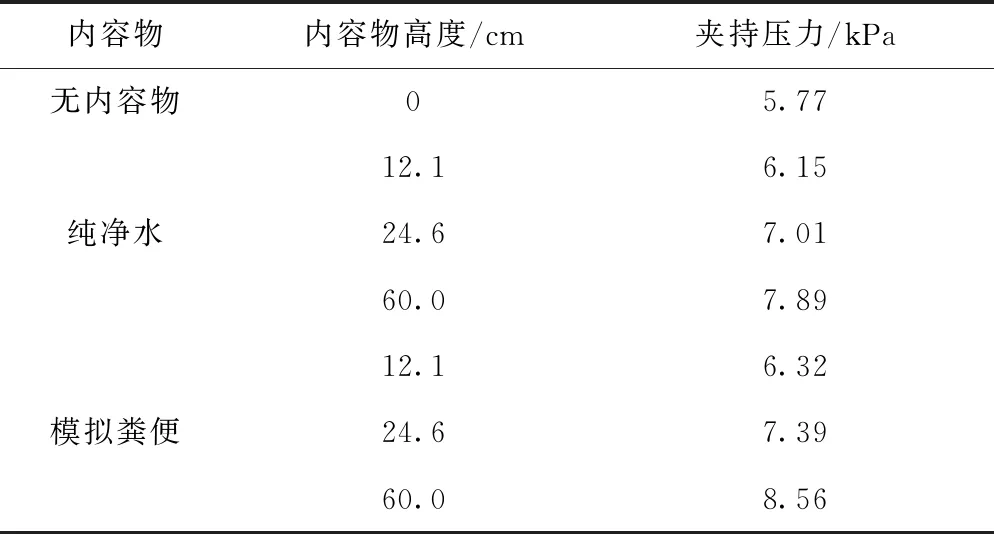
表1 内容物高度与夹持压力
实验结果表明,人体开始产生便意(H=12.1 cm)和产生持续便意(H=24.6 cm)时,在肠道内容物是纯净水和模拟粪便的情况下,括约肌假体都可以实现控便,且夹持压力均小于8 kPa。肠道内容物高度达到60 cm时,机构仍可控便,此时最大夹持压力为8.56 kPa。故本括约肌假体对两种肠道内容物的蓄控效果满足便意阈值需求,且最大夹持压力在肠道血供安全性范围内,满足控便和血供安全性要求。
2.3 便意智能感知模型
人体从产生便意到排便是一个复杂的神经反射过程,而重度肛门失禁的患者通常丧失感知便意的能力,人工肛门括约肌系统通过肠道压力传感模块可以重建患者的便意感知能力,辅助其恢复正常的排便习惯。传统的便意感知模型通过体外猪大肠实验中水柱高度对应的传感器压力值来确定排便阈值,若任意一个压力值超过了排便阈值,则判定需要排便。但动物实验表明使用单一的阈值时便意判断不准确,且易受外界条件干扰而产生误判[25],因此需要建立一种更稳定可靠的便意判断标准。
为克服单一阈值判断的弊端,本研究创新地采用括约肌假体上环径向(1、2号)、上环轴向(3、4号)、中环轴向(7、8号)的压力传感模块采集到的压力值作为判断便意的依据,将这6路传感模块的数值联合成为压力向量P(X′1,X′2,X′3,X′4,X′7,X′8),通过度量压力向量与排便阈值向量P0之间的相似度来判断是否排便,建立基于向量相似度的便意智能感知模型。
常用的度量向量相似度的方法是计算两向量间的距离,有欧几里得距离、曼哈顿距离、切比雪夫距离等。两个n维向量A(x11,x12,…,x1n)与B(x21,x22,…,x2n)间的距离d12计算公式如下。
欧几里得距离:
曼哈顿距离:
切比雪夫距离:
因此,通过体外实验确定肠道内容物高度与压力向量的对应关系,得到排便阈值向量与零向量之间的距离阈值,再通过计算待判定向量与零向量之间的距离判断是否便意预警。
体外实验中,通过确定液位高度与6路压力数值之间的对应关系(图7),得到持续便意高度(H=24.6 cm)对应的排便阈值向量P0。同时,通过表2的计算公式得到向量距离与水柱高度的关系(图8)。由图8可知欧几里得距离、曼哈顿距离、切比雪夫距离均随着水柱高度的升高而增加,但曼哈顿距离对水柱高度的变化最为敏感,最适用于精确的便意检测模型,故选用曼哈顿距离作为度量向量相似度的标准。排便阈值向量P0的曼哈顿距离为46.9 kPa,当压力向量P与零向量的曼哈顿距离超过46.9 kPa时,手持控制端报警提醒患者排便。
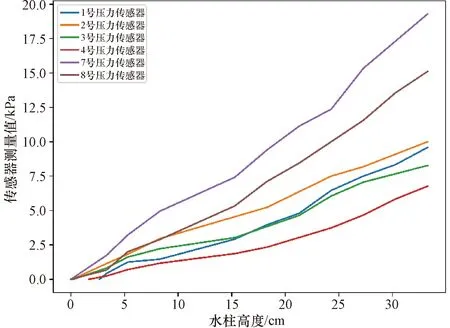
图7 传感器测量值与水柱高度的关系
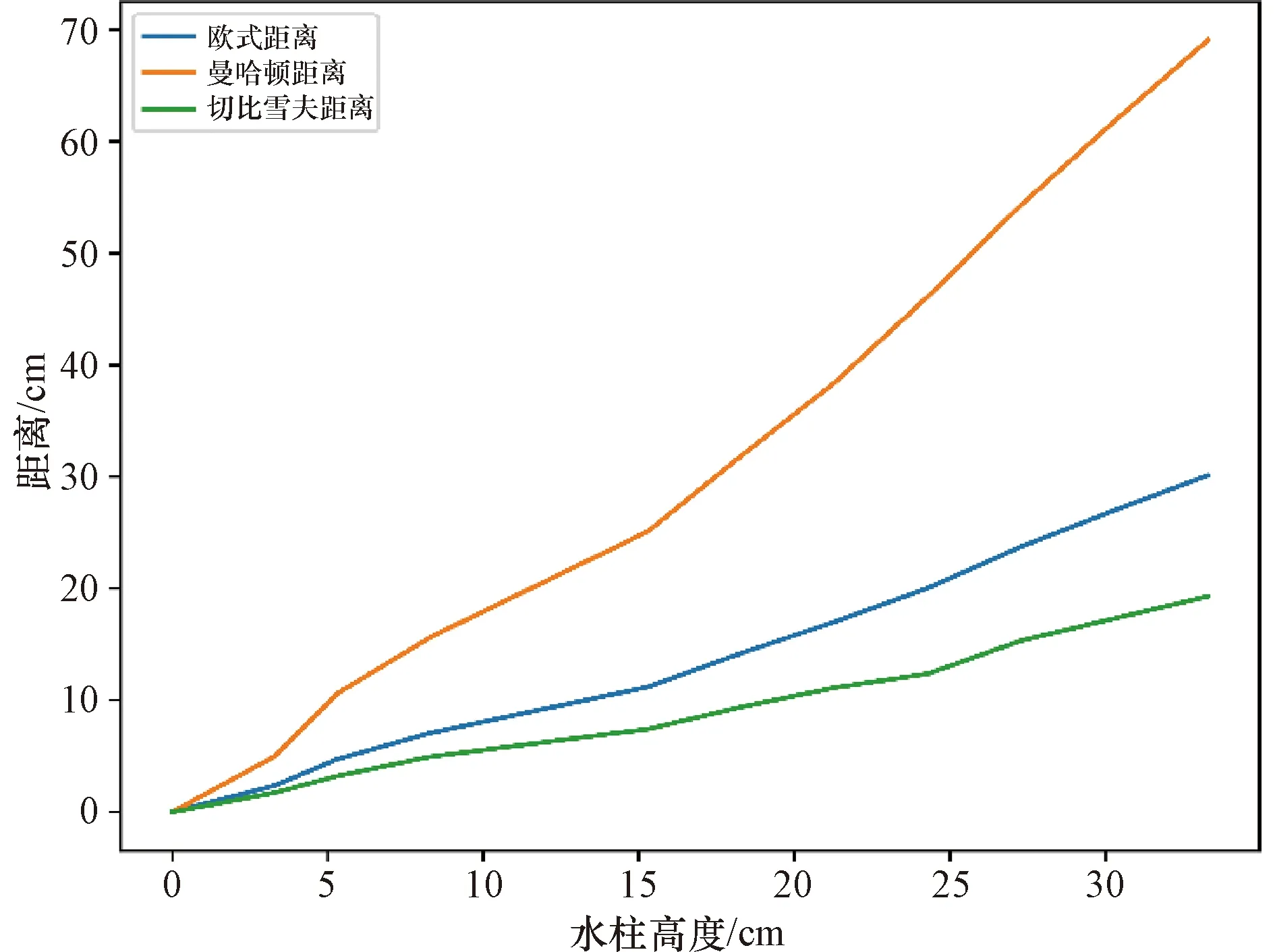
图8 向量距离与水柱高度的关系
3 动物实验评估
动物实验的目的是对BAAS系统整体植入效果、生物相容性、控便及便意感知能力等进行观察和评估。其中,生物相容性是指生命体组织对非活性材料产生反应的一种性能,包括血液相容性和组织相容性[26]。血液相容性的评价指标有抗血小板血栓形成、抗溶血性、抗白细胞减少性等,可通过静脉血样指标进行观测;组织相容性的评价指标有抗炎症性、细胞黏附性、无致癌性等,可通过实验动物组织学观察、病理组织切片观察等方式进行评估。
3.1 实验动物
实验经上海交通大学伦理委员会批准,并严格遵守上海交通大学动物实验相关规定,在上海交通大学七宝校区农学院教学实验养殖中心开展。实验动物选用的是2头雌性广西巴马小香猪,年龄2个月,体质量约30 kg。两头小香猪每日进食量控制在600 g左右,实验前1周小香猪排便习性表明,每日排便1~3次,每次粪便量50~80 g。
3.2 实验步骤及观测指标
动物实验分为两个阶段。第一阶段为括约肌植入术,目的是将BAAS假体及无线能量接收端植入实验动物体内。
在术前24 h将实验动物禁食处理,括约肌系统的体内部分用600~800 mg/L环氧乙烷熏蒸消毒。将实验动物麻醉并固定于无菌操作台,备皮、消毒、铺巾后在下腹部位置逐层开腹,游离出直肠末端后切断该段肠道附近肠系膜,将括约肌假体安装于该段肠道上,将无线能量接收端放置于腹股沟皮下,逐层缝合后,完全切断原有肛门括约肌,破坏巴马小香猪自身控便能力。括约肌植入术如图9所示。
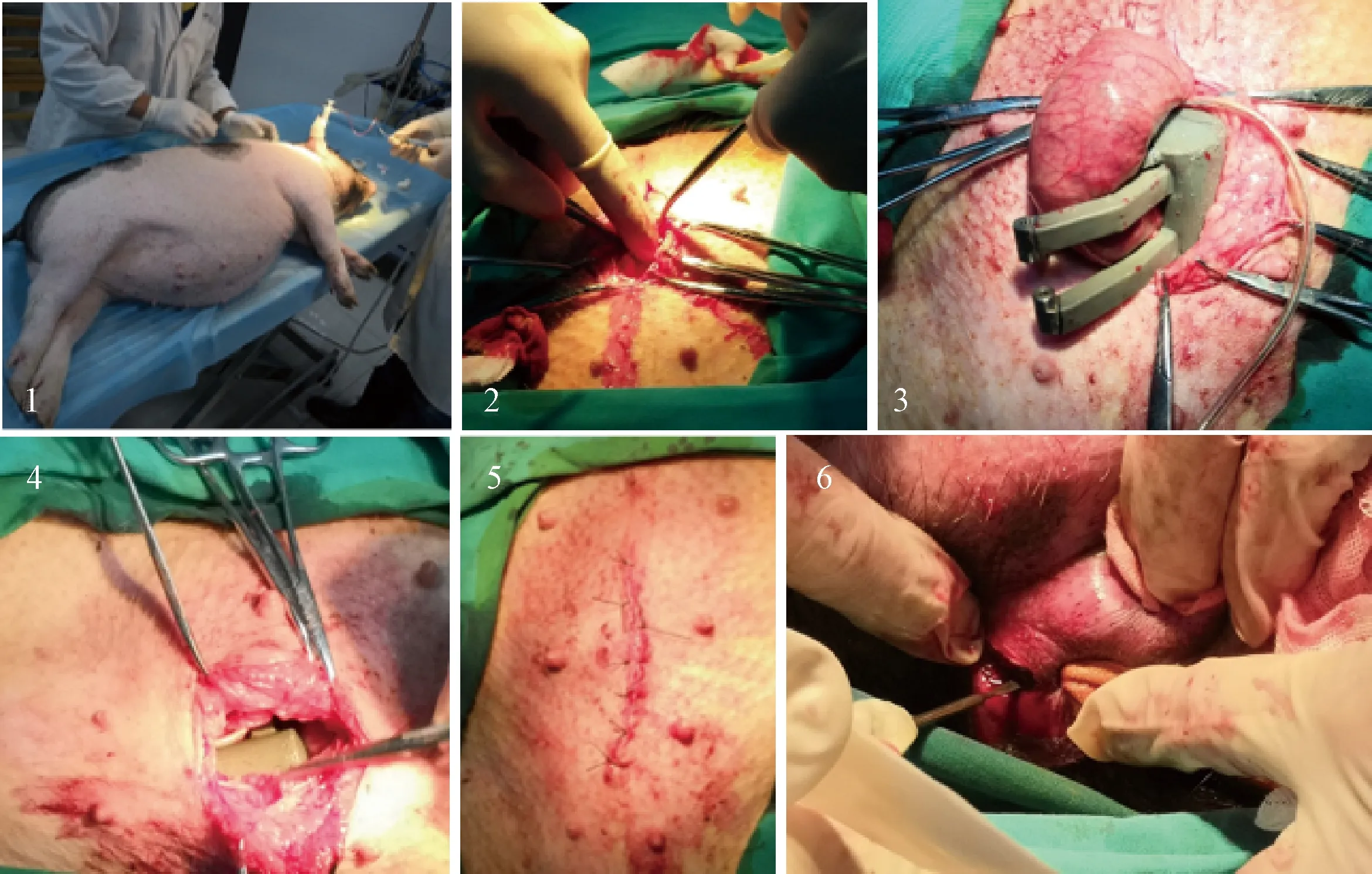
1—麻醉与固定;2—逐层开腹;3—安装括约肌假体;4—放置接收线圈;5—缝合;6—破坏原有括约肌功能
第二阶段为实验观察期,主要观测系统植入效果、控便及便意预警能力。先进行5日术后恢复,期间括约肌假体打开,自由排便。第6日开始关闭体内括约肌假体,每日喂食2次,每次投喂300 g小香猪饲料,每日于手持控制端报警时打开括约肌假体,进行控便排便实验。期间24 h采集肠道压力数据,监测并记录每日排便情况,并通过经皮无线能量传输保证括约肌系统能量供给,如图10所示。

图10 实验观察期
42 d后动物实验结束,严格遵照伦理学要求将实验动物麻醉解剖。取出体内装置对其进行测试分析,并对括约肌假体及无线能量接收端的周围组织进行切片取样。
3.3 实验结果
3.3.1 生物相容性
在2头实验动物清醒状态下从前腔静脉采血10 mL,分装于采血管,血液生理指标采用全自动五分类血球仪测定,如表2所示。其中,白细胞总数和红细胞总数可以作为感染的参考,血红蛋白、红细胞压积和血小板总数可用于确认营养状况,红细胞平均体积、平均血红蛋白量和平均血红蛋白浓度可用于判断是否有贫血症状。与参考值相比,系统植入42日后1号猪血液主要生理指标基本分布在正常范围内,2号猪白细胞总数较低,是由于2号猪无线能量接收端植入处有轻微炎症和少量积水,为其注射了抗生素。血常规结果表明系统血液相容性良好,长期植入未对血液生理指标造成不利影响。
将实验动物麻醉解剖,开腹查看括约肌假体、无线能量接收端、肠道组织变化及血供情况。解剖发现,括约肌假体整体封装完好,系统运转正常,能量供给良好,括约肌假体和无线能量接收端周围都形成了组织纤维囊,肠道未出现感染,组织整体状况良好。其中1号猪肠道状态相对健康,2号猪肠道在括约肌假体植入处存在上端内容物通过障碍问题,初步判定为肠道扭转粘连导致的肠梗阻现象。
从实验动物的无线能量接收端周围皮下组织、括约肌假体移植处增生组织取少量样品,切割成3~4 mm大小组织块,分别放入4%多聚甲醛中固定。经过脱水透明、石蜡包埋、切片展片等步骤后进行苏木精-伊红染色(简称HE染色)和Masson染色,如图11所示,用显微镜观察检查其组织情况。
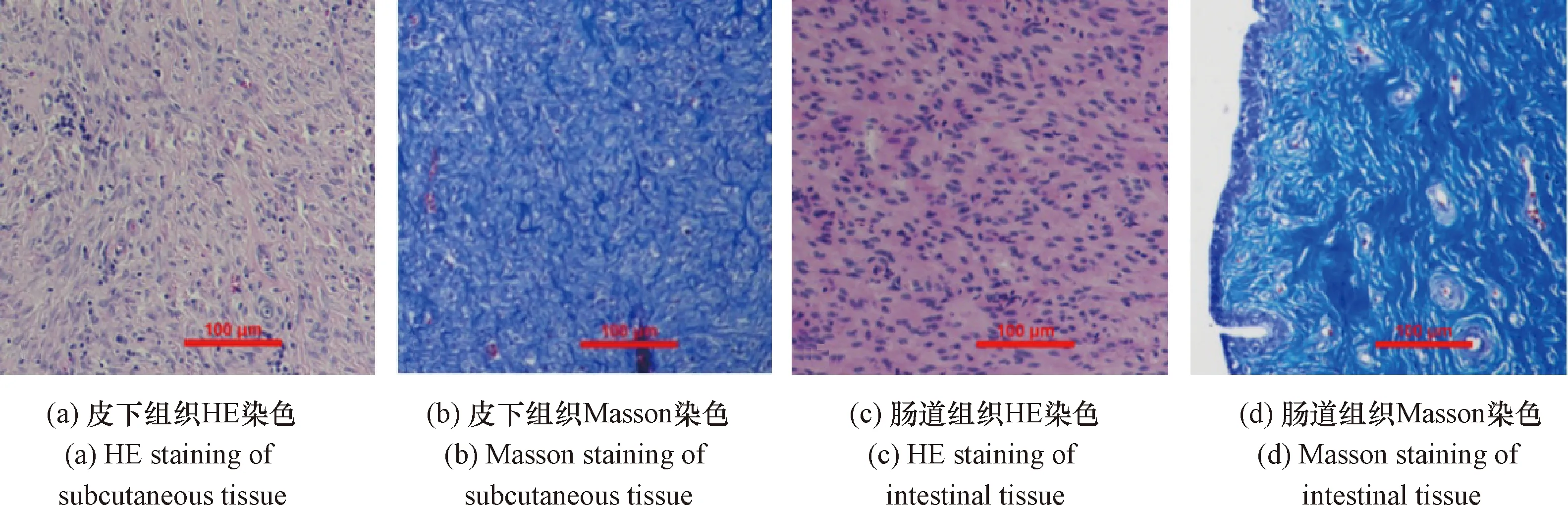
图11 组织HE染色和Masson染色(10×)
无线能量接收端周围皮下组织的HE染色和Masson染色结果分别如图11(a)和(b)所示,可见组织为皮下胶原纤维组织增生,HE染色细胞浆较难着色,细胞核被少量炎症细胞浸润,Masson染色见大量均匀的胶原纤维着色,少见弹力纤维着色。括约肌假体移植处肠道增生组织染色结果分别如图11(c)和(d)所示,HE染色见大量上皮细胞增生,未见炎症细胞浸润,Masson染色未见炎性因子,见大量胶原纤维增生。
组织切片结果初步表明括约肌假体的医用硅胶膜封装稳定,无渗漏,无毒害,长期植入后不会对生物组织产生明显危害,具备良好的生物相容性。但聚醚醚酮封装的无线能量接收端植入皮下组织后可能导致组织感染而积液的情况,初步判断原因主要有:(1) 3D打印加工工艺精度不够,无线能量接收端表面粗糙导致组织相容性差;(2) 经皮无线供能过程中线圈发热,诱发了组织感染肿胀。
3.3.2 便意智能感知模型评估
在括约肌植入术后的第二周内,两头猪一共触发了19次便意预警(1号猪10次,2号猪9次),在每次触发便意预警时打开括约肌假体收集粪便,打开后10 min内收集到粪便则表示便意预测成功,否则失败。统计得便意智能感知模型的总体预测成功率为52.6%,其中1号猪成功率为80%,2号猪成功率为22.2%,如图12所示。实验期间对2号猪实施肛门指检后判定其直肠内具备便意症状但没有正常排便,实验结束后经解剖发现其有肠道粘连梗阻的情况,故在计数时得到的预测成功率较低。

图12 便意智能感知模型准确率
4 讨论与结论
基于前期研究的经验与不足,本研究提出一种新型的BAAS系统,括约肌假体采用封闭连杆式“三环”结构,外覆医用硅橡胶薄膜,内置10路压力检测传感模块,采用基于向量相似度的便意智能感知模型实现精准的便意预警。系统采用经皮无线能量传输实现能量供给,通过优化改进后的手持控制端实现无线通信和远程控制。
体外实验表明,封闭连杆式“三环”括约肌假体对液体粪便和糊状粪便的蓄控能力都比较好,且便意范围内夹持压力小于8 kPa,满足肠道血供安全性的要求。区别于传统的单一阈值便意判断,基于体外实验的模拟便意数据建立了基于压力向量相似度的便意智能感知模型,确定压力向量的距离报警阈值(曼哈顿距离46.9 kPa)。
通过动物实验综合评估了系统的整体植入效果、生物相容性和便意感知能力,获得了丰富的肠道压力数据信息。与之前的研究相比,本次动物实验更加成功,实验动物安全度过排异期,且系统能够在体内进行正常的压力检测、假体开合、无线通信与供能。血液生理指标检测、组织切片染色观察表明体内部分满足血液相容性和组织相容性的要求,在生物相容性的评价维度上可以满足长期植入的需要。通过连续便意预警监测,判断植入正常的情况下基于向量相似度的便意感知模型具备更优的准确率和可靠性,为之后的便意智能感知研究建立了模型基础。针对此次动物实验暴露的临床医学问题,如2号猪肠道粘连梗阻现象,结合临床肛肠专家的评估建议,宜加强植入术时的腹腔抗感染处理,并固定植入的括约肌假体,防止肠道扭转粘连。
今后的研究重点主要围绕以下几个方面:综合优化经皮无线能量供给系统,提高充电效率、减少持续发热、制定充电策略、提高生物相容性等;进一步对肠道内容物状态进行测量,区分固体、液体和气体,实现控便状态下的机构夹持角度的自适应控制,提升肠道血供安全性,对肠道急性疾病建立预警机制,实时诊查保障肠道健康;进一步实现神经系统意义上的便意重建,将体内便意转化为神经电位信号接入盆底神经,实现基于盆神经上行通路的便意功能重建。

