新型含嘧啶环的半乳糖苷类衍生物的合成及杀菌活性
陈美航, 鲁道旺, 张 迅, 杜士杰, 李 娜,马关康, 吴文能, 罗海荣*,
(1. 铜仁学院 材料与化学工程学院,贵州 铜仁 554300;2. 贵阳学院 食品与制药工程学院,贵阳 550005)
嘧啶类衍生物不仅具有杀菌、除草、杀虫及抗病毒等生物活性,还具有高效、作用方式独特、对人类低毒和对环境友好等优点[1-6]。自1968年英国卜内卡门公司首先发现乙嘧酚以来,已有数十个嘧啶环类杀菌剂被相继开发出来,如甲基嘧菌胺、氟嘧啶醇和醚菌酯等。目前,嘧啶类杀菌剂已成为新农药创制研究中的焦点之一[7]。2020 年,Borthakur 等发现,3,5-苯基-7-氨基-[1,3]-噻二唑[3,2-a]嘧啶-6-腈衍生物对水稻纹枯病菌具有很好的杀菌活性[8]。本课题组在前期研究中发现,N-取代嘧啶吡唑酰胺类衍生物具有杀菌活性,其中部分化合物对拟茎点霉菌Phompsissp.的活性优于对照药剂甲基嘧菌胺[9-10]。
糖苷类化合物是植物体内的二级代谢产物,广泛存在于植物体中。研究表明,糖苷类化合物不仅具有抗菌、抗肿瘤和抗氧化等活性[11-13],在生物识别过程中还起着重要作用[14]。糖苷类化合物一直是研究热点之一。刘斌等报道,5-核糖或木糖亚甲基-2,4-咪唑啉二酮衍生物对西瓜枯萎菌、苹果炭疽菌等7 种病原真菌具有一定的抑制活性[15];Zong 等合成了两个系列新型1,3,4-噻二唑基呋喃糖衍生物,其对油菜菌核病菌等具有很好的抑制活性[16-17]。本课题组前期研究发现,含1,3,4-噻二唑和1,2,4-三唑等氮杂环的葡萄糖苷衍生物具有杀菌活性,其中部分化合物对马铃薯晚疫菌Phytophthora infestans的抑制活性与对照药剂烯酰吗啉的活性相当[18-19]。
为寻找具有更高杀菌活性的含氮杂环的糖苷衍生物,基于前期的工作基础,本研究拟用半乳糖苷结构替代葡萄糖苷,合成一系列新型含嘧啶环的半乳糖苷类衍生物 (合成路线见图式1),并初步测试了目标化合物对部分植物病原真菌及细菌的杀菌活性。
1 材料与方法
1.1 仪器与药剂
Bruker Avance III TM 400 和HD 600 MHz 核磁共振仪 (德国-瑞士布鲁克光谱公司);Agilent 6 540 UHD Q-TOF LC/MS 超高分辨质谱仪 (安捷伦科技有限公司);RE-52AA 旋转蒸发仪 (上海亚荣生化有限公司);B11-2 温度数显磁力搅拌器 (上海司乐仪器有限公司);X-6 型数字显微熔点测定仪 (北京泰克仪器有限公司);ZF-2 型三用紫外分析仪 (上海市安亭电子仪器厂)。
所有试剂均购自商业供应商,除特别注明外,未经进一步处理,直接使用。6-氨基-2-硫脲嘧啶、芳香酸和D-半乳糖 (天津希恩思生化科技有限公司);99%噻菌铜 (thiazolone) 原药 (浙江龙湾化工有限公司);50%烯酰吗啉(dimethomorph)可湿性粉剂 (河北依诺生化有限公司)。
1.2 供试植物病原菌
水稻白叶枯菌Xanthomonas oryzaepv.oryzae和柑橘溃疡病菌Xanthomonascitrisubsp.citri,由贵州大学精细化工研究中心提供;小麦赤霉病菌Gibberella zeae、马铃薯晚疫病菌Phytophthora infestans和水稻纹枯病菌Thanatephorus cucumeris,由湖北省农业科学院植保土肥研究所和贵阳学院食品与制药工程学院提供;葡萄座腔菌Botryosphaeria dothidea和拟茎点霉菌Phompsissp.,由贵阳学院食品与制药工程学院提供。
1.3 目标化合物的合成
1.3.1 化合物1 的合成 参照文献[20]方法,将D-半乳糖 (80.0 g,0.444 mol)、乙酸酐 (260 mL,2.55 mol)、800 mL 冰乙酸和1 mL 高氯酸加入3 000 mL 圆底烧瓶中,常温搅拌1.0 h 后,加入乙酰溴 (100 mL,1.326 mol) 和甲醇 (64 mL,1.596 mol),再搅拌2 h。将反应液倒入2 000 mL冰水中,用二氯甲烷萃取。有机相分别用饱和碳酸氢钠溶液和饱和氯化钠溶液洗涤,无水硫酸钠干燥,浓缩得到化合物1 的粗产品。由于该产品不稳定,无需进一步纯化。
1.3.2 化合物2 的合成 将6-氨基-2-硫脲嘧啶(82.2 g,0.2 mol)、碳酸钾 (41.4 g,0.3 mol)、1 000 mL 1,4-二氧六环和300 mL 水加入3 000 mL 圆底烧瓶中,常温搅拌1 h 后,加入200 mL 含化合物1(42.9 g,0.3 mol) 的1,4-二氧六环烷溶液,将温度升高至50 ℃反应,采用薄层层析 (TLC,V(乙酸乙酯) :V(石油醚) = 1 : 4) 监测至反应结束。浓缩反应液,用乙酸乙酯萃取,无水硫酸镁干燥,浓缩得到白色固体。经 (V(甲醇) :V(二氯甲烷) =4 : 1) 重结晶,得到化合物2。白色固体,产率75.0%,熔点135~137 ℃。1H NMR (600 MHz,DMSO-d6),δ: 6.57 (s, 2H), 5.83 (d,J= 10.6 Hz, 1H),5.38 (s, 1H), 5.31 - 5.04 (m, 3H), 4.25 (t,J= 6.2 Hz,1H), 4.08 - 3.98 (m, 2H), 2.14 (s, 3H), 2.01 (s, 3H),1.97 (s, 3H), 1.95 (s, 3H);13C NMR (150 MHz,DMSO-d6),δ: 170.43, 169.92, 169.70, 169.48,163.44, 152.93, 82.87, 75.07, 73.50, 70.62, 68.36,62.18, 20.94, 20.83, 20.75。
1.3.3 目标化合物4a~4m 的合成 将2.2 mmol 芳香酸和4 mL 二氯亚砜加入100 mL 三口瓶中,加热回流2 h 后将反应液充分旋干,用5 mL 二氯甲烷溶解后待用。将化合物2 (0.95 g,2.0 mmol)、三乙胺 (TEA,0.28 mL,2.0 mmol) 和20 mL 二氯甲烷加入100 mL 三口瓶中,加入上述制得的二氯甲烷溶液,常温下反应,采用TLC (V(乙酸乙酯) :V(石油醚) = 1 : 2) 监测至反应结束。将反应液倒入20 mL 水中,分出有机相,并依次用饱和碳酸氢钠溶液和饱和氯化钠溶液洗涤,无水硫酸钠干燥,浓缩得到粗产品。将该粗产品溶于5 mL 二氯甲烷中,加入适量石油醚使其产生沉淀,抽滤,所得固体用异丙醇重结晶,得到目标化合物 4a~4m。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(邻甲基苯甲酰基) 氨基嘧啶 (4a):白色固体,产率67.1%。熔点160~162 ℃。1H NMR (400 MHz, CDCl3),δ: 8.32 - 8.06 (m,1H), 7.50 (t,J= 6.9 Hz, 1H), 7.33 (t,J= 7.3 Hz, 2H), 6.11 (s,1H), 5.71 (d,J= 10.6 Hz, 1H), 5.46 (d,J= 3.1 Hz, 1H), 5.39(t,J= 10.2 Hz, 1H), 5.17 (dd,J= 9.9, 3.4 Hz, 1H), 5.10 (s,1H), 4.15 - 4.09 (m, 3H), 2.66 (s, 3H), 2.17 (s, 3H), 2.03 (s,3H), 1.99 (s, 6H);13C NMR (150 MHz, CDCl3),δ: 170.46,170.34, 170.06, 169.57, 168.81, 165.13, 165.11, 163.87,141.85, 133.36, 132.06, 131.54, 127.51, 126.07, 91.72, 82.57,74.67, 72.22, 67.45, 66.51, 61.38, 21.87, 20.72, 20.64, 20.60,20.56. HRMS: 计算值C26H29N3O11S ([M + H]+) 592.159 6, 实测值592.159 7。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(对甲基苯甲酰基) 氨基嘧啶 (4b):白色固体,产率75.1%,熔点159~161 ℃。1H NMR (400 MHz, CDCl3),δ: 8.42 - 7.94 (m,2H), 7.32 (d,J= 7.5 Hz, 2H), 6.13 (s, 1H), 5.71 (d,J= 10.7 Hz,1H), 5.33 (t,J= 9.2 Hz, 1H), 5.22 - 5.09 (m, 3H), 4.25 (dd,J=12.2, 4.1 Hz, 1H), 4.13 (d,J= 12.5 Hz, 1H), 3.86 - 3.84 (m,1H), 2.46 (s, 3H), 2.03 (d,J= 8.1 Hz, 12H);13C NMR (150 MHz,CDCl3),δ: 170.80, 170.20, 169.40, 168.61, 165.16, 165.10,163.55, 145.25, 130.51, 129.45, 125.89, 91.62, 82.10, 75.98,74.24, 69.11, 68.49, 62.04, 21.78, 20.67, 20.62, 20.59, 20.54.HRMS: 计算值C26H29N3O11S ([M + H]+) 592.159 6, 实测值592.159 9。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(邻甲氧基苯甲酰基) 氨基嘧啶 (4c):白色固体,产率68.7%,熔点168~170 ℃。1H NMR (400 MHz, CDCl3),δ: 8.02 (d,J= 9.5 Hz,1H), 7.65 - 7.52 (m, 1H), 7.05 (t,J= 8.3 Hz, 2H), 6.13 (s, 1H),5.71 (d,J= 10.6 Hz, 1H), 5.33 (t,J= 9.3 Hz, 1H), 5.22 - 5.09(m, 3H), 4.25 (dd,J= 12.4, 4.6 Hz, 1H), 4.13 (d,J= 14.5 Hz,1H), 3.94 (s, 3H), 3.87 - 3.83 (m, 1H), 2.04 (s, 3H), 2.02 (s,3H), 2.02 (s, 3H), 2.02 (s, 3H);13C NMR (150 MHz, CDCl3),δ: 170.85, 170.24, 169.42, 168.56, 165.13, 162.14, 160.42,135.15, 132.65, 120.35, 112.35, 91.64, 82.15, 76.02, 74.32,69.16, 68.54, 62.07, 56.08, 20.69, 20.66, 20.62, 20.58. HRMS:计算值C26H29N3O12S ([M + H]+) 608.154 5, 实测值608.154 3。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(间甲氧基苯甲酰基) 氨基嘧啶 (4d):白色固体,产率73.2%,熔点169~171 ℃。1H NMR (400 MHz, CDCl3),δ: 7.77 (d,J= 7.8 Hz,1H), 7.66 (s, 1H), 7.43 (t,J= 8.0 Hz, 1H), 7.20 (dd,J= 8.0,2.2 Hz, 1H), 6.11 (s, 1H), 5.71 (d,J= 10.6 Hz, 1H), 5.33 (t,J= 9.3 Hz, 1H), 5.23 - 5.11 (m, 3H), 4.25 (dd,J= 12.4, 4.6 Hz,1H), 4.13 (dd,J= 12.4, 2.3 Hz, 1H), 3.89 - 3.83 (m, 4H), 2.04(s, 3H), 2.03 (s, 3H), 2.02 (s, 3H), 2.02 (s, 3H);13C NMR(150 MHz, CDCl3),δ: 170.83, 170.25, 169.43, 168.77, 165.13,165.09, 163.39, 159.85, 129.93, 129.78, 122.92, 120.83,114.83, 91.65, 82.13, 76.02, 74.28, 69.13, 68.53, 62.09, 55.60,20.71, 20.66, 20.62, 20.58. HRMS: 计算值C26H29N3O12S([M + H]+) 608.154 5, 实测值608.154 6。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(对甲氧基苯甲酰基) 氨基嘧啶 (4e):白色固体,产率75.0%,熔点166~168 ℃。1H NMR (400 MHz, CDCl3),δ: 8.12 (d,J=8.8 Hz, 2H), 6.99 (d,J= 7.9 Hz, 2H), 6.13 (s, 1H), 5.72 (d,J=9.7 Hz, 1H), 5.33 (t,J= 9.9 Hz, 1H), 5.22 - 5.11 (m, 3H), 4.25(dd,J= 12.5, 4.2 Hz, 1H), 4.13 (d,J= 12.2 Hz, 1H), 3.90 -3.84 (m, 4H), 2.04 (s, 3H), 2.03 - 1.96 (m, 9H);13C NMR(150 MHz, CDCl3),δ: 170.49, 170.34, 170.05, 169.58, 168.78,165.21, 165.00, 163.44, 159.80, 129.90, 129.73, 122.88,120.77, 114.82, 91.64, 82.55, 74.66, 72.21, 67.47, 66.53,61.41, 55.55, 55.45, 20.70, 20.63, 20.60, 20.55; HRMS: 计算值C26H29N3O12S ([M + H]+) 608.154 5, 实测值608.154 5。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(邻氯苯甲酰基) 氨基嘧啶 (4f):白色固体,产率55.4%,熔点173~175 ℃。1H NMR (400 MHz, CDCl3),δ: 8.06 (d,J= 8.3 Hz,1H), 7.53 (d,J= 4.4 Hz, 2H), 7.48 - 7.34 (m, 1H), 6.13 (s,1H), 5.71 (d,J= 10.6 Hz, 1H), 5.33 (t,J= 9.3 Hz, 1H), 5.25 -5.11 (m, 3H), 4.26 (dd,J= 12.4, 4.6 Hz, 1H), 4.14 (dd,J=12.4, 2.4 Hz, 1H), 3.88 - 3.84 (m, 1H), 2.04 (s, 3H), 2.03 (s,3H), 2.02 (s, 3H), 2.02 (s, 3H);13C NMR (150 MHz, CDCl3),δ: 170.80, 170.20, 169.41, 168.75, 165.21, 164.67, 161.87,134.89, 133.82, 132.29, 131.54, 128.10, 126.88, 91.50, 82.10,76.01, 74.24, 69.08, 68.47, 62.04, 20.68, 20.63, 20.59, 20.55.HRMS: 计算值C25H26ClN3O11S ([M + H]+) 612.105 0, 实测值612.105 0。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(间氯苯甲酰基) 氨基嘧啶 (4g):白色固体,产率70.2%,熔点174~176 ℃。1H NMR (400 MHz, CDCl3),δ: 8.27 - 8.12 (m, 2H),7.19 (t,J= 8.6 Hz, 2H), 6.13 (s, 1H), 5.71 (d,J= 10.6 Hz,1H), 5.46 (d,J= 3.4 Hz, 1H), 5.38 (t,J= 10.2 Hz, 1H), 5.18(dd,J= 10.1, 6.7 Hz, 2H), 4.16 - 4.08 (m, 3H), 2.17 (s, 3H),2.03 (s, 3H), 2.00 (s, 3H), 2.00 (s, 3H);13C NMR (150 MHz,CDCl3),δ: 170.51, 170.35, 170.09, 169.58, 168.96, 165.18,164.84, 162.73, 140.93, 131.84, 129.16, 127.15, 91.53, 82.60,74.65, 72.23, 67.45, 66.54, 61.38, 20.74, 20.67, 20.59. HRMS:计算值C25H26ClN3O11S ([M + H]+) 612.105 0, 实测值612.105 0。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(对氯苯甲酰基) 氨基嘧啶 (4h):白色固体,产率65.8%,熔点170~172 ℃。1H NMR (400 MHz, CDCl3),δ: 8.12 (d,J= 8.8 Hz,2H), 7.50 (d,J= 8.8 Hz, 2H), 6.14 (s, 1H), 5.71 (d,J= 10.6 Hz,1H), 5.46 (d,J= 3.4 Hz, 1H), 5.42 - 5.34 (m, 1H), 5.19 - 5.13(m, 2H), 4.17 - 4.09 (m, 3H), 2.17 (s, 3H), 2.03 (s, 3H), 2.00(d,J= 3.6 Hz, 6H);13C NMR (150 MHz, CDCl3),δ: 170.51,170.35, 170.10, 169.58, 168.92, 165.18, 164.89, 162.57, 133.24,133.18, 116.12, 115.97, 91.57, 82.60, 74.66, 72.24, 67.46,66.55, 61.39, 20.74, 20.67, 20.66, 20.59. HRMS:计算值C25H26ClN3O11S ([M + H]+) 实测值612.105 0, 实测值612.105 0。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(邻溴苯甲酰基) 氨基嘧啶 (4i):白色固体,产率70.1%,熔点178~180 ℃。1H NMR (400 MHz, CDCl3),δ: 8.06 (d,J= 7.1 Hz,1H), 7.75 (d,J= 7.2 Hz, 1H), 7.51 - 7.36 (m, 2H), 6.16 (s,1H), 5.71 (d,J= 10.6 Hz, 1H), 5.46 (d,J= 3.3 Hz, 1H), 5.39(t,J= 10.2 Hz, 1H), 5.16 (dd,J= 9.4, 6.0 Hz, 2H), 4.15 - 4.09(m, 3H), 2.17 (s, 3H), 2.03 (s, 3H), 2.00 (s, 6H);13C NMR(150 MHz, CDCl3),δ: 170.48, 170.33, 170.05, 169.58, 168.90,165.19, 164.64, 162.42, 134.87, 133.79, 132.32, 130.03,127.46, 122.78, 91.53, 82.55, 74.68, 72.21, 67.45, 66.49,61.39, 20.72, 20.64, 20.56. HRMS: 计算值C25H26BrN3O11S([M + H]+) 656.054 4, 实测值656.054 5。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(间溴苯甲酰基) 氨基嘧啶 (4j):白色固体,产率65.3%,熔点179~180 ℃。1H NMR (400 MHz, CDCl3),δ: (s, 1H), 8.11 (d,J= 7.9 Hz, 1H), 7.79 (d,J= 9.8 Hz, 1H), 7.41 (t,J= 7.9 Hz,1H), 6.11 (s, 1H), 5.71 (d,J= 10.6 Hz, 1H), 5.46 (d,J=3.3 Hz, 1H), 5.38 (t,J= 10.2 Hz, 1H), 5.24 (s, 1H), 5.17 (dd,J= 9.9, 3.4 Hz, 1H), 4.16 - 4.08 (m, 3H), 2.17 (s, 3H), 2.03 (s,3H), 2.01 (s, 3H), 1.99 (s, 3H);13C NMR (150 MHz, CDCl3),δ: 170.48, 170.32, 170.05, 169.55, 168.97, 165.17, 164.74,162.23, 137.13, 133.32, 130.61, 130.27, 128.99, 122.78, 91.50,82.55, 74.65, 72.20, 67.43, 66.51, 61.38, 20.71, 20.64, 20.55.HRMS: 计算值C25H26BrN3O11S ([M + H]+) 656.054 4, 实测值656.054 5。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(对溴苯甲酰基) 氨基嘧啶 (4k):白色固体,产率78.5%,熔点178~180 ℃。1H NMR (400 MHz, CDCl3),δ: 8.03 (d,J= 8.5 Hz,2H), 7.67 (d,J= 8.6 Hz, 2H), 6.13 (s, 1H), 5.70 (d,J=12.0 Hz, 1H), 5.52 - 5.42 (m, 1H), 5.38 (t,J= 10.2 Hz, 1H),5.20 - 5.10 (m, 2H), 4.15 - 4.09 (m, 3H), 2.17 (s, 3H), 2.03 (s,3H), 2.00 (d,J= 3.5 Hz, 6H);13C NMR (150 MHz, CDCl3),δ:170.52, 170.35, 170.09, 169.58, 168.96, 165.18, 164.82,162.89, 132.17, 131.91, 129.65, 127.61, 91.53, 82.59, 74.65,72.22, 67.44, 66.54, 61.38, 61.32, 20.74, 20.67, 20.58.HRMS: 计算值C25H26BrN3O11S ([M + H]+) 656.054 4, 实测值656.054 6。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(邻硝基苯甲酰基) 氨基嘧啶 (4l):白色固体,产率69.4%,熔点190~192 ℃。1H NMR (400 MHz, CDCl3),δ: 8.07 (d,J= 9.1 Hz,1H), 7.91 (d,J= 7.5 Hz, 1H), 7.82 - 7.72 (m, 2H), 6.21 (s,1H), 5.73 (d,J= 10.6 Hz, 1H), 5.47 (d,J= 3.4 Hz, 1H), 5.38(t,J= 10.2 Hz, 1H), 5.18 (dd,J= 9.8, 3.5 Hz, 2H), 4.16 - 4.11(m, 3H), 2.17 (s, 3H), 2.03 (s, 3H), 2.00 (s, 3H), 1.99 (s, 3H);13C NMR (150 MHz, CDCl3),δ: 169.56, 169.37, 169.07,168.64, 167.97, 164.33, 163.17, 161.41, 146.84, 132.53,131.53, 129.20, 125.71, 123.30, 90.23, 81.53, 73.61, 71.24,66.50, 65.51, 60.39, 19.73, 19.66, 19.62, 19.58. HRMS: 计算值C25H26N4O13S ([M + H]+) 623.129 0, 实测值623.128 9。
2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-(间硝基苯甲酰基) 氨基嘧啶 (4m):白色固体,产率60.2%,熔点191~193 ℃。1H NMR (400 MHz, CDCl3),δ: 9.01 (s, 1H),8.52 (dt,J= 7.9, 2.1 Hz, 2H), 7.76 (t,J= 8.0 Hz, 1H), 6.14 (s,1H), 5.71 (d,J= 10.6 Hz, 1H), 5.45 (d,J= 3.3 Hz, 1H), 5.39(t,J= 10.2 Hz, 1H), 5.21 - 5.16 (m, 2H), 4.21 - 4.09 (m, 3H),2.17 (s, 3H), 2.04 (s, 3H), 2.01 (s, 3H), 2.00 (s, 3H);13C NMR(150 MHz, CDCl3),δ: 170.86, 170.22, 169.46, 168.70, 165.24,164.12, 162.25, 147.94, 133.47, 132.58, 130.24, 126.59,124.28, 91.31, 82.06, 75.93, 74.28, 69.10, 68.42, 62.02, 20.67,20.62, 20.59, 20.56. HRMS: 计算值C25H26N4O13S ([M + H]+)623.129 0, 实测值623.128 9。
1.4 杀菌活性测定
1.4.1 对植物真菌的活性 采用生长速率法[21]测定,药剂质量浓度为50 μg/mL。每个药剂3 次重复,以烯酰吗啉为对照药剂,以十字交叉法测定各处理菌落的直径。按公式 (1) 计算菌丝生长抑制率。
(1) 式中:I1为药剂对真菌的抑制率,%;Dc为空白对照直径,cm;Dt为处理直径,cm。
1.4.2 对植物细菌的活性 以噻菌铜为对照药剂,采用浑浊度法[22]测定。将目标化合物及对照药剂分别配制成200 及100 μg/mL 的药液。用酶标仪测定各浓度菌液的OD 值,每处理重复3 次。按公式 (2) 计算抑制率。
(2) 式中:I2为药剂对细菌的抑制率,%;T0为对照菌液OD值;T1为样品菌液OD 值。菌液OD 值=含菌培养基OD 值-无菌培养基OD 值。
2 结果与讨论
2.1 目标化合物的合成
以乙酸作溶剂,先由D-半乳糖与醋酸酐和乙酰溴反应,生成1-溴-2,3,4,6-四乙酰基半乳糖(1);然后,以K2CO3作缚酸剂,将化合物1 与6-氨基-2-硫脲嘧啶在1,4-二氧六环烷中加热回流,生成2-(2,3,4,6-四乙酰基半乳糖基硫基)-4-羟基-6-氨基嘧啶 (2);最后,在二氯甲烷作溶剂、三乙胺作缚酸剂条件下,化合物2 与芳酰氯反应生成13 个未见文献报道的含4-羟基嘧啶半乳糖苷衍生物 (4a~4m)。
2.2 目标化合物的图谱解析
所有目标化合物的结构均经过1H NMR、13C NMR 和HRMS 的确证。以化合物4e 为例,苯环上的质子是双重峰,其化学位移 (δ) 分别为8.12 和6.99;δ为6.13 的单峰是嘧啶环上OH 上的质子;吡喃环上6 个质子的δ为5.72~413;苯环上-OCH3上的质子是δ为3.90 的单峰;乙酰基上的质子δ为2.04~1.96。在13C NMR 谱图中,4 个乙酰基的羰基碳的δ分别为170.49、170.34、170.05 和169.58;吡喃环上的6 个碳的δ为91.64~55.55;4 个乙酰基甲基碳的δ分别为20.70、20.63、20.60 和20.55。
2.3 杀菌活性
2.3.1 对植物病原真菌的杀菌活性 测定结果(表1) 表明,目标化合物对5 种供试植物病原真菌均有一定的杀菌活性。在50 μg/mL 下,化合物4f、4h、4j、4k、4l 和4m 对小麦赤霉病菌的抑制率为61.5%~68.1%,化合物4f、4g、4h、4i、4j、4k、4l 和4m 对马铃薯晚疫病菌的抑制率为61.0%~69.1%,均略低于烯酰吗啉。
对化合物4k 和4m 进一步测定了其对马铃薯晚疫病菌的EC50值。结果 (表2) 表明,其EC50值分别为11.55 和8.67 μg/mL,其中化合物4m 的杀菌活性与对照药剂烯酰吗啉相当。

表2 化合物4k 和4m 对马铃薯晚疫病菌的EC50 值Table 2 The EC50 values of compounds 4k and 4m against P. infestans
初步构效关系分析结果看出,目标化合物对马铃薯晚疫病菌的抑制活性与苯环上R 的性质有关,当R 为Cl、Br 和NO2等吸电子基团时抑菌活性较高,而R 为Me 和OMe 等供电子基团时活性较低。
2.3.2 对植物病原细菌的杀菌活性 测定结果(表3) 表明,目标化合物对水稻白叶枯菌和柑橘溃疡病菌都有一定的杀菌活性。在200 μg/mL 时,化合物4f、4g、4h、4j、4l 和4m 对两种供试细菌的抑制率均大于60%。
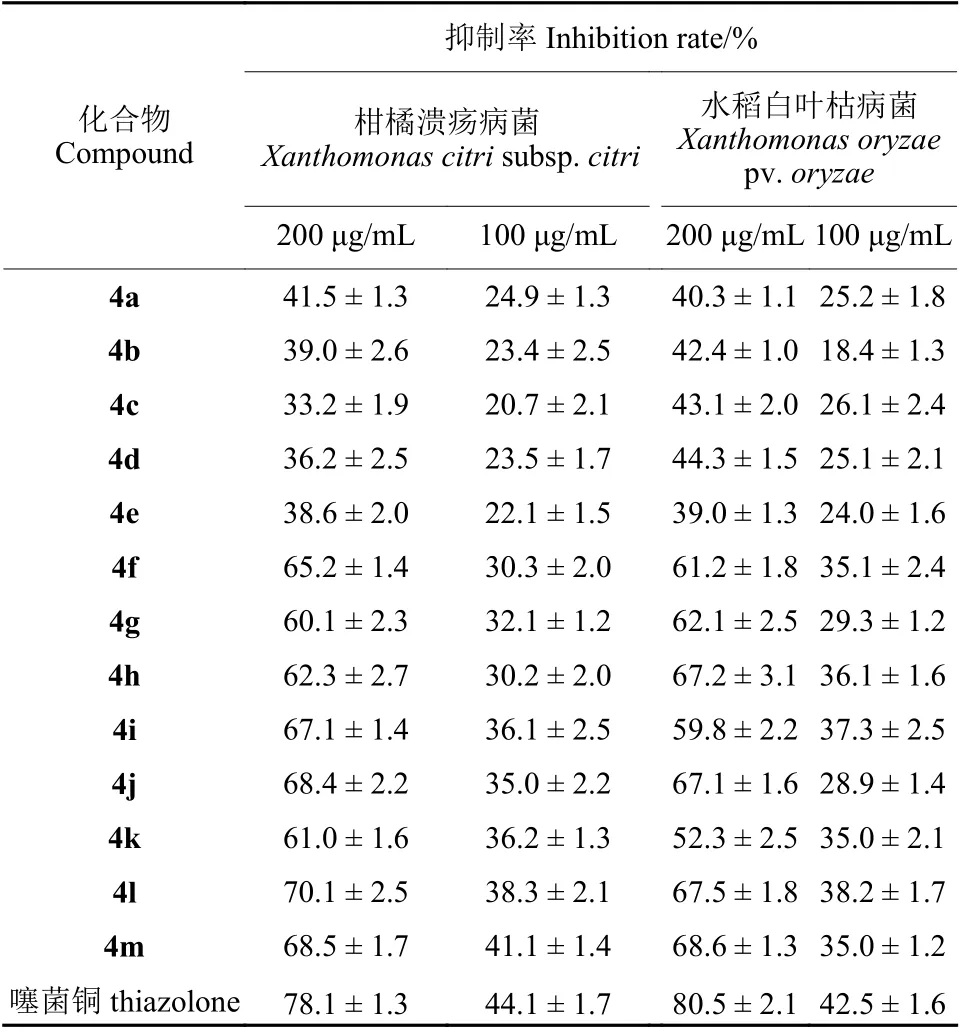
表3 目标化合物对两种植物细菌病原菌的抑制作用Table 3 Inhibition of target compounds against two pathogenic bacteria in vitro
3 结论
本研究合成了13 个未见文献报道的新型含嘧啶环的半乳糖苷类衍生物,所有化合物的结构均经过1H NMR、13C NMR 和HRMS 的确证。杀菌活性测试结果表明,该类化合物对植物病原真菌和细菌均表现出一定的杀菌活性,其中化合物4m 对马铃薯晚疫病菌具有较好的杀菌活性,有进一步研究的价值。

