黄连素对感染幽门螺杆菌小鼠胃黏膜上皮细胞损伤的影响
郭颖媛 冯强 杨运霞 马新生 郭明霞 杜丹丹 佘延芬

摘要 目的:探究黄连素对幽门螺杆菌感染小鼠胃黏膜上皮细胞损伤的保护作用。方法:选取25只雄性BALB/c小鼠,随机分为对照组,模型组,低剂量组,中剂量组,高剂量组,每组5只。其中对照组小鼠按0.2 mL/只灌胃生理盐水和布氏肉汤,其他4组均以0.2 mL/只灌胃幽门螺杆菌NCTC11637菌液构建幽门螺杆菌感染模型。低剂量组,中剂量组,高剂量组在建模后分别灌服25 mg/kg、50 mg/kg和100 mg/kg黄连素,1次/d,连续2周。对照组、模型组灌服5 mL/kg 0.5%羧甲基纤维素钠;用CCK-8法评估小鼠胃黏膜上皮细胞活力;ELISA法检测细胞上清IL-1β、IL-8、IL-4、IL-10的水平;流式细胞仪分析细胞凋亡率,免疫印迹法检测细胞中Bax和Cl-caspase-3的表达。结果:与对照组比较,模型组的细胞活力显著下降(P<0.05),而IL-1β、IL-8、IL-4、IL-10水平、细胞凋亡率以及Bax和Cl-caspase-3的表达均显著增加(P<0.05);与模型组比较,低、中、高剂量组的细胞活力明显增加(P<0.05),而IL-1β、IL-8、IL-4、IL-10水平、细胞凋亡率以及Bax和Cl-caspase-3的表达均显著降低(P<0.05)。结论:黄连素可减轻幽门螺杆菌感染对小鼠胃黏膜上皮细胞的炎性损伤。
关键词 黄连素;幽门螺杆菌;炎症介质;细胞凋亡;白細胞介素-1β;白细胞介素-8;胃黏膜;细胞活力
Abstract Objective:To explore the protective effects of berberine on the injury of gastric mucosal epithelial cells in mice model with helicobacter pylori.Methods:25 male BALB/c mice were selected and randomly divided into the control group,model group,low-dose experimental group,medium-dose experimental group and high-dose experimental group,with 5 in each group.The mice in the control group were given 0.2 mL/each with normal saline and brucella broth.The other four groups were all given 0.2 mL/each helicobacter pylori NCTC11637 bacterial solution to construct the helicobacter pylori infection model.After successful modeling,the low-dose experimental group,the middle-dose experimental group,and the high-dose experimental group were given 25 mg/kg,50 mg/kg and 100 mg/kg berberine,respectively.1 time per day for 2 consecutive weeks.The control group and model group were given sodium carboxymethyl cellulose solution at the dose of 5 mL/kg by gavage respectively.Mouse gastric mucosal epithelial cells viability was assessed using CCK-8.The levels of IL-1β,IL-8,IL-4,IL-10 in cell supernatant were detected by enzyme-linked immunoassay(ELISA).Cell apoptosis were analyzed by flow cytometry.The expression of Bax and Cl-caspase-3 in the cells was detected by western blotting.Results:Compared with the control group,cell viability decreased significantly in the model group(P<0.05),while the contents of IL-1β,IL-8,IL-4,IL-10,apoptosis rate and expression of Bax and Cl-caspase-3 were significantly increased(P<0.05).Compared with the model group,cell viability was significantly increased in low,medium and high dose groups(P<0.05),while the contents of IL-1β,IL-8,IL-4,IL-10,apoptosis rate and expression of Bax and Cl-caspase-3 were significantly decreased(P<0.05).Conclusion:Berberine can reduce the inflammatory damage of helicobacter pylori infection on gastric mucosal epithelial cells in mice.
Keywords Berberine; Helicobacter pylori; Inflammatory factors; Apoptosis; Interleukin 1β; Interleukin 8; Gastric mucosal; Cell vitality
中图分类号:R284;R392.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.18.008
幽门螺旋杆菌是一种公认的病原体,世界上多达一半的人慢性感染幽门螺旋杆菌[1],幽门螺旋杆菌是导致消化性溃疡和慢性胃炎发生的重要原因,也是十二指溃疡发生的启动因子[2]。黄连素,又名小檗碱,属异喹啉类生物碱,是植物黄连的根状茎中提取的主要有效成分[3]。临床上黄连素被用来治疗消化性溃疡、胃炎和消化性或感染性腹泻等疾病[4]。最新研究表明,黄连素具有良好的抗菌、抗炎等作用[5]。有研究报道黄连素在多种疾病中均具有显著的疗效,例如宋菊敏等[6]在研究中发现黄连素可明显降低糖尿病大鼠高胰岛素血症,改善脂类代谢障碍,同时黄连素还具有抗氧化作用。既往研究发现,黄连素对同为革兰阴性杆菌的结核双歧杆菌有较好的抑制作用[7]。然而关于黄连素对幽门螺杆菌作用机制的相关研究还未见报道。本研究将通过构建幽门螺杆菌感染小鼠模型,并分离小鼠胃黏膜上皮细胞,探讨黄连素对幽门螺杆菌感染小鼠胃黏膜上皮细胞的活力,炎症介质水平以及细胞凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 动物 选取25只健康雄性BALB/c小鼠,6~8周龄,体质量为17~20 g,购自华北制药股份有限公司。动物生产许可证号:SCXK(冀)2019-004。温度20~26 ℃,相对湿度40%~70%,明暗交替时间12 h/12 h。4只小鼠饲养于一个灭菌鼠笼,实验期间自由饮水及采食,动物饲喂高压灭菌全价颗粒饲料,饮用高压灭菌酸化水。每周二、五称取体质量,并记录数据。本研究经邯郸市中心医院伦理委员会批准(伦理审批号:201805003)。
1.1.2 菌株 幽门螺杆菌菌株NCTC 11637,购自北京北纳创联生物技术研究院。将幽门螺杆菌菌株NCTC11637置于厌氧罐中,在85% N2、10% CO2、5% O2,37 ℃的环境下培养48 h,用生理盐水制成细菌悬液备用[8]。
1.1.3 药物 黄连素(上海懋康生物科技有限公司,生产批号:YC49927471),HPLC(高效液相色谱法)测定含量≥98%。
1.1.4 试剂与仪器 胎牛血清(Gibco公司,美国,货号:1921005PJ);DMEM培养基(Gibco公司,美国,货号:A4192101);细胞计数试剂盒-8(CCK-8)(Dojindo公司,日本,货号:CK04);IL-1β ELISA试剂盒(上海碧云天生物公司,货号:PI305);IL-8 ELISA试剂盒(上海碧云天生物公司,货号:PI640);Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物公司,货号:C1062M);甲醛游离组织固定剂(上海西格玛奥德里奇贸易有限公司,货号:A5472-1GAL);切片石蜡(北京谨明生物科技有限公司,货号:P10071-1kg);兔抗Bax多克隆抗体(Abcam公司,美国,货号:ab32503);兔抗Cl-caspase-3多克隆抗体(Abcam公司,美国,货号:ab2302);兔抗β-actin多克隆抗体(Abcam公司,美国,货号:ab8227);山羊抗兔IgG二抗(Abcam公司,美国,货号:ab150077)。多功能酶標仪(TECAN公司,瑞士,型号:Spark);流式细胞仪(BD公司,美国,型号:FACSCalibur)。
1.2 方法
1.2.1 分组与模型制备 将小鼠禁食12 h后,先用5%碳酸氢钠溶液以0.2 mL/只灌胃,30 min后,幽门螺旋杆菌小鼠模型用幽门螺杆菌菌液按照0.2 mL/只灌胃,连续3次,每次间隔48 h的方法进行构建;空白对照组小鼠模型用0.2 mL/只生理盐水和布氏肉汤灌胃,连续3次,每次间隔48 h的方法处理。末次干预后处死幽门螺旋杆菌感染小鼠,取胃窦组织,进行快速尿素酶试验和镜检,以快速尿素酶试剂检测结果为阳性且胃黏膜出现慢性炎症病理学改变为造模成功[9]。将25只小鼠随机分为对照组,模型组,低剂量组,中剂量组,高剂量组,每组5只。
1.2.2 给药方法 将黄连素与0.5%羧甲基纤维素钠配制成25 mg/mL、50 mg/mL和100 mg/mL黄连素混悬液,现配现用[10]。对照组、模型组按5 mL/kg灌服0.5%羧甲基纤维素钠;低剂量观察组,中剂量观察组,高剂量观察组按5 mL/kg灌服25 mg/mL、50 mg/mL和100 mg/mL黄连素混悬液,1次/d,连续2周,随后按照参考文献[11]方法,从各组小鼠胃黏膜中分离制取胃黏膜上皮细胞,用于后续实验。
1.2.4 检测指标与方法
1.2.4.1 苏木精-伊红(HE)染色检测各组小鼠胃黏膜组织病理 对各组小鼠进行安乐死处理,取胃组织,用含有甲醛(10%)溶液进行固定,然后分别用从低浓度到高浓度的乙醇进行脱水,将组织置于二甲苯中透明,再将已经透明过的组织放入石蜡中,待石蜡完全把组织包埋后进行冷却。之后将包埋后的石蜡块进行切片,然后使用HE染色法进行染色,并在光镜下观察[13]。
1.2.4.2 用CCK-8法检测细胞成活率 取1.2.2分离的各组小鼠胃黏膜上皮细胞,使用胰蛋白酶消化制成2×105个/mL的细胞悬液。以每孔100 μL细胞悬液接种于96孔板。向每孔加入10 μL的CCK-8试剂,并设置只含培养基和CCK-8试剂的空白孔。将培养板37 ℃孵育90 min后,用多功能酶标仪在450 nm波长下读取吸光度(A)值[14]。计算细胞成活率:细胞成活率(%)=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)×100%。
1.2.4.3 用酶联免疫吸附试验法(ELISA)检测细胞炎症介质的水平 取1.2.2分离的各组小鼠胃黏膜上皮细胞。按照操作说明书,分别使用IL-1β和IL-8 ELISA试剂盒检测各组细胞上清液IL-1β和IL-8的水平[15]。
1.2.4.4 用流式细胞术测定细胞凋亡 取1.2.2分离的各组小鼠胃黏膜上皮细胞,用胰蛋白酶消化并用4 ℃磷酸盐缓冲液重悬细胞,加入100 μL Annexin V-FITC结合缓冲液重悬细胞。加入5 μL AnnexinV-FITC,37 ℃下避光孵育15 min后,再加入5 μL碘化丙啶(PI)作用5 min后,上机检测各组细胞的凋亡[16]。
1.2.4.5 用蛋白免疫印迹法(Western Blotting)检测Bax和Cl-caspase-3蛋白表达水平 取1.2.2分离的各组小鼠胃黏膜上皮细胞,按照每106个细胞加入20 μL的RIPA裂解液,30 min后,按照文献[12]的离心速度离心后,使用BCA法检测蛋白水平,然后进行凝胶电泳分离蛋白,进行转膜,转膜后用5%的脱脂牛奶进行室温封闭,之后加入Bax(1∶500)、Cl-caspase-3(1∶1 000)和β-actin一抗(1∶500)进行孵育,4 ℃孵育过夜,加入二抗(1∶2 000)室温孵育,之后加入显色液进行检测[15]。
1.3 统计学方法 采用SPSS 25.0统计软件对数据进行分析。计量资料用均数±标准差(±s)表示,多组间差异比较用单因素方差分析,使用LSD-t进行两两比较,以P<0.05为差异有统计学意义。
2 结果
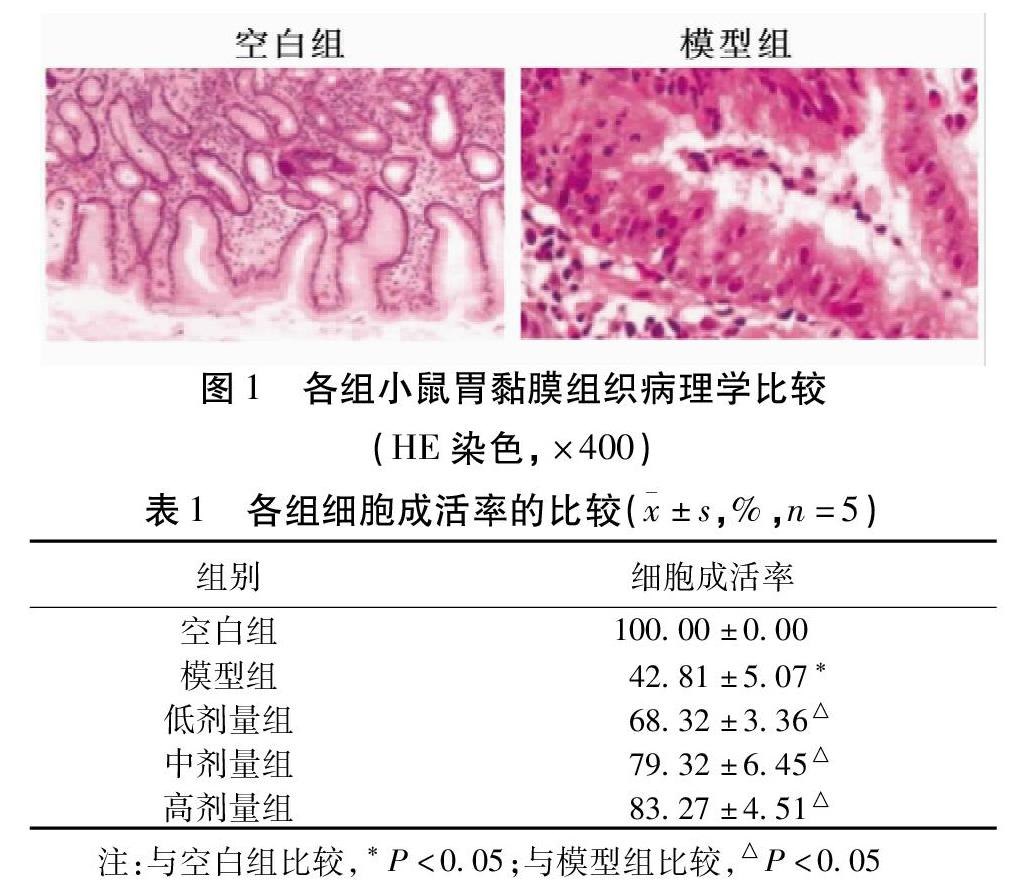
2.1 黄连素对幽门螺杆菌感染小鼠组织病理学的影响 空白组的胃黏膜上皮组织结构较为完整,腺体排列整齐。与空白组比较,模型组的小鼠胃黏膜上皮组织破坏,镜下可见上皮细胞坏死、脱落。见图1。
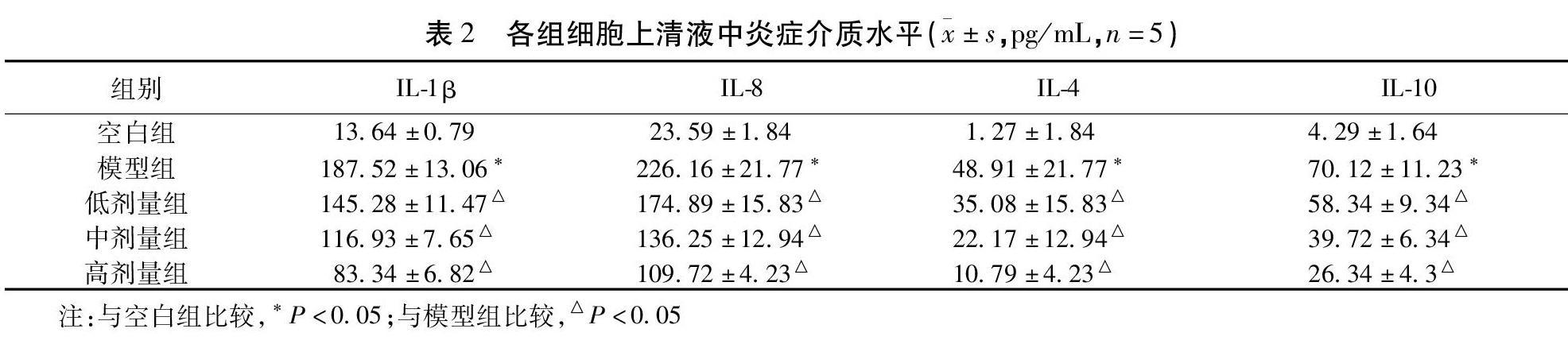
2.2 黄连素对幽门螺杆菌感染的小鼠胃黏膜上皮细胞活力的影响 模型组与空白组比较,低、中、高剂量观察组与模型组比较,差异均有统计学意义(均P<0.05)。见表1。
2.3 黄连素对幽门螺杆菌感染的小鼠胃黏膜上皮细胞上清液中炎症介质水平的影响 与空白组比较,模型组上清液中IL-1β,IL-8,IL-4,IL-10的水平均显著升高(P<0.05);与模型组比较,低、中、高剂量组上清液中IL-1β和IL-8,IL-4,IL-10的水平均显著降低(P<0.05)。见表2。
2.4 黄连素对幽门螺杆菌感染的小鼠胃黏膜上皮细胞凋亡的影响 与对照组比较,模型组细胞凋亡率、Bax和Cl-caspase-3蛋白表达水平均显著增加(P<0.05);与模型组比较,低、中、高剂量观察组细胞的凋亡率、Bax和Cl-caspase-3蛋白表达水平显著降低(均P<0.05)。见表3,图2~3。
3 讨论
幽门螺旋杆菌感染能使胃和十二指肠产生炎症,使感染宿主产生免疫反应,使胃黏膜细胞变性、坏死、炎症细胞浸润[17]。目前,临床上治疗幽门螺旋杆菌的方法多采用类似阿莫西林和克拉霉素等抗生素以及质子泵抑制剂,然而对幽门螺杆菌的疗效却不理想,因此寻找新的治疗幽门螺旋杆菌的药物十分重要。黄连素又称小檗碱,是中药黄连的主要有效成分[18],黄连素的药理作用已得到证实[19]。研究发现黄连素在治疗幽门螺旋杆菌感染的消化性溃疡有显著的疗效[20]。田华等[21]研究发现黄连素可通过调控ROS/ERK1/2信号通路使胃黏膜免受幽门螺旋杆菌感染帶来的损伤。本研究发现,幽门螺旋杆菌可抑制促进胃黏膜上皮细胞的活性,但黄连素可提高幽门螺旋杆菌对胃黏膜上皮细胞活力的抑制,表明黄连素可通过促进胃黏膜上皮细胞成活率的途径改善幽门螺旋杆菌对胃黏膜上皮细胞的损伤,这与田华等[21]的研究结果相似。
IL-1β是主要由内皮细胞或单核细胞生成的一种白细胞介素1的亚型,IL-1β在机体免疫应答中扮演着重要的角色。研究发现IL-8,IL-4,IL-10也参与调控机体的炎症反应[22-23]。郭辉等[24]在研究中发现,幽门螺旋杆菌感染后,胃癌患血清中IL-1β和IL-8的表达显著增加,且刘东亚等[25]也通过实验证实了IL-1β在幽门螺旋杆菌感染的胃黏膜组织中显著高表达。在本研究中发现,幽门螺旋杆菌感染后,小鼠胃黏膜上皮细胞中IL-1β,IL-8,IL-4,IL-10的表达显著升高,这与刘学仁[23]和郭辉等[24]的研究结果一致。研究发现黄连素具有一定的抗炎功效[5],本研究对幽门螺旋杆菌感染的胃黏膜上皮细胞给予不同浓度的黄连素处理,结果发现黄连素可显著抑制幽门螺旋杆菌感染的胃黏膜上皮细胞中IL-1β,IL-8,IL-4,IL-10的表达,表明黄连素可抑制幽门螺旋杆菌感染导致的炎症反应。
胃黏膜上皮细胞凋亡是消化系统疾病发生和发展的重要途径[26],本研究通过对胃黏膜上皮细胞凋亡情况的检测,结果发现幽门螺旋杆菌可显著促进胃黏膜上皮细胞凋亡,而黄连素可显著逆转幽门螺旋杆菌对胃黏膜上皮细胞凋亡的影响,提示黄连素可通过抑制胃黏膜上皮细胞凋亡的途径改善幽门螺旋杆菌感染的损伤。
综上所述,本研究发现黄连素可通过促进胃黏膜上皮细胞成活率,抑制胃黏膜上皮细胞凋亡和炎症反应的途径减轻幽门螺旋杆菌对胃黏膜上皮细胞的损伤,本研究为临床治疗幽门螺旋杆菌提供了可参考的理论依据。
参考文献
[1]Fock KM,Ang TL.Epidemiology of Helicobacter pylori infection and gastric cancer in Asia[J].J Gastroenterol Hepatol,2010,25(3):479-486.
[2]罗雄,夏于新,杨国亮,等.幽门螺杆菌及血清胃泌素与十二指肠溃疡的关系[J].中国医药,2009,4(1):44-45.
[3]崔连泉.浅谈黄连素临床新用途[J].中草药,2006,37(8):附8-附9.
[4]和纶.中西医结合治疗胃炎及胃十二指肠溃疡的临床研究[J].世界最新医学信息文摘(连续型电子期刊),2019,19(68):202-203.
[5]杨萍.黄连素临床应用及研究的新进展[J].天津药学,2011,23(3):69-72.
[6]宋菊敏,毛良,施建玲,等.黄连素对非胰岛素依赖性糖尿病大鼠的抗氧化作用[J].中草药,1992,23(11):590-591.
[7]匡铁吉,董梅,宋萍,等.黄连素对结核分枝杆菌的体外抑菌作用[J].中国中药杂志,2001,26(12):867-868.
[8]陆为民,沈洪,吴静,等.益气清热方对Ⅰ型幽门螺杆菌感染裸鼠胃黏膜组织病理学的影响[J].中医杂志,2009,50(7):646-648.
[9]于靖,叶晖,李宁,等.清热化湿方对幽门螺杆菌感染小鼠的抗菌和抗炎作用[J].中成药,2017,39(1):7-14.
[10]黄倩,林佩璜,王梅爱,等.黄连素对糖尿病肾病大鼠晚期糖基化终末产物及其受体信号传导通路的影响[J].中国临床药理学杂志,2020,36(6):632-635.
[11]王海滨,郝素珍,刘蕾,等.幽门螺杆菌对Balb/c小鼠胃粘膜上皮细胞表达环氧合酶-2的影响[J].热带医学杂志,2007,7(5):415-417,封四.
[12]林娇芬,黄家福,林志超,等.杏鲍菇β-葡聚糖促人胃粘膜上皮细胞增殖和迁移效果研究[J].热带作物学报,2013,34(11):2301-2306.
[13]母健菲,赵欣,龙兴瑶,等.小叶苦丁茶多酚提取物对盐酸/乙醇诱导小鼠胃损伤的预防效果[J].食品工业科技,2019,40(15):276-283,291.
[14]李萌,马致洁,章从恩,等.西红花对皮质酮诱导的PC12细胞损伤的保护作用研究[J].世界中医药,2019,14(4):833-838.
[15]王勇,孙朝峰,胡钱红.NF-κB p65对肺炎链球菌诱导的肺泡上皮细胞凋亡及炎性因子表达的影响[J].实用预防医学,2018,25(5):547-550,556.
[16]司熙,孔晨飞,王晓峰.盐酸小檗碱对人腺样囊性癌ACC2细胞增殖及周期的影响[J].中国老年学杂志,2018,38(13):3196-3198.
[17]王剑,王吉耀,沈锡中,等.幽门螺杆菌感染Balb/c小鼠模型的建立及对N-甲基-N-亚硝基脲诱发胃癌的影响[J].中华消化杂志,2005,25(3):146-149.
[18]邓晓威,谢宁.黄连素治疗2型糖尿病研究进展[J].中国中药杂志,2014,39(8):1374-1378.
[19]赵颖,杨园园,杜雅薇,等.黄连素治疗血脂异常有效性和安全性随机对照临床试验的系统评价与Meta分析[J].中国中药杂志,2020,45(3):664-673.
[20]周江敏.黄连素配合抗菌三联疗法治疗2型糖尿病合并幽门螺旋杆菌感染消化性溃疡疗效分析[J].中外女性健康研究,2020(7):41,105.
[21]田华,闫平慧,张锋利.黄连素通过ROS/ERK1/2通路抗幽门螺旋杆菌相关性胃炎的实验研究[J].中医药通报,2017,16(6):66-69.
[22]赵东.益生菌对感染幽门螺杆菌的C57BL/6小鼠胃黏膜IL-4、IL-8、IL-10和IFN-γ的调节效应[D].南京:南京大学,2012.
[23]刘学仁.引流管连接负压瓶引流法辅助治疗对乳腺癌术后皮瓣下积液伴感染患者的影响[J].中国民间疗法,2019,27(20):66-69.
[24]郭辉,程广坤,张晓雪,等.幽门螺旋杆菌感染与胃癌患者血清IL-1β、IL-8、IL-32的关系[J].海南医学,2020,31(18):2326-2329.
[25]刘东亚.胃黏膜中IL-1、IL-6、IL-8的表达水平与幽门螺旋杆菌感染及其伴发胃息肉的关系[D].开封:河南大学,2019.
[26]陈畅,隋璐,赵春莹.复方芪藻汤调控Foxo3a/Bim抑制胃溃疡大鼠胃黏膜上皮細胞凋亡及其机制[J].西安交通大学学报:医学版,2020,41(1):145-149.
(2021-07-06收稿 责任编辑:杨觉雄)

