华东地区6株不同年份的H9N2亚型禽流感病毒的遗传进化分析
裴宇茹,王晓泉,2,刘晓文,2,胡顺林,2,顾 敏,2,胡 娇,2,刘秀梵,2
(1.扬州大学兽医学院 农业农村部畜禽传染病学重点开放实验室,扬州 225009;2.江苏省重点动物传染病和人畜共患病预防控制联合创新中心,扬州 225009)
1966年,H9N2亚型禽流感病毒(Avian influenza virus,AIV)首次从美国威斯康辛州的火鸡中分离出来[1]。在随后的几十年里,该病毒在世界范围内广泛传播,常与其他病原体共感染,导致产蛋量下降和死亡,给家禽业带来巨大的经济损失。1992年,在中国大陆的鸡群中首次分离到H9N2亚型禽流感病毒,由于H9N2病毒对家禽为低致病性,在各类动物疾病防控中处于较低级别,导致该病毒迅速在中国大陆多个不同地区广泛传播,成为鸡、鸭、鹌鹑等禽类中最流行的禽流感病毒亚型[2]。已有文献表明,宿主屏障在很大程度上限制了病毒在不同物种之间的传播,但当这些屏障被突破时,流感病毒可能会发生跨物种传播,并造成严重后果,特别是在病毒从禽类宿主向哺乳动物适应性进化的过程[3]。此外,H9N2 AIV可以与哺乳动物唾液酸受体结合。2013-2018年,出现了多个H9N2实验室确诊病例[4]。最近的研究报道,H9N2病毒为中国南方新出现的H7N9病毒和在中国江西省造成3人感染的H10N8病毒贡献了6个内部基因[5-6],这表明H9N2病毒给公共卫生安全带来严重威胁。本研究对我国华东地区2011-2019年分离的6株H9N2 AIV进行了全基因组测序,通过分析遗传进化、受体结合特性和宿主适应相关的关键分子标记,探究近10年H9N2亚型AIV的遗传进化特点及跨种感染的风险。
1 材料与方法
1.1 试验毒株与材料 H9N2亚型禽流感毒株A/Chicken/Jiangsu/SQ68/2011(H9N2)(简称SQ68/11)、A/Chicken/Jiangsu/TM118/2014(H9N2)(简称TM118/14)、A/Chicken/Anhui/AH320/2016(H9N2)(简称AH320/16)、A/Chicken/Anhui/AH463/2017(H9N2)(简称AH463/17)、A/Chicken/Fujian/FJ1802/2018(H9N2)(简称FJ1802/18)、A/Chicken/Anhui/NG1901/2019(H9N2)(简称NG1901/19)由扬州大学农业部畜禽传染病重点开放实验室分离并保存。无特定病原体(specific pathogen free,SPF)鸡胚购自北京梅里亚维通实验动物技术有限公司。
样品处理液为含有抗生素的pH7.0~7.4的磷酸盐缓冲液(phosphate buffer,PBS);各AIV HA亚型抗血清及新城疫病毒阳性血清、1%鸡红细胞均由扬州大学农业部畜禽传染病重点开放实验室制备并提供;EasyPure Viral DNA/RNA Kit RNA提取试剂盒、DNA聚合酶购自北京全式金生物技术有限公司;AMV反转录酶及反转录体系其他成分、DNA marker购自购自宝生物工程(大连)有限公司;DNA Gel Extraction Kit胶回收试剂盒购自Axygen公司;各亚型AIV通用反转录12 bp随机引物5'-AGCAAAAGCAGG-3'、普通PCR引物合成和基因测序均由南京金斯瑞生物科技有限公司完成。
1.2 病毒RNA的提取与反转录 根据RNA提取试剂盒及提供的说明书提取分离病毒RNA,根据相应说明书配制反转录反应体系进行反转录,获得cDNA。
1.2.1 引物设计 分析近年来GenBank收录的的H9N2 AIV 基因序列,运用Primer Premier5.0软件设计特异性引物(表1)。
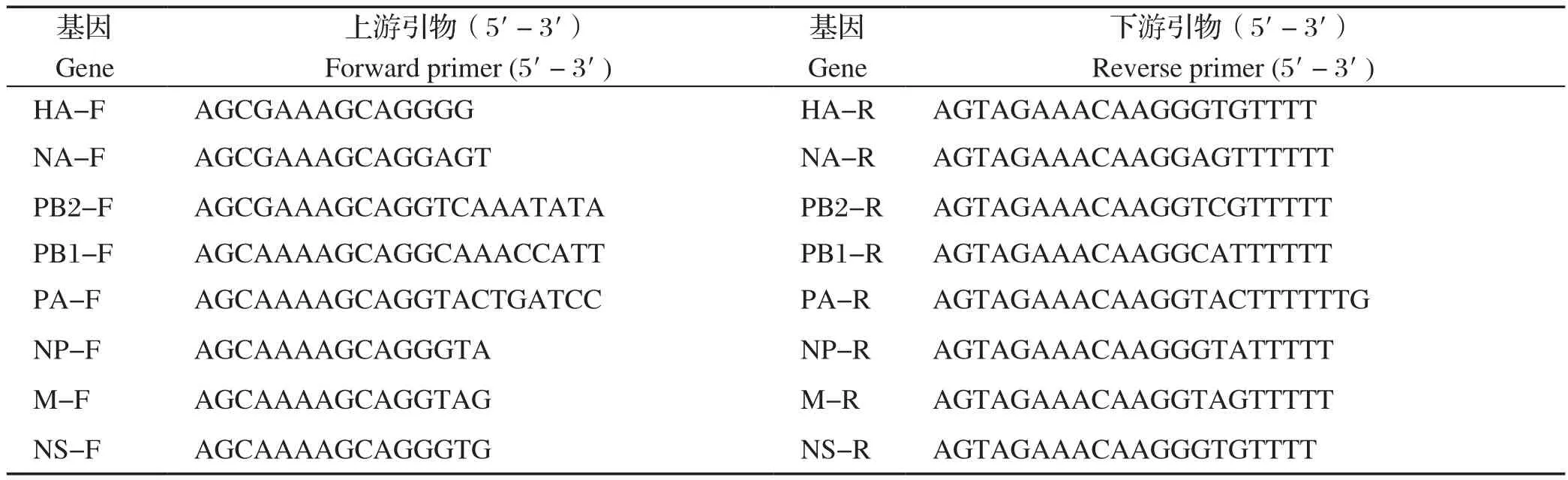
表1 RT-PCR 扩增 H9N2 禽流感病毒基因片段的引物序列Table 1 RT-PCR primer sequences for amplifying genome of H9N2 Avian in fluenza virus
1.2.2 RT-PCR及电泳检测 根据每对引物的Tm值,选择相应PCR反应的退火温度,设计反应程序。经1%琼脂凝胶电泳检测,切取目的条带,根据胶回收试剂盒做胶回收,将胶回收产物送测序公司进行序列测定。
1.2.3 处理分析序列 利用NCBI数据库和DNAStar、DNAMAN等软件编辑处理测序公司反馈的序列,将基因序列保存为成FAS文件格式。从GISAID数据库下载H9N2 AIV标准参考株, 运用MEGA6.0进行序列比对和构建系统发生树。
2 结果
2.1 HA基因序列分析
2.1.1 HA基因遗传进化分析 对6株H9N2 AIV分离株进行遗传进化分析表明,毒株HA基因开放阅读框(open reading frame,ORF)基因全长1683 bp,无核苷酸插入或缺失,编码560个氨基酸。6个毒株之间核苷酸同源性为90.1%~97.2%,氨基酸同源性为90.9%~98%,其中年份差距最远的两株分离株SQ68/11与NG1901/19核苷酸和氨基酸同源性最低,说明毒株随时间演化存在遗传差异。HA基因的同源性在8个片段中最低,说明HA基因的遗传进化最为显著。系统发生树显示,虽然2009年以来大部分H9分离株HA基因共同起源Y280/97,但是不同年代的毒株存在一定的遗传距离,2009-2012年毒株单独一个分支,2014年后的毒株分布在3个Group[7],近5年分离株主要分布于Group 3,还有部分毒株分布于Group 2,具体见图1。
2.1.2 HA关键氨基酸位点分析 HA的序列分析显示,其中5株分离毒株的裂解位点的氨基酸序列为PSRSSR↓GLF,1株(A/Chicken/Anhui/AH463/2017(H9N2))为PSRSNR↓GLF,均符合低致病性AIV的特征。HA的受体结合位点分析如表2所示(保守的受体结合位点不单独列出),受体结合位点右侧臂有3种氨基酸组成形式:GTSKA、GTSSA、GTSTA;受体结合位点左侧臂除SQ68/11外,剩余5株均为NGLMGR。
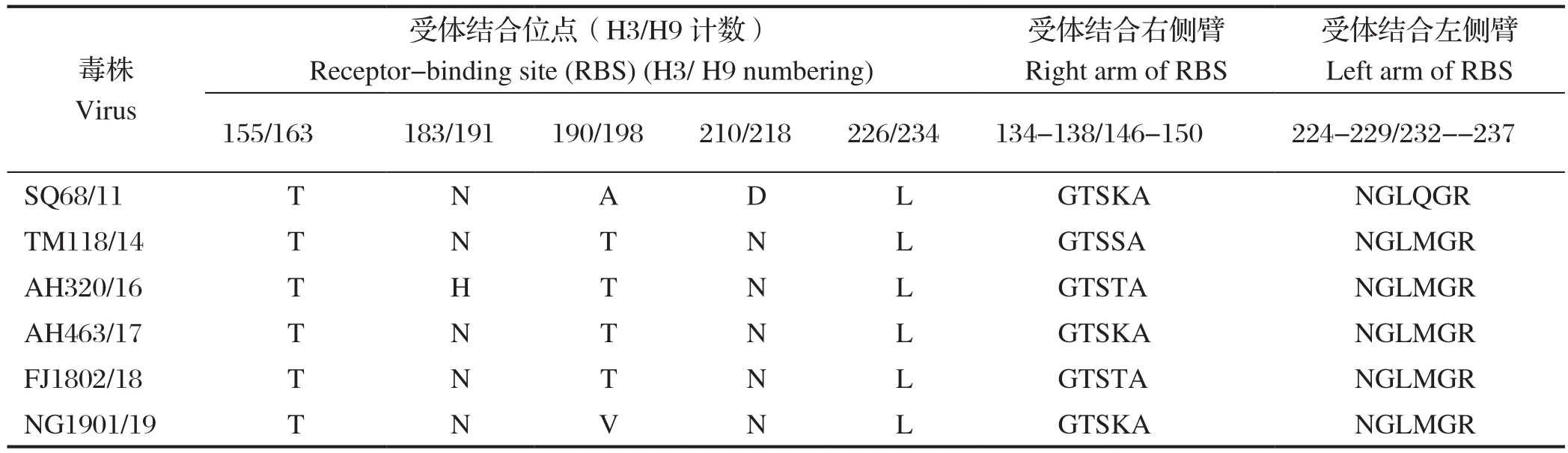
表2 6株H9N2分离毒株HA基因的氨基酸位点分析Table 2 Amino acid site of HA of six H9N2 isolates
6株病毒在重要的受体结合位点处,均出现了Q226L的变化,在第155位氨基酸均为T[8](全文均采用H3计数方法),除AH320/16外的5株病毒第183位受体结合位点为N[9],除SQ68/11外5株病毒发生A190T/V的变化,这些均可以增强H9N2病毒对人源受体的亲和力[10],说明6株H9N2禽流感病毒在遗传进化过程中已具有优先与人源受体结合的能力。5株病毒(除SQ68/11外)发生了D210N的突变,可改变H9N2 AIV的抗原性,降低HA蛋白的酸稳定性和热稳定性,同时促进H9N2病毒的复制[11]。
AIV HA蛋白的潜在糖基化位点的改变可能会影响宿主免疫反应[12-13],从而导致病毒毒力的改变和免疫逃逸现象。本研究的6株病毒含有7个潜在的糖基化位点,分别是21NST、128NVS、289NTT、296NVS、304NCS、483NGT、541NGS。其中早期毒株SQ68/11在210NRT、304位均存在潜在糖基化位点,即8个潜在糖基化位点。但剩余5株分离毒的HA蛋白T212I的突变导致210位潜在糖基化位点的缺失,均在304位新增潜在的糖基化位点,符合H9N2 AIV变异的新特征[14]。
2.2 NA基因序列分析 6株H9N2 AIV分离毒NA基因的ORF全长为1401 bp,编码466个氨基酸,核苷酸同源性为90.7%~98.3%,氨基酸同源性为87.8%~98%,其中SQ68/11与NG1901/19核苷酸和氨基酸同源性最低。系统发生树显示(图1),分离株与参考株Y280/97距离较近,均划为Y280-Like。其中6株分离毒分别聚类在2个Group,近两年的分离株(AH320/16、AH463/17、FJ1802/18、NG1901/19)均位于Group A,年份较远的毒株(SQ68/11、TM118/14)主要分布于Group B,其他参考株均符合该规律,说明NA基因在系统发生树上存在明显的随时间演化特点,并且Group A在近两年的NA基因进化过程中占优势。分离毒与参考株Y280/97的核苷酸同源性为89.9%~95.4%,氨基酸同源性为87.8%~95.8%,其中SQ68/11与NG1901/19核苷酸和氨基酸同源性最低,FJ1802/18与NG1901/19的核苷酸和氨基酸同源性最高,说明基因随着年代在不断进化。

图1 6株分离毒HA、NA基因片段系统发生树Fig.1 Phylogenetic trees of HA and NA genes of the six H9N2 isolates
根据氨基酸序列分析,潜在糖基化位点有8个:44NPS、69NST、86NWS、146NGT、200NAT、234NGT、264NIS、368ND/GS(表3),其中44、264、368位潜在糖基化位点均有差异。AH320/16在第44位增加潜在糖基化位点;AH463/17、FJ1802/18、NG1901/19均在第264位发生潜在糖基化位点的缺失,但又与AH320/16在第368位均发生潜在糖基化位点的增加。另外,在红细胞结合重要位点发生了E368S/N、D369G、S400N、N402S/D的突变,在活性中心2014年以后的毒株发生了I153T的突变(表3)。

表3 6株H9N2分离毒NA基因的潜在糖基化位点和功能位点分析Table 3 Potential glycation sites and function sites of NA gene of six H9N2 isolates
2.3 内部基因的序列分析
2.3.1内部基因遗传进化分析 对6株H9N2亚型分离毒的内部基因片段分别构建系统发生树(图2),结果表明,内部基因发生树中PB2、PA、PB1和NS基因发生树存在一个共同特点:即形成两个分支,一个是2013年之前的毒株,以2011年毒株SQ68为代表;另一个是2013年之后的毒株形成的分支,并且随着年代不同毒株在不断演化出不同的小分支。PB2和PA基因发生树中以AH463/17为代表的毒株聚类于一个小分支,AH463/17毒株与其他5株分离株的遗传距离较远、核苷酸和氨基酸相似性略低:PB2核苷酸相似性为92.8%~95.3%,氨基酸相似性为98%~98.4%;PA核苷酸相似性为94.5%~96.4%,氨基酸相似性为97.7%~98.9%。M基因系统发生树显示,以TM118/14为代表的2013-2014年毒株聚类于一个小分支,TM118/14与其他5株分离毒的遗传距离较远,核苷酸相似性为96.2%~98.3%,氨基酸相似性为97.1%~98.1%;2012年以后的毒株(AH320/16、AH463/17、FJ1802/18和NG1901/19)聚在另一个分支且相互之间遗传距离较近,均起源于SQ68/11-like毒株。NP基因与其他5个内部基因不同的是,都是起源于F98-like,但是近几年的毒株分为两个分支,一个以AH463为代表的,包含2015-2018年的毒株;另一个分支包含2008-2019年的毒株,其中2013年以前与以后的毒株分在两个不同的亚分支。
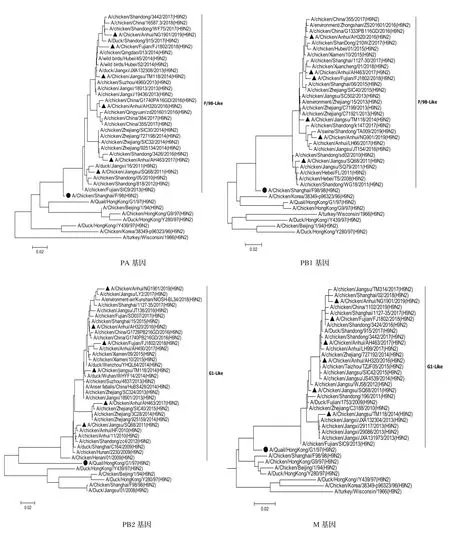
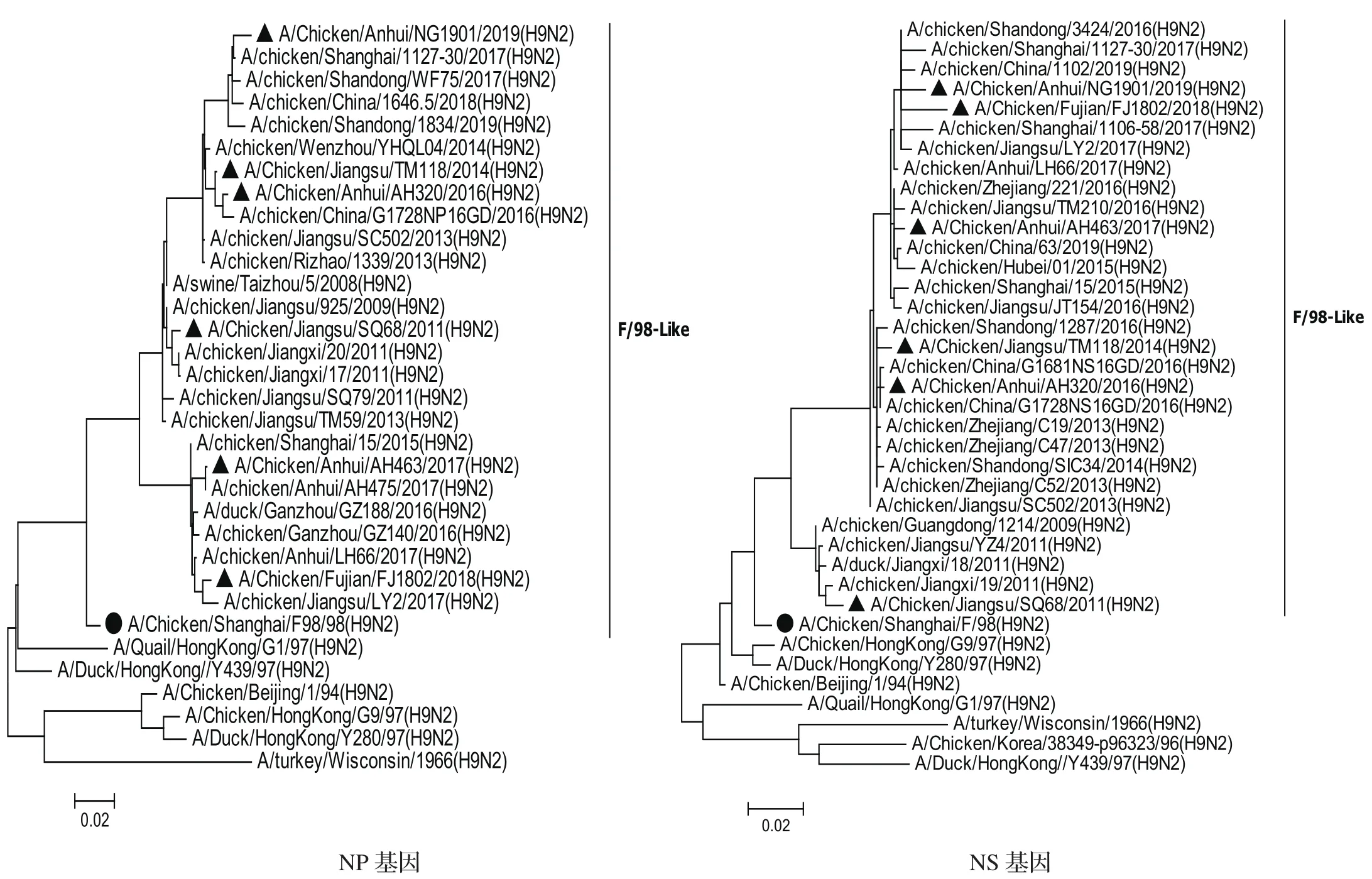
图2 6株分离毒内部基因片段系统发生树Fig.2 Phylogenetic trees of internal genes of the six H9N2 isolates
2.3.2 内部基因关键氨基酸位点分析 关键氨基酸位点分析表明,本研究的6株H9N2亚型AIV分离毒在PB2蛋白并未发生E627K、N701D的突变,但6株分离毒株中有3株分离毒株(SQ68/11、AH320/16、FJ1802/18)发生I292V的突变;4株分离毒株(TM118/14、AH320/16、FJ1802/18、NG1901/19)发生A588V的突变,该突变可促进H9N2病毒在哺乳动物中的复制。6株分离毒株PA蛋白的关键位点分析显示,除SQ68/11外,5株分离毒株(TM118/14、AH320/16、AH463/17、FJ1802/18 和NG1901/19)均发生了K356R的突变,提示H9N2病毒在哺乳动物宿主适应性增强;除FJ1802/18外,其余5株分离毒株(SQ68/11、TM118/14、AH320/16、AH463/17、和NG1901/19)均发生S409N的变化。此外,6株H9N2分离毒株具有一致的关键位点氨基酸变异:M2蛋白第21位氨基酸均为G、第31位均为N以及NP蛋白第253位氨基酸均为I。

表4 6株H9N2分离毒株内部基因的关键差异位点氨基酸分析Table 4 Key amino acid analysis in internal genes of six H9N2 isolates
3 讨论
H9N2亚型禽流感病毒在世界许多地方的家禽中广泛传播,并且在我国已有20多年的历史,它偶尔会跨越物种屏障引起人类感染。有证据表明,多个国家发生人感染H9N2禽流感病毒的病例,或血清学调查证明人感染或暴露H9N2病毒,这强调了H9N2亚型具有引起人类轻度和/或无症状感染的能力[15]。H9N2禽流感病毒之间存在广泛的遗传多样性,目前已鉴定出100多种不同的基因型和几个分散的谱系[16]。
本研究对华东地区6株不同年份(2011-2019年)的H9N2亚型禽流感病毒进行了全基因遗传进化分析,其中HA和NA基因的序列分析表明,本研究的6株分离毒均属Y280-Like,但它们之间的核苷酸、氨基酸同源性均较低(核苷酸同源性最低为90.1%,氨基酸为90.9%),这说明H9N2亚型AIV在免疫选择压力下发生了较大的基因变异。6株毒株的HA基因裂解位点均无多个连续的碱性氨基酸,符合低致病性毒株的特征,但HA蛋白第226位氨基酸为L、第155位氨基酸为T,表明6株病毒具有感染人类的可能性。6株病毒均发生HA D210N的突变,可以促进H9N2病毒的复制,372K可以促进H9N2病毒的气源性传播能力,这些有利于病毒生存以及跨种间感染的位点变化应该受到关注。
糖基化位点的分析显示,6株毒株中均出现了HA蛋白210位潜在糖基化位点的缺失和304位的增加,此前有文献报道,HA蛋白的第210位糖基化位点的缺失会降低病毒结合鸡红细胞的能力,提高病毒对鸡胚的致死性[17]。NA蛋白63~65位氨基酸的缺失导致第61位糖基化位点的消失,这是目前S基因型H9N2毒株共有的特征。但我们的分析发现与Y280/97相比,6株分离株的NA蛋白还出现了第44位潜在糖基化位点的增加(AH320/16)、第264位和第368位潜在糖基化位点的变化(AH320/16、AH463/17、FJ1802/18、NG1901/19),并且这些变化均在近几年的毒株中出现,表明H9N2亚型AIV病毒NA蛋白的潜在糖基化位点具有一定持续进化的趋势。
除了H9N2 HA基因的受体结合偏好外,内部基因组合在哺乳动物的病毒传播中也起决定作用。有研究报道,某些H9N2病毒内部基因具有独特的能力,可提高非H9N2 AIV的人畜共患病潜能,最近的例子包括H7N9、H10N8和H5N6[18]。已知的PB2-E627K和D701N的适应性突变很少在流行的禽源H9N2病毒中发现,本研究的6株分离毒在这两个位点均未发生突变。文献报道,PB2蛋白A588V替代可能是AIV适应哺乳动物的新策略;PB2蛋白I292V的突变可作为一种新型的哺乳动物适应性标记,促进H9N2病毒在哺乳动物宿主中的复制[19]。本研究的分离毒株除SQ68/11外均发生了PA蛋白K356R的突变,该位点是一种新的哺乳动物向性突变,与PB2-E627K、PA-S409N等突变一起,可能使禽源H9N2病毒适应人类感染,增加病毒在哺乳动物宿主内的复制和致病性[20]。M2蛋白第31位S突变为N该位点是流感病毒具有抗金刚烷类抗性的靶位点,以及21位氨基酸为G显示出增强的病毒感染性;NP蛋白第253位氨基酸突变为I导致病毒在哺乳动物宿主中致病性的降低和宿主的向性变化[21],6株分离毒均符合这3个特征。同时,它们均携带了几种哺乳动物适应的分子残基,包括PB1蛋白中的L13P、M1蛋白中的V15I、M2蛋白中的I28V、L55F和NS蛋白中的E227K[22]。6株病毒的内部基因遗传进化分析显示,H9N2亚型AIV病毒已携带多种哺乳动物适应性氨基酸位点的突变,这些哺乳动物适应标记位点的突变,增加了H9N2造成大流行的风险。因此,提示加强持续监测H9N2亚型AIV的重要性。
根据本研究中全基因组遗传进化树的分析结果及文献报道H9N2亚型AIV基因型的划分标准,发现6株分离毒株仍属于中国H9N2亚型AIV的主要流行S基因型。该基因型自2007年首次被分离,至2010年进化成了目前优势基因型[23],6株分离株的年份分布于2011-2019年,说明直至目前,华东地区家禽中的AIV感染依旧是以S基因型为主[24-25]。虽然不同年份的6株病毒的基因型一致,但各基因在遗传进化树上的距离较远,均进化出不同亚分支,而且在受体结合位点、潜在糖基化位点和其他关键位点氨基酸均有差异,表明H9N2亚型AIV病毒在这10年间基因组变化相对稳定,但在进化过程中哺乳动物宿主适应性增强、跨种间感染风险增加。因此,加强对H9N2 AIV的长期持续监测、掌握其遗传进化规律,不仅可为防控该亚型禽流感病毒的疫苗研制提供理论依据,而且对保障公共卫生安全具有重要意义。

