白蛋白与球蛋白比值对膀胱癌患者术后生存情况的预测作用
甄洪涛,杜 鹏,易 强,唐晓龙,王同庆,魏俊峰,王继征,张 超,王朝亮
(1.郑州大学附属郑州中心医院泌尿外科一病区,河南郑州 450007;2.北京大学肿瘤医院泌尿外科,北京 100142;3.郑州大学第一附属医院泌尿外科,河南郑州 450000)
膀胱癌是最为常见的一种泌尿系统恶性肿瘤,近年来,膀胱癌的发病率及死亡率呈逐渐上升趋势,数据显示膀胱癌患者男女比例约为3∶1[1-2]。膀胱癌分为肌层浸润性膀胱癌与非肌层浸润性膀胱癌两种,其中非肌层浸润性膀胱癌患者约占膀胱癌患者75%[3]。术后肿瘤复发及进展是膀胱癌患者重要的临床终点,如何改善膀胱癌患者预后成为临床重点关注问题[4]。寻找预测评估膀胱癌风险及预后生存率的指标以指导临床治疗是改善预后的关键。近年来大量研究显示[5],肿瘤相关炎症可促进肿瘤的发生及发展,部分炎症标志物,如血小板、中性粒细胞、C反应蛋白等对肿瘤预后有重要积极意义。白蛋白与球蛋白作为血清蛋白的主要成分,参与炎症反应的发生及发展。既往有研究表明白蛋白及球蛋白比值(albumin/globulin ratio,AGR)变化对结肠癌、胃癌及非转移性肾透明细胞癌等多种癌症患者的预后判断有积极意义[6-7],故本研究探讨分析AGR对膀胱癌患者术后生存情况的预测作用,现报告如下。
1 资料与方法
1.1 临床资料回顾性分析郑州大学附属郑州中心医院2010年3月至2013年5月收治的120例膀胱癌患者临床资料,纳入标准:①均为首次确诊,并自愿接受手术治疗;②术后经病理证实为膀胱癌;③入院前未接受过放疗、化疗等任何抗肿瘤治疗;④术前未曾使用免疫抑制剂;⑤自愿入组并签署知情同意书者。排除标准:①患有血液性疾病者;②合并有其他慢性炎症疾病或恶性肿瘤者;③有手术禁忌证及认知功能障碍者;④临床病例资料不完整者。所有患者中男78例,女42例;年龄38~65岁,平均年龄(54.35±6.48)岁;病灶单发86例,多发34例;肿瘤直径≥3 cm 57例,肿瘤直径<3 cm 63例;肿瘤分级:高级别59例,低级别61例;肿瘤分期:T1-T2期81例,T3-T4期39例。本研究在实施前已获得医院伦理委员会批准。
1.2 方法收集患者血生化检查资料,获取患者术前1周内的血清白蛋白与血清球蛋白水平,计算血清AGR,AGR=血清白蛋白/(血清总蛋白-血清白蛋白)。审阅患者一般临床病理资料,由病例首页获得患者性别、年龄等资料;由术前及术中膀胱镜检查获取患者肿瘤数量、直径;由术后病理诊断获取患者肿瘤分级与分期,患者肿瘤分级与分期参考世界卫生组织(World Health Organization,WHO)2004分级法及美国癌症联合委员会(American Joint Committee on Cancer,AJCC)TNM分期法(第7版)进行评估[8-9]。
1.3 术后随访通过术后门诊复查或电话随访收集患者查体、血尿常规、血生化检查、影像学检查、膀胱镜检查、生存情况及死亡时间等资料。术后2年内每3个月复查或随访1次,术后第3年开始每半年复查或随访1次。随访时间截止至2018年6月,随访期间获取死亡者全部数据,术后死亡、术后死于非原发病者作为删失数据;失去随访者,统计末次随访时间作为删失数据。总生存时间即手术当天开始至终点事件发生当天(患者肿瘤相关死亡时间或末次有效随访时间)。
2 结 果
2.1 AGR最佳截断值随访8~60个月,平均随访时间(20.47±4.25)个月,有48例(40.00%)患者发生至少一次肿瘤复发,20例(16.67%)患者死亡。根据ROC曲线图(图1)可得曲线下面积(areaunder the curve,AUC)为0.724、最佳截断值为1.58,根据最佳截断值将所有患者中AGR≥1.58的患者划为高AGR组,共65例,占比为54.17%;AGR<1.58的患者划为低AGR组,共55例,占比为45.83%。
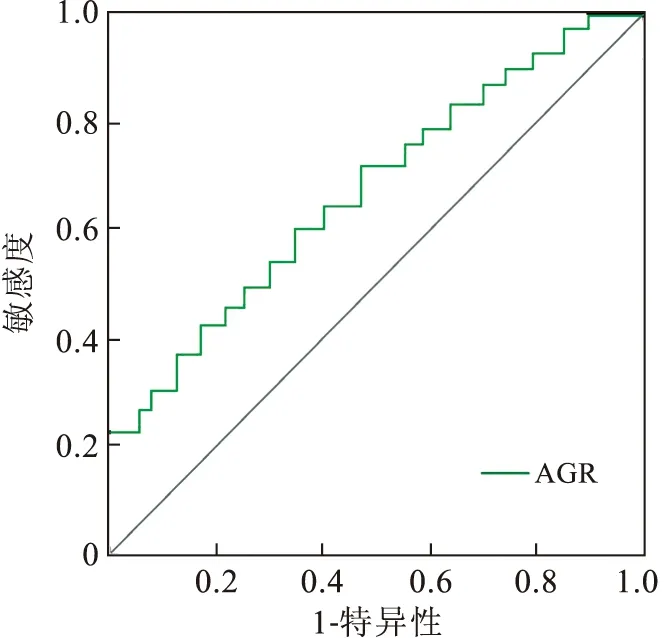
图1 AGR对患者预后价值评估的ROC曲线图
2.2 高AGR组与低AGR组患者临床病理特征比较两组间性别、吸烟、饮酒、体质量、肿瘤直径、肿瘤数量、肿瘤分级、肿瘤分期等相比差异无统计学意义(P>0.05)。低AGR组患者年龄≥60岁占比高于高AGR组(P<0.05,表1)。
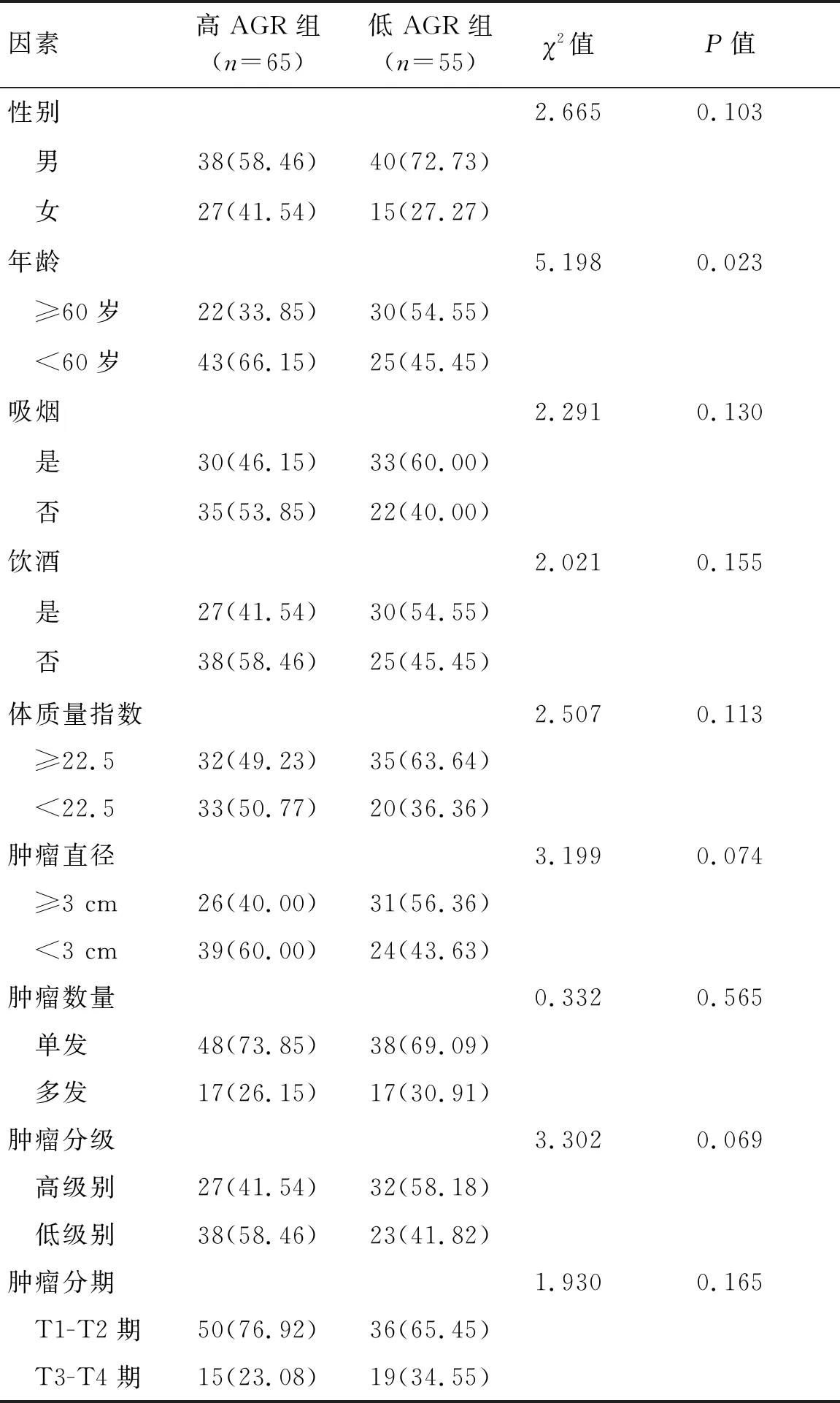
表1 高AGR组与低AGR组患者临床病理特征比较 [例(%)]
2.3 影响膀胱癌患者术后生存情况的单因素分析单因素分析显示,性别、吸烟、饮酒、体质量与膀胱癌患者生存时间无关(P>0.05),与年龄<60岁者相比,年龄≥60岁者生存时间更短,与肿瘤直径<3 cm者相比,肿瘤直径≥3 cm者生存时间更短,与肿瘤数量为单发者相比,多发者生存时间更短,与肿瘤分级为低级别者相比,高级别者生存时间更短,与肿瘤分期为T1-T2者相比,T3-T4者生存时间更短,与AGR值≥1.58者相比,AGR值<1.58者生存时间更短,差异均有统计学意义(P<0.05,表2)。高AGR组患者生存曲线与低AGR组患者生存曲线比较,差异均有统计学意义(P<0.05,图2)。
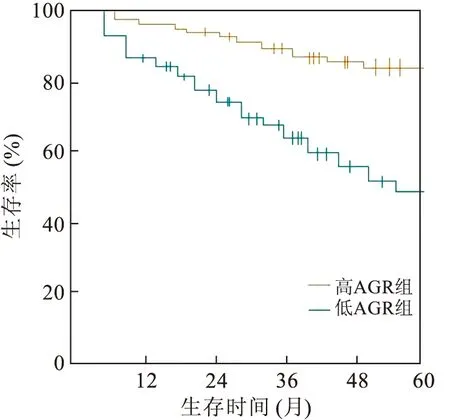
图2 高AGR组与低AGR组患者的生存曲线
表2 影响膀胱癌患者术后生存情况的单因素分析
2.4 影响膀胱癌患者术后生存情况的Cox多因素分析对年龄、肿瘤直径、肿瘤数量、肿瘤分级、肿瘤分期及AGR值以前进法(Forrward:LR)进行Cox回归多因素模型分析,结果显示,肿瘤直径、肿瘤分级、肿瘤分期及AGR值是影响膀胱癌患者术后生存情况的危险因素(P<0.05,表3)。
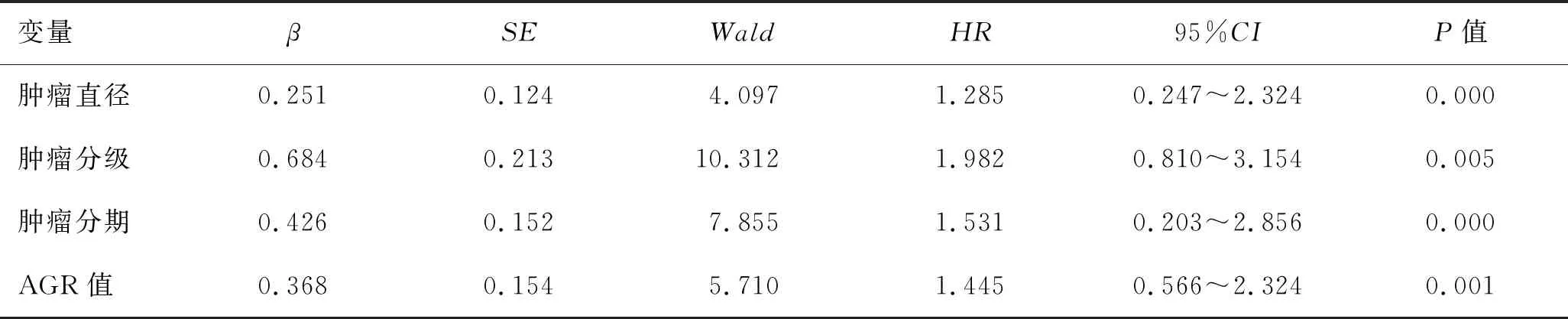
表3 影响膀胱癌患者术后生存情况的Cox多因素分析
3 讨 论
膀胱癌是常见的一种泌尿系恶性肿瘤,多发于中老年男性人群,其发病原因尚未完全明确,部分学者认为可能与色氨酸和烟酸代谢异常、遗传基因及化学致癌物有关[10-11]。目前对于膀胱癌患者多采取手术及膀胱灌注治疗,虽有一定治疗效果,但其术后极易复发,甚至进一步恶化。因此,可预测膀胱癌患者预后参考指标对指导临床治疗具有重要意义。对于癌症的发生发展难以用单一影响因素进行解释,可能是多种因素互相影响共同作用造成的。现今癌症患者术前评估主要依据临床分期,不同病理学分期的膀胱癌术后复发及进展的危险性不同,T1期膀胱癌患者术后复发及进展风险性高于Ta期患者,但其仅纳入肿瘤生物学特性,却忽视患者自身炎症反应微环境[12-13]。
既往研究揭示慢性炎症与癌症之间的潜在关系,发现细胞中的炎性介质,如白细胞介素-1、白细胞介素-6、清道夫受体1及过敏毒素等可以改变肿瘤微环境,促进肿瘤细胞增殖、恶变及转移,从而促使癌症发生[14]。另有研究表明慢性炎症与多种癌症患者生存时间密切相关[15]。研究显示包括C反应蛋白、补体C3等在内的球蛋白在急性时相蛋白表达可上调炎症级联反应,加速炎症进程,还可抑制免疫细胞活性,加速肿瘤生长[16]。白蛋白一方面与癌症患者营养状况有关,患者出现低蛋白血症时意味着其营养不良,机体免疫力降低,防御能力减弱;另一方面肿瘤组织释放的白细胞介素-4及白细胞介素-6等促炎因子可影响肝细胞合成白蛋白,导致白蛋白水平降低,促进肿瘤扩散及转移。由此可见,AGR水平与肿瘤发生及发展密切相关。
LIANG等[17]研究中以AGR=1.35为临界值,将患者分为低AGR组与高AGR组,Kaplan-Meier生存率分析显示低AGR与高级别胶质瘤患者的低总生存率相关。ZHANG等[18]在研究中采用多变量Cox回归分析,发现胃癌患者中低AGR组总生存率及无进展生存率均较低,AGR可作为胃癌患者生存情况的独立预后因素。本研究单因素分析结果显示,年龄≥60岁者生存时间短于年龄<60岁者,肿瘤直径≥3 cm者生存时间短于肿瘤直径<3 cm者,肿瘤数量为多发者生存时间短于单发者,肿瘤分级为高级别者生存时间短于低级别者,肿瘤分期为T3-T4者生存时间短于T1-T2者,AGR值<1.58者生存时间短于AGR值≥1.58者;生存曲线分析结果显示,高AGR组患者生存率高于低AGR组患者生存率,提示AGR值与膀胱癌患者的术后生存情况相关。原因可能在于,对于膀胱癌患者AGR值越低,其肿瘤直径越大,患者无复发生存期越低。白蛋白作为一种炎性因子的主要成分,可预测癌症患者的生存时间。球蛋白作为血清蛋白主要成分的一种,在慢性炎症中具有重要意义,高水平的球蛋白可作为激活炎症标志物[19]。AGR不受肝功能不全、压力及体液变化等因素影响,可识别出白蛋白水平正常但可能预后不良患者,比单独白蛋白或球蛋白更为准确的判断患者预后,可作为临床评估膀胱癌患者预后的重要标志物[20]。此外,Cox回归多因素模型分析结果显示,肿瘤直径、肿瘤分级、肿瘤分期及AGR值是影响膀胱癌患者术后生存情况的危险因素,再次表明AGR值与膀胱癌患者预后密切相关。
综上所述,AGR可作为预测膀胱癌患者术后生存情况的指标,对膀胱癌患者具有较好的预测预后价值。低AGR组较高AGR组术后生存率更低。此外,AGR检测方便且价格低廉,可协助临床医生评估高危患者及时进行个体化治疗。但本研究尚有不足之处,研究样本量较小,只作单中心研究,下一步需进行多中心、大量样本研究以证实AGR对膀胱癌患者预后的预测价值。