阿尔茨海默病的组学机制分析及药物预测
王卓雅, 王燕琳, 杨志华, 孙慧芳, 张 奇, 杨 靖, 许予明
阿尔茨海默病(Alzheimer’s disease,AD)是一种年龄相关的神经退行性疾病,也是认知功能下降最常见的病因。目前,全球有4000多万人患有AD,预计到2050年,这一数字将超过1亿[1]。影像学的应用在AD诊断方面有极大影响,研究表明AD脑萎缩的模式不是随机的,通常是缓慢有序发展的,首先涉及海马体,然后扩散到内侧顶叶、外侧颞叶和额叶区域,最终影响皮质的所有区域,因此,海马体的是区分AD的最佳区域[2]。关于AD的发病机制存在很多种假说,包括淀粉样蛋白级联反应,tau过度磷酸化,神经递质和氧化应激等[3],但具体的发病机制和最佳的治疗方案仍未明确。目前,有几种针对Aβ和tau的药物可以改善症状,但这些药物不能延缓疾病的进展。在我们此次的研究中,利用GEO数据库结合GO富集分析、KEGG通路分析、PPI网络分析、基因共表达网络分析等生物信息学方法,识别可能参与AD发生发展的关键基因。因此,探讨AD发病的分子机制,进一步为AD的精准治疗提供依据。
1 对象与方法
1.1 资料来源 GEO(Gene Expression Omnibus database)数据库(https://www. ncbi. nlm. nih. gov/geo/)系美国国立生物技术信息中心(NCBI)创建并维护的基因表达数据库,是目前最全面的公共基因表达数据库[4]。从GEO数据库中搜索获取基因芯片GSE5281,该芯片包含161个人大脑组织,芯片数据是通过Affymetrix U133 Plus 2.0 array获取的表达谱,其中包括6个脑区样本,分别是内嗅皮质(AD患者10例,正常对照13例)、海马(AD患者10例,正常对照13例)、内侧颞叶(AD患者16例,正常对照12例)、后扣带回(AD患者9例,正常对照13例)、额上回(AD患者23例,正常对照11例)和初级视觉皮质(AD患者19例,正常对照12例)。本研究选取海马区AD患者10例,正常对照13例作为样本,并比较两者之间的差异。
1.2 差异表达基因的筛选 使用R程序对基因进行t检验,通过统计学方法差异基因,通过采用调整P值<0.05,|logFC|>1.5 作为入选标准,其中logFC>1.5 作为上调差异表达基因,logFC<-1.5作为下调差异表达基因。
1.3 基因本体(GO)及京都基因与基因组百科全书(KEGG)通路富集分析 GO富集分析从生物过程、细胞组成和分子功能三方面对基因产物进行标准化描述,能够有效地鉴定获取数据的相应生物学属性。KEGG通路富集分析DEGs所参与的代谢途径以及各途径之间的关系,从而可以表示参与其中的基因列表以及信号通路。使用DAVID数据库(https://david. ncifcrf. gov)对筛选得到的DEGs进行在线GO富集分析,使用R程序clusterProfiler包对DEGs进行KEGG通路富集分析,获取P值,P<0.05并且基因数≥5有统计学意义。
1.4 蛋白质-蛋白质相互作用(Protein-Protein interaction,PPI) 网络分析 采用STRING数据库(https://string-db. org)进行DEGs的PPI网络构建,STRING是目前覆盖蛋白质相互作用信息最全面的数据库,使用STRING分析得到的PPI网络结合Cytoscape软件进行可视化分析。
1.5 药物-基因的相互作用 利用开源的药物基因相互作用数据库(https:/ /www. Dgidb. org)来分析基因与药物之间的相互作用,以关键基因为潜在的标靶在数据库中搜素现有的药物,以探索新的药物在疾病中的潜在应用。
1.6 统计学分析 DEGs分析采用t检验的P值和差异倍数进行筛选和鉴定,筛选的标准为调整P值<0.05且差异倍数>1.5有统计学意义,对DEGs进行GO及 KEGG富集分析,P<0.05有统计学意义。所有统计分析均在R 4.0.3中完成。
2 结 果
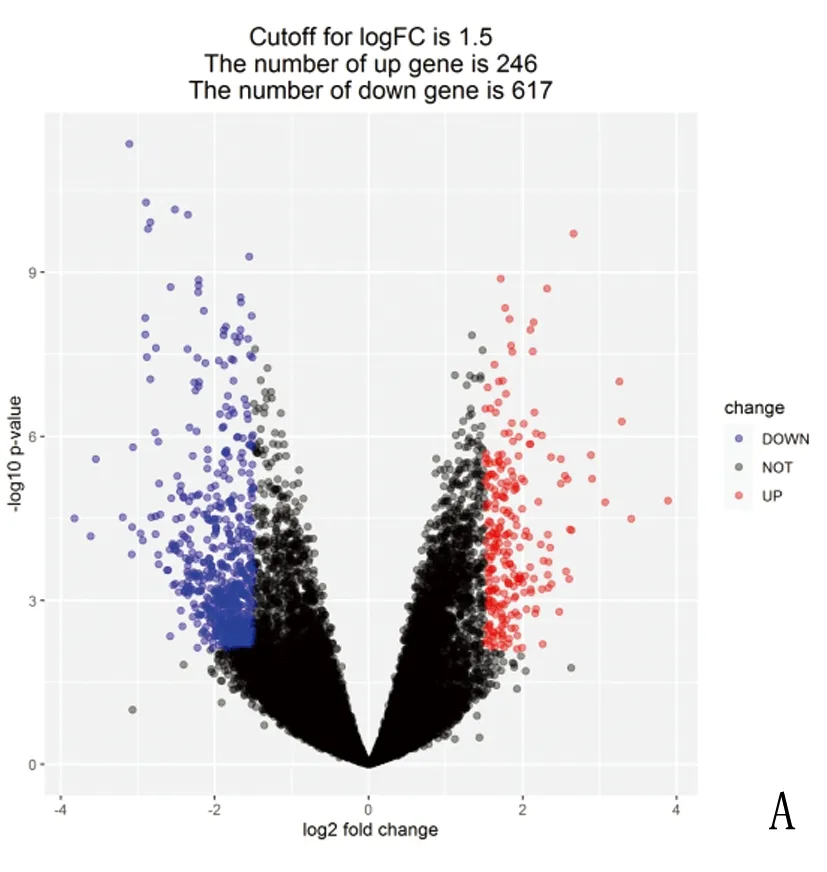
2.1 差异表达基因 通过GSE5281中海马组进行差异基因筛选出863个DEGs(差异倍数>1.5,且调整P<0.05),分别包括246个上调基因和617个下调基因(前10位上调和下调DEGs见表1)。通过差异表达基因绘制火山图(图1A)和聚类图(见图1B)。红色代表上调基因,蓝色代表下调基因,从图中可以说明下调基因比例较高。
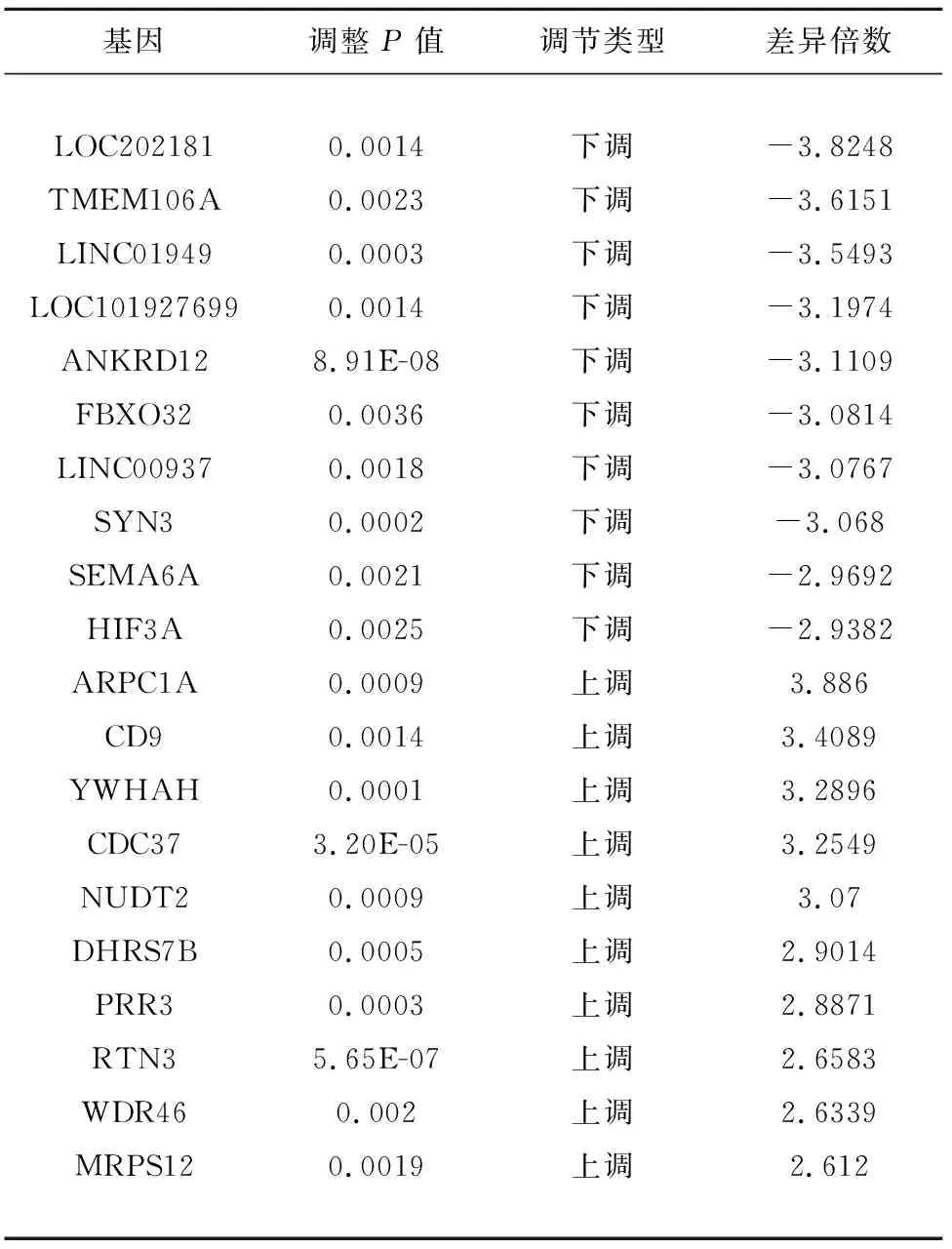
表1 前10位上调及下调差异表达基因
2.2 差异表达基因的功能分析
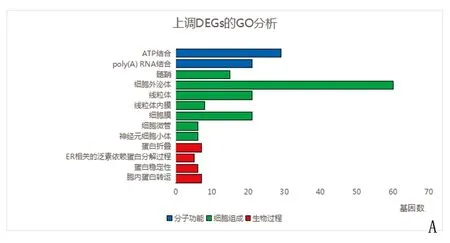
2.2.1 GO富集分析 GO分析可由生物过程、分子功能和细胞组成3个部分结果构成。上调的DEGs在分子功能包括ATP结合以及POLY(A) RNA结合,细胞组成包括细胞外泌体,线粒体,线粒体内膜,细胞膜等,生物过程中主要包括蛋白折叠和内质网(ER)相关泛素依赖蛋白分解过程,下调的DFGs在分子功能包括RNA聚合酶Ⅱ核心启动子的结合及特异性DNA结合以及转录调控区域的特异性结合,细胞组成包括核质和细胞核内,生物过程中主要包括RNA聚合酶Ⅱ启动子的转录的调控以及转化生长因子受体信号通路的负调控等(见图2)。
2.2.2 KEGG通路分析 KEGG分析结果显示,上调DEGs主要涉及帕金森病、朊蛋白病、亨廷顿病、阿尔兹海默病等多种神经退行性疾病,以及蛋白酶体、氧化磷酸化和生热作用,下调DEGs主要包括长时程增强作用、轴突导向、嗅觉传导以及MAPK、Rap1、雌激素钙离子、Ras信号通路等(见图3)。
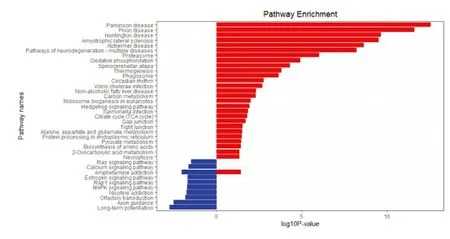
图3 差异表达基因的KEGG富集分析(红色代表上调基因,蓝色代表下调基因)
2.3 差异表达基因的PPI结果
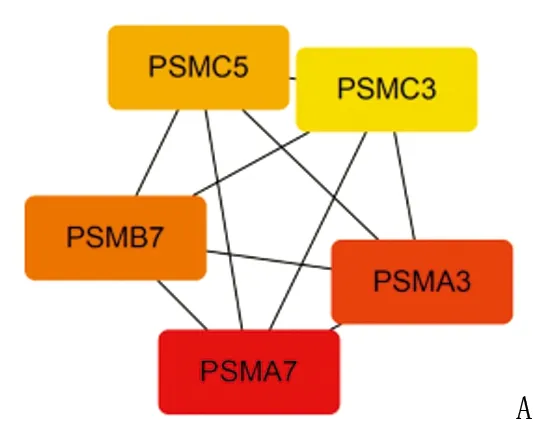
2.3.1 PPI网络的构建以及核心基因的筛选 为了鉴定潜在调控基因,构建 PPI 网络,基于STRING数据库结合Cytoscape插件筛选出5个基因PSMA7、PSMA3、PSMB7、PSMC5和PSMC3,将这5个基因命名为核心基因(见图4A)。
2.3.2 功能模块分析 使用 Cytoscape 中的 MCODE 插件,其根据拓扑关系对给定网络进行聚类,筛选出31个关键基因,其中包括23个上调基因和8个下调基因(图4B),红色代表上调基因,蓝色代表下调基因。31个关键基因为PSMC5、PSMA7、PSMC3、PSMB3、TNPO1、UBE2W、FBXO32、CCT4、MYLIP、PSMB7、RPL3、RNF25、FBXW12、CCT2、PSMA3、CUL3、PFDN5、CCT5、SMURF2、UBE2M、COPS5、EIF3G、ASB16、UBC、PPP2R1A、HSP90AB1、PSMD8、CCT7、CUL1、NACA、NHP2L1,其中TNPO1、NHP2L1、ASB16、FBXW12、SMURF2、FBXO32、UBE2W、MYLIP为下调基因,余23个均为上调基因。通过KEGG分析得这些关键基因与蛋白酶体及泛素介导的蛋白水解关系密切。
2.4 药物基因相互作用 以5个核心基因为靶点筛选出8种现有药物,分别为CARFILZOMIB、BORTEZOMIB、IXAZOMIB CITRATE、OPROZOMIB、PHENETHYLISOTHIOCYANATEIXAZOMI、CHEMBL304784、MARIZOMIB(见表2)。

表2 药物与核心基因相互作用
2.5 多组基因芯片分析 由于所检索的基因表达谱芯片(ID:GSE5281)样本量较少,为了使数据更加具有说服力,进一步扩大样本量进行分析,以用于寻找到共同的差异表达基因,从GEO数据库中进一步筛选出两组基因芯片GSE1297和GSE48350,GSE1297芯片来源于海马部分的基因表达分析,其包含9个正常对照和31个AD患者的海马区脑组织,根据MMSE和NFT评分将患者划分为轻、中、重度,我们选取其中9个正常对照和7个分型为重度的患者进行分析。GSE48350芯片包括253例脑组织样本的基因表达谱数据集,我们选取其中对本研究有意义的62例样本,包括19例AD患者海马区脑组织样本和43例正常对照海马区脑组织样本进行分析(P值<0.05,|logFC|>1.5 作为入选标准)。GEO数据库中仅GSE5281,GSE1297和GSE48350这3组基因芯片为AD患者海马区脑组织表达谱芯片,这三组基因芯片两两比较结果见表3。

表3 3组基因芯片分析结果两两比较
3 讨 论
阿尔茨海默病(AD)是1907年由Alois Alzheimer首次提出并以其名字命名此种疾病[5]。AD是痴呆最常见的原因,约占70%[6]。临床表现起病隐匿,包括记忆力减退、认知功能下降,行为功能障碍,日常生活活动不能维持[7]。患者从正常认知障碍进展到轻度认知障碍(MCI),随后痴呆程度逐渐加重从轻度进展为中度进而变为重度。65岁患者确诊后的平均存活时间为8 y[8]。AD的神经病理学在宏观上表现为脑萎缩,皮质变薄、萎缩,主要显微特征包括神经炎性淀粉样斑块和神经原纤维缠结(NFTs)形成。目前多数研究认为Aβ和tau寡聚物沉积是AD重要的发病机制[9]。但具体的机制仍不清晰,并且治疗方式单一,效果甚微,给患者及家庭造成了极大的精神和经济负担,因此加快对AD的发病机制的研究进而促进治疗的需求十分迫切。
本研究通过使用t检验对GSE5281基因芯片进行分析,获得AD患者海马体部分脑组织与正常对照相比差异表达863个基因,包括 246个上调基因和617个下调基因,通过PPI分析得到31个关键基因:PSMC5、PSMA7、PSMC3、PSMB3、TNPO1、UBE2W、FBXO32、CCT4、MYLIP、PSMB7、RPL3、RNF25、FBXW12、CCT2、PSMA3、CUL3、PFDN5、CCT5、SMURF2、UBE2M、COPS5、EIF3G、ASB16、UBC、PPP2R1A、HSP90AB1、PSMD8、CCT7、CUL1、NACA、NHP2L1,其中TNPO1、NHP2L1、ASB16、FBXW12、SMURF2、FBXO32、UBE2W、MYLIP为下调基因,余23个差异表达基因在AD患者海马体部分为上调基因。
通过生物信息学的方法,我们分析得到AD患者海马体部分与正常对照相比有31个关键的DEGs,其中COPS5、PSDN5和TNPO1在AD中的作用已有研究,而有些基因在AD中的作用仍需进一步研究。有研究表明在细胞系和小鼠脑中COPS5 (Constitutive Photomorphogenesis 9 Signalosome Subunit 5)与LRP、BACE1、APP和RanBP9结合从而导致Aβ的分泌增加[10],此外,COPS5过表达减少脑内树突棘标志物的表达并且小鼠的学习和记忆能力均有下降[11],因此说明COPS5是RanBP9复合物的一部分,并且在Aβ的产生和体内突触蛋白水平变化中占据重要作用。PFDN(Prefoldin)是一种广泛表达的异六聚体辅伴侣蛋白,由2个α亚基(PFDN3、5)和4个β亚基(PFDN1,2,4,和6)组成[12],其生物功能主要为协助新合成大小的蛋白质折叠,防止已存在的蛋白质聚集和错误折叠[13],其中PFDN5在神经系统中研究最为充分,PFDN5功能异常导致致病性淀粉样β蛋白聚集,随后神经元死亡[14],此外,在小鼠体内PFDN5基因破坏可导致小脑神经元细胞变性[15],因此PFDN5功能障碍是导致AD的病因之一。有研究指出TNPO1(Transportin-1)在早期AD中发挥了重要作用,在AD小鼠海马区发现TNPO1水平上调,这与我们此次的研究相符,这可能说明了TNOP1表达水平的上调可能是脑内Aβ增加的调节机制,因此TNOP1可能在早期AD中Aβ代谢中占据了重要作用[16]。
GO富集分析得到DEGs主要集中在线粒体电子传递、ATP结合以及定位于线粒体内等生物过程。线粒体功能障碍与AD之间的关系十分密切,线粒体主要产生ATP用于为细胞生命活动提供能量,许多线粒体功能障碍已经在AD中有研究,在Aβ和tau蛋白开始形成之前线粒体中葡萄糖的代谢受损、线粒体酶功能下降以及ROS的产生增加[17],此外,在早期AD线粒体动力学方面也出现功能障碍,包括线粒体融合和裂变之间的平衡破坏、线粒体轴突运输减少、细胞内线粒体比例降低、大小发生改变,线粒体在AD中维持为更短、更宽的形状[18]。因此,线粒体功能缺陷可能是AD进展的核心。KEGG富集分析结果示上调DEGs主要跟AD、帕金森病及亨廷顿病等神经退行性疾病有关,下调DEGs主要跟长时程增强有关,长时程增强(LTP)是1973年首次在哺乳动物大脑中的穿通神经纤维与颗粒细胞之间的突触连接中发现,海马内单突触兴奋同类的短暂高频刺激寻猎导致突触传递效率的突然和持续增加,LTP构成海马体的所有兴奋通路及大脑其他几个区域[19],因此可以说明其构成了记忆形式的基础,我们此次研究说明AD患者海马体与正常对照相比下调DEGs的KEGG富集通路主要集中于长时程增强,构成AD的发病机制。然而,我们此次研究中GO富集分析中发现DEGs与RNA聚合酶Ⅱ启动子的结合剂转录调控关系密切,然而这部分研究相对较少,可能为以后研究AD发病机制提供新方向。
通过基因与药物相互关系研究,我们通过PPI筛选出5个核心基因(PSMA7、PSMA3、PSMB7、PSMC5和PSMC3),并以此为靶点筛选出8种药物,分别为CARFILZOMIB、BORTEZOMIB、IXAZOMIB CITRATE、OPROZOMIB、PHENETHYLISOTHIOCYANATE、IXAZOMI、CHEMBL304784、MARIZOMIB,这8种药物均为相应基因位点的抑制剂。其中,CARFILZOMIB用于治疗难治性和复发性多发性骨髓瘤的蛋白酶体抑制剂,美国食品和药物管理局(FDA)批准该药物可以与地塞米松或来那度胺联合使用来做进一步治疗[20],有案例曾报道一位使用CARFILZOMIB治疗的多发性骨髓瘤患者出现了癫痫持续状态,停药3 d后这些症状消失[21],目前针对CARFILZOMIB与癫痫的关系并没有机制说明,我们猜测可能通过降低血管内皮生长因子的转录导致内皮功能障碍从而导致脑内神经元的兴奋性增强出现癫痫等症状,而AD是一种退行性疾病,由此我们推测CARFILZOMIB可能提高神经系统的兴奋性。然而这些药物均未在AD模型进行研究,我们此次的研究为探讨AD的发病机制及治疗方式提供了新的思路,但仍需要进行分子实验进行验证。
4 结 论
我们通过一系列生物信息信息学方法对基因表达谱进行分析,筛选出多个AD患者海马体部分与正常人相比的差异表达基因,以及现有的靶向药物,这将为我们了解AD发病机制和探讨新的治疗方案提供依据。

