增强磁共振成像对乏血供胰腺神经内分泌肿瘤及胰腺导管腺癌的鉴别诊断价值
汪 薇, 饶圣祥, 曾蒙苏, 周国锋*
1. 复旦大学附属中山医院放射科,上海 200032 2. 上海市影像医学研究所,上海 200032
胰腺神经内分泌肿瘤(pancreatic neuroendo-crine tumors,PNETs)是一类起源于肽能神经元和神经内分泌细胞的异质性肿瘤,发病率为1/10万~2/10万,约占所有胰腺肿瘤的2%[1-2]。大多数PNETs是富血供肿瘤,增强扫描动脉期强化明显,门脉期造影剂有廓清,这也是PNETs的特征性表现,而约41.5%的PNETs为乏血供肿瘤,动态增强扫描呈弱强化,与胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)强化方式相似[3-6]。
目前,只有少数研究是关于PNETs与PDAC的影像学鉴别诊断,并且大部分为CT相关鉴别诊断研究[7-10],而临床上PNETs与PDAC的手术切除范围不同,预后亦不同[11-13]。因此,术前的准确诊断有利于更好地进行术前评估、预后判断及手术方案的制订。本研究旨在探讨增强磁共振成像(MRI)对乏血供PNETs及PDAC的鉴别诊断价值。
1 资料与方法
1.1 一般资料 回顾性分析2015年1月至2020年12月复旦大学附属中山医院经手术病理证实的PNETs患者的MRI检查资料以及2020年1月至2020年12月经手术病理或穿刺病理证实的PDAC患者的MRI检查资料。乏血供PNETs的诊断标准为MRI动态增强后动脉期强化程度低于或等于胰腺实质[8]。排除图像质量不佳的病例后,共109例PNETs患者,其中乏血供PNETs患者39例,富血供PNETs患者70例。112例PDAC患者,排除术前未进行磁共振增强扫描及图像质量不佳的病例,共纳入37例PDAC患者。
纳入标准:经手术病理或穿刺病理证实的乏血供PNETs、PDAC的增强MRI检查患者。排除标准:(1)术前未行放化疗及其他辅助抗肿瘤治疗者;(2)扫描图像质量差,出现明显呼吸运动伪影或胃肠道蠕动伪影或磁敏感伪影。(3)同时伴有其他恶性肿瘤患者。本研究经复旦大学附属中山医院伦理委员会批准(B2020-081R),所有患者均签署知情同意书。
1.2 MRI检查设备与参数 MRI检查共采用5种机型,包括西门子1.5 Tesla 扫描仪(MAGNETOM Aera, SIEMENS Healthcare,Erlangen, 德国)、1.5 Tesla 扫描仪(MAGNETOM Avanto, SIEMENS Healthcare,Erlangen, 德国)、1.5 Tesla扫描仪(uMR 560;United Imaging Healthcare, 上海,中国)、3.0 Tesla 扫描仪(Verio, Siemens Medical Solutions, Erlangen, 德国)、3.0 Tesla扫描仪(uMR 770;United Imaging Healthcare, 上海,中国),并采用腹部体线圈。磁共振扫描包括横断位T1WI,采用快速自旋回波(fast spin echo,FSE)序列、T1WI抑脂序列、T2WI横断位及冠状位序列和常规DWI序列(b值0、500 s·mm-2)。动态增强成像造影剂为钆喷酸葡胺注射液(Magnevist; Bayer HealthCare, Berlin, 德国),分别采集动脉期(对比剂达到升主动脉时自动触发)、门脉期(70~80 s)、平衡期(180 s),对比剂(质量浓度为0.1 mmol/kg)以2 mL/s的速率通过外周静脉注入,并以20 mL生理盐水冲洗管道。
1.3 图像分析 影像图像及相应参数测量由2名有2年以上工作经验的放射科医师分别测量。定量数据取二者平均值,定性数据取二者统一值,意见不同时,与另一位高年资医师讨论后达成一致。主要观察指标包括PNETs及PDAC的大小、位置、境界、质地、胰管扩张、周围血管侵犯、淋巴结转移及远处转移等情况。另外,分别测得2组肿瘤的ADC值、增强后各期的强化率,参考T2WI和动态增强图像,确保感兴趣区(ROI)在目标组织内,且避开主胰管、胆总管胰腺段、邻近血管、囊变坏死区及边缘伪影,在肿瘤最大面积层面放置ROI。病变位置分为胰腺头-颈部、体部及尾部。实性成分大于90%的肿瘤定义为实性,而囊性肿瘤指囊性成分大于90%的肿瘤,其余定义为囊实性[14]。主胰管直径>3 mm定义为胰管扩张。病变的强化方式分为四型:Ⅰ型为门脉期高强化型,Ⅱ型为持续低强化型,Ⅲ型为持续高强化型,Ⅳ型为延迟期高强化型;病变强化高于周围正常胰腺则为高强化,反之则为低强化[9]。为了避免不同MRI扫描仪信号强度的误差,增强后的图像在三期分别测量强化率。强化率=(SIle-SIpe)/SIm,其中SIle代表胰腺病变增强后的信号强度,SIpe代表正常胰腺组织增强后的信号强度,SIm则代表脊柱周围肌肉同期的信号强化[15]。

2 结 果
2.1 一般资料分析 结果(表1)显示:乏血供PNETs患者共39例,其中男25例,女14例;年龄15~77岁,平均(55.7±14.1)岁。PDAC患者共37例,其中男18例,女19例;年龄48~79岁,平均(66.5±7.3)岁。乏血供PNETs组较PDAC组发病年龄更小[(55.71±14.18)岁vs(66.46±7.25)岁,P<0.001]、黄疸的症状更少见(7.7%vs27%)、CA19-9升高亦少见(12.8%vs75.7%,P<0.001)。腹泻、低血糖等激素分泌症状则是PNETs患者的特征性表现(12.8%vs0)。2组患者在病变大小、性别、腹痛症状上差异无统计学意义。
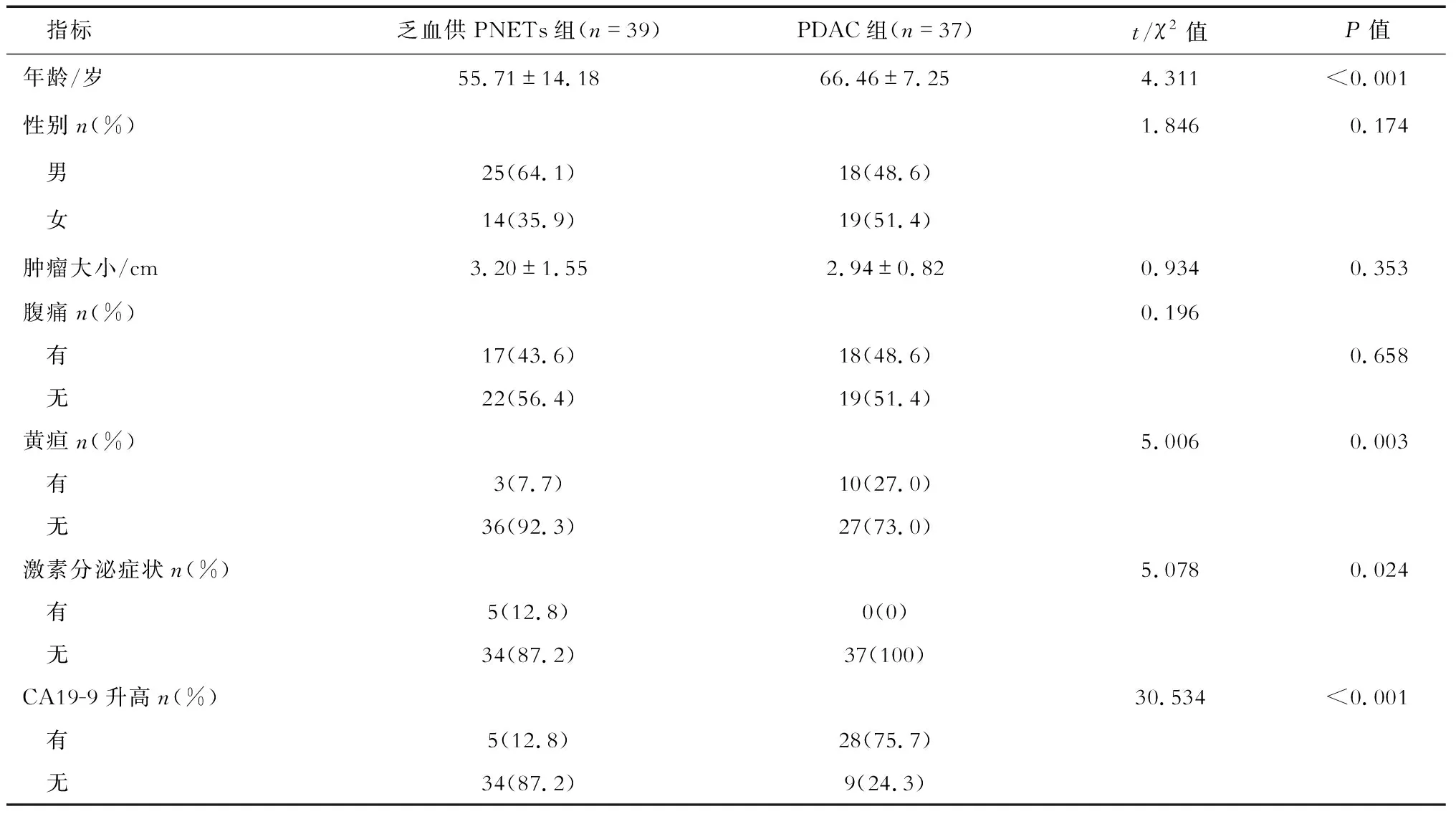
表1 乏血供PNETs与PDAC组患者的一般资料分析
2.2 影像学特征比较分析 结果(表2)显示:发病部位上来说,PDAC相对乏血供PNETs更好发于胰头,而乏血供PNETs较PDAC胰尾略多见(P=0.018)。PDAC边界不清的较乏血供PNETs多见(81.1%vs43.6%,P=0.001)。比较二者质地(囊实性或实性)、周围血管受累情况差异无统计学意义。PDAC组较乏血供PNETs组,更易出现主胰管扩张、淋巴结转移及周围脂肪浸润(均P<0.001)。2组的表观弥散系数(ADC)值差异无统计学意义。2组病变在强化方式、动态增强三期的强化率差异存在统计学意义(均P<0.001),强化方式均为渐进性强化,但乏血供PNETs组增强后门脉期有38.5%的病例呈相对高信号(对比周围正常胰腺组织),典型病例动态增强MRI图像见图1,而PDAC组只有2.7%的病例门脉期呈相对高信号,即Ⅰ型强化方式,PDAC组最常见的是Ⅱ型强化方式,即动态增强三期均呈相对低信号,典型病例动态增强MRI图像见图2。
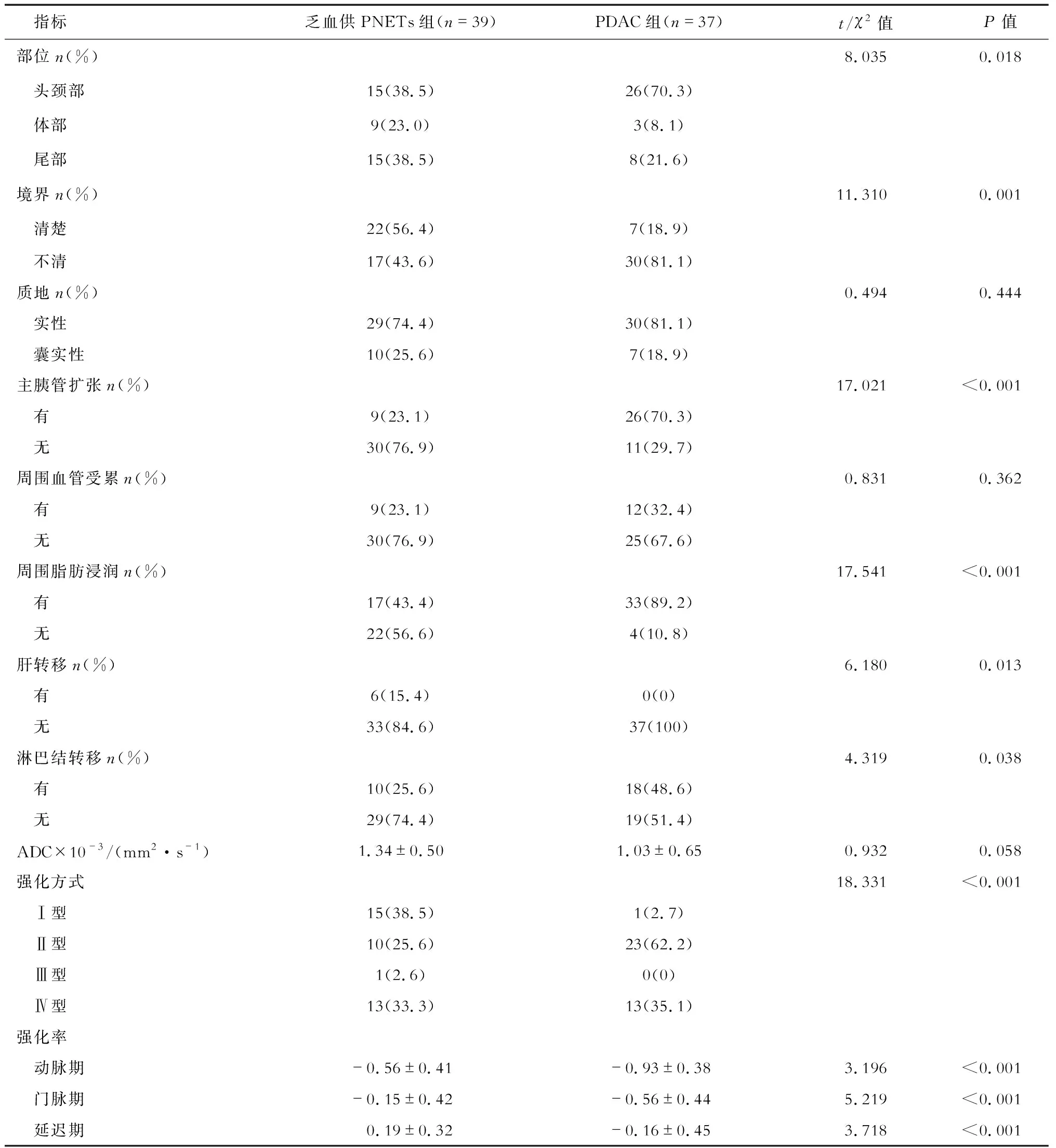
表2 乏血供PNETs与PDAC组患者的MRI征象比较
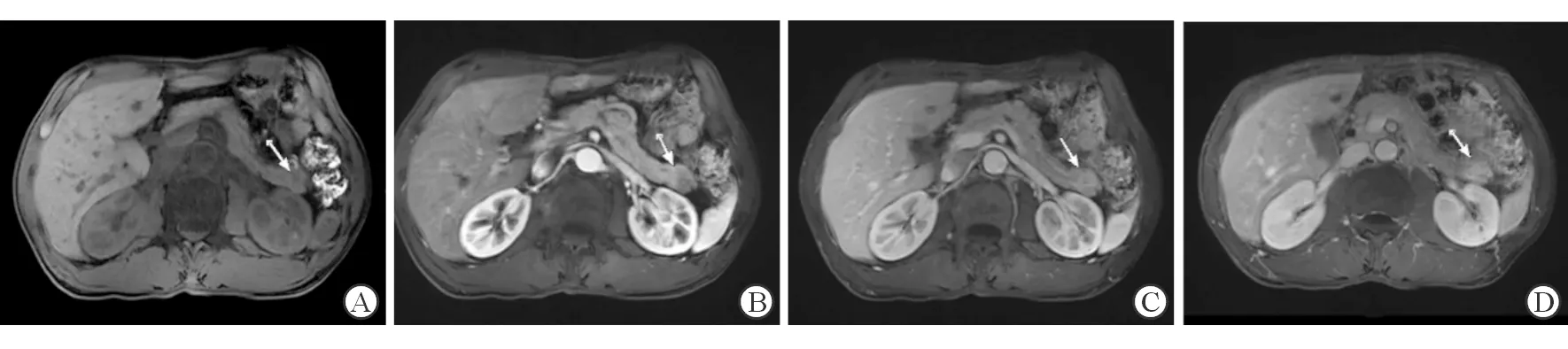
图1 乏血供PNETs组典型病例的动态增强MRI图像
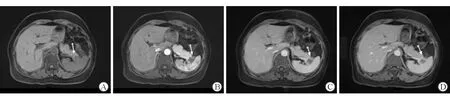
图2 PDAC组典型病例的动态增强MRI图像
2.3 独立预测因子分析 由表2结果筛选出有统计学差异(P<0.05)的影像学特征:部位、境界、主胰管扩张、周围脂肪浸润、淋巴结转移、强化方式。对上述因素进行logistic回归分析的结果(表3)显示:主胰管扩张(P=0.035)、周围脂肪浸润(P=0.006)、强化方式为鉴别诊断的独立预测因子(P=0.048)。

表3 Logistic回归分析MRI影像学特征的独立预测因子
2.4 联合临床及影像学特征的鉴别诊断效能 由前文结果筛选出有统计学差异的临床特征(年龄、黄疸、激素分泌症状、CA19-9有无升高)及影像学特征(部位、境界、主胰管扩张、周围脂肪浸润、淋巴结转移、强化方式),纳入logistic回归分析模型,最后得出的独立预测指标为CA19-9有无升高、周围脂肪浸润、门脉期强化率,见表4。
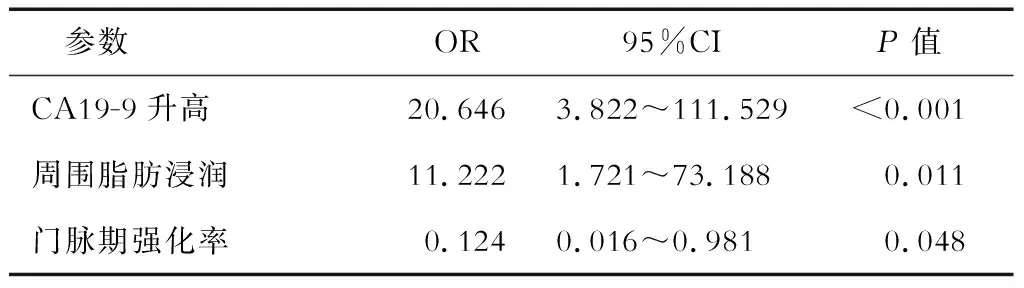
表4 Logistic回归分析临床特征及影像学特征的独立预测因子
2.5 多因素联合分析诊断效能的ROC曲线 计算多个指标的预测概率,包括临床特征(年龄、黄疸、激素分泌症状、CA19-9有无升高)及影像学特征(部位、境界、主胰管扩张、周围脂肪浸润、淋巴结转移、强化率),并对其进行ROC曲线绘制。结果(图3)显示:AUC为0.93(95%CI 0.868~0.995,P<0.001),截断值0.4557,约登指数0.75,诊断的灵敏度为91.7%,特异度为83.3%。
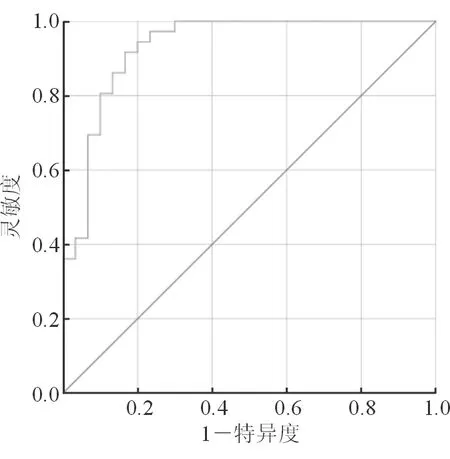
图3 多因素联合分析诊断效能ROC曲线
3 讨 论
乏血供PNETs与PDAC在影像学存在部分重叠,但二者的手术方式不尽相同。PDAC通常需行包括淋巴结清扫在内的根治性手术;而对于PNETs,小的、早期的肿瘤可能只需要行范围较小的手术,而不需要行淋巴结清扫,诸如肿瘤剥除术、部分胰腺切除术及腹腔镜手术[13]。因此,术前利用影像学对两者进行准确诊断及鉴别诊断具有重要意义。PNETs是一类具有不同临床表现的异质性肿瘤[8]。本研究中,117例PNETs中有39例(36.4%)动脉期表现为乏血供型,这与之前研究[16]一致。
PNETs按照是否有激素分泌症状和实验室检查分为有功能性和无功能性,前者包括胰岛素瘤、胃泌素瘤、胰高血糖素瘤、生长抑素瘤等[2],功能性乏血供PNETs,通常会因分泌多量的内分泌激素而出现相对应的临床症状。本研究39例乏血供PNETs患者中,5例出现低血糖、腹泻等症状,也与其包含能分泌各种激素的有功能性肿瘤有关。无功能性PNETs较为常见,占80%左右,发现时多有肝转移。在来自瑞典的关于PNETs远处转移的回顾性研究[17]中,82%转移部位为肝脏,PNETs肝转移占93%,其中孤立性肝转移占61%,肝脏合并其他器官远处转移占32%,约40%的PNETs诊断时即发现肝转移[18]。而文献报道,PDAC术后肝转移发生率为32%~46%。本研究中PNETs组中有15.4%的病例发现肝转移,这与之前研究[17]有差距。而PDAC组未发现肝转移病例,这可能是由于本研究纳入的PDAC病例为手术病理证实者,而很多已经发生肝转移的PDAC病例由于已属晚期,并未进行手术治疗,而未被纳入本研究。
本研究结果显示,相比于乏血供PNETs,PDAC患者肿瘤部位以胰头多见,这与以往研究[20]相符。目前的研究表明,乏血供PNETs大多表现为边界清晰的肿块[9],并且约75%的乏血供PNETs病灶边界清楚[8]。本研究中乏血供PNETs的边界清晰较PDAC多见,约占56.4%,与其结果相似。另外,之前的研究[21-22]表明,PNETs的常见表现中,边缘清晰、胰管扩张及血管浸润、淋巴结转移少见。Tummala等[23]评估恶性肿瘤胰管扩张的发生率证实,187例胰管扩张患者中152例有恶性肿瘤,本研究也证实了此点,PDAC组较乏血供PNETs组更易出现主胰管扩张、淋巴结转移及周围脂肪浸润。ADC值除反映组织内水分子的弥散运动外,还受到毛细血管网中血流的微循环灌注影响。本研究中乏血供PNETs与PDAC间ADC值的差异无统计学意义,可能由2组单纯弥散参数差异与灌注参数差异相互抵消所致[24]。以往研究[9]表明,乏血供PNETs的强化方式多以渐进性持续强化为主,而PNETs的强化方式通常与肿瘤大小、肿瘤内纤维化、囊变坏死及肿瘤级别有关,低强化PNETs的微血管密度明显低于高强化者,且低强化者的恶性度更高,所以乏血供PNETs恶性程度较富血供PNETs高[8]。有研究[25]推测,这可能是乏血供PNETs恶性程度高,血管结构紊乱所致。虽然2组病变的强化方式类似,但是静脉期的CT值对于2组病灶的鉴别具有一定意义[8],本研究2组病变,在强化方式上存在差别,乏血供PNETs更多表现为门脉期高强化,而PDAC大部分则三期均呈相对低信号,而且二者在动脉期、门脉期、延迟期的强化率差异均有统计学意义,PDAC的强化率在三期都要低于乏血供PNETs。
本研究的局限性:(1)为回顾性分析,样本量较少,需要大样本研究进一步证实;(2)由于本研究中病例的MR扫描机型无法统一,只能选择不受机型影响的ADC值及强化率进行分析,因而剔除了许多其他MR序列;(3)研究仅收集经手术病理证实的病例,未行病理检查的患者未纳入研究,样本具有一定选择性的原因可能导致结果出现偏倚。
综上所述,患者的年龄、是否黄疸、是否存在激素分泌症状、是否CA19-9升高、肿瘤边界是否清晰、主胰管是否扩张、周围脂肪是否浸润、动态增强三期的强化率及是否转移对于乏血供PNETs与PDAC的鉴别有诊断价值。主胰管扩张、周围脂肪浸润、强化方式3个影像学特征为鉴别诊断的独立预测因子。若患者年龄偏大、有黄疸症状、CA19-9升高、肿瘤边界不清、主胰管扩张、累及周围脂肪间隙、淋巴结转移、增强三期的强化率较低则倾向考虑PDAC,若患者存在激素分泌症状、肿瘤边界清晰、动态增强三期强化率较高、伴有肝转移则倾向考虑乏血供PNETs。
利益冲突:所有作者声明不存在利益冲突。

