IGF-1通过P38MAPK信号下调急性脑梗死大鼠脑组织中凋亡蛋白的表达及其意义 ①
杜云婷
(中国医科大学肿瘤医院,辽宁省肿瘤医院检验科,辽宁 沈阳 110042)
急性脑梗死是脑组织的缺氧缺血性坏死,由脑血管阻塞引起,包括栓塞和血栓形成。各种疾病和不健康的生活习惯可能导致脑梗死,如高血压,糖尿病,吸烟,肥胖和血脂异常,这些与其高死亡率和残疾率成正相关[1]。在我国脑血管病已在各种死亡原因中上升为第一位[2]。研究表明,炎症反应和神经细胞凋亡被认为是脑梗死的主要病理生理机制[3]。胰岛素样生长因子-1(Insulin-like Growth Factor-1,IGF-1)是体内普遍存在的具有胰岛素样生物学活性的循环内分泌多肽,并可促进细胞增殖、分化、抑制凋亡。此外,相关的研究发现,IGF-1在不同的情况下参与机体的促炎[4]和抗炎[5]双重作用。IGF-1是一种促进小胶质细胞有丝分裂因子,通过转换和调控小胶质细胞表型进而调节神经胶质细胞的神经炎症反应。
IGF-1通过与IGF1R和IGF2R作用,活化促分裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)途径[6]。作为 MAPK 通路的一个主要分支, 细胞毒素炎症因子、肿瘤坏死因子等应激性刺激可以激活p38MAPK[7],活化后的 p38MAPK 通过调控下游多种酶及转录因子的基因的表达,从而间接调节细胞的功能活动,在炎症反应、细胞的应激反应以及凋亡等方面发挥重要作用。我们前期结果发现,Th17细胞通过调控NF-κB和P38的活化调控急性脑梗死大鼠脑部炎症反应。目前,脑梗死发生过程中IGF-1是否参与了脑卒中后脑部炎症反应和/或小胶质细胞的凋亡过程,是否与p38MAPK密切相关,无明确结论。本实验通过观察IGF-1动态变化,确定其在急性脑梗死发生发展中是否参与了脑部小胶质细胞的凋亡及其相关机制。以及为急性脑梗死后脑损伤有效控制提供可靠的理论依据。
1 材料和方法
1.1 实验试剂
BCA蛋白定量试剂盒(BOSTER,Prod:AR0146),兔源β-Actin 单克隆抗体(Cell signaling,13E5),兔抗大鼠IGF-1单克隆体抗,兔抗大鼠P38单克隆体抗,兔源p-P38 单克隆抗体(Cell signaling,D3F9),兔抗大鼠caspase-9单克隆抗体,兔抗大鼠caspase-3单克隆抗体均购自美国Cell SignalingTechnology 公司。重组人胰岛素样生长因子-1(rhIGF-1)购自购自美国Sigma公司,水合氯醛购自上海上药新亚药业有限公司。
1.2 急性脑梗死大鼠模型构建
按照常规方法-线栓法[8]通过手术制备大脑中动脉闭塞 (middle cerebral artery occlusion, MCAO)模型。水合氯醛腹腔注射麻醉,剂量为300mg/kg。颈部正中纵行切开,暴露左侧颈总和颈外动脉,分离迷走神经以防损伤。阻断颈总动脉的近心端下微血管血流后,在颈外动脉远心端和近心端之间插入普通尼龙线栓,使一侧大脑中动脉闭塞。120min后拔出线栓,缝合、消毒。假手术组仅分离颈总动脉,随即缝合切口。
1.3 模型评价
模型制备后24h,动物应清醒。随即采用Bederon[8]等的方法通过神经功能评分确定模型是否构建成功。 计分方法如下:(1)提大鼠尾巴,观察右前肢内收、内旋情况,根据轻重程度,评分为1~3分。4分:大鼠身体右侧旋转。(2)大鼠肌张力评定:借助金属网,通过向后轻拉大鼠尾巴观察双侧前肢肌张力,根据轻重程度,评分为0~2分。(3)借助光滑平面,观察侧向推挡阻力。0分:两侧推无显著差别。1分:右侧明显弱于左侧。2分:向右推大鼠向右侧倾倒。(4)大鼠左上眼睑下垂且分泌物增多,评为2分。总分10分。以上评分相加为最后得分,大于3分属于造模成功,低于3分直接剔除。
1.4 实验动物分组及处理方法
8~10周的雄性SD大鼠,体重250~300g,共20只,由哈尔滨医科大学动物中心提供。随机分为3组,6只/组,实验共进行3次。假手术组(Sham):仅分离双侧颈总动脉及剥离迷走神经,随即缝合切口。
手术组术后24h(MCAO-24h):手术后24h按照Bederon[8]法进行评分,>3分为合格模型。
IGF-1处理组(IGF-1):MCAO造模120min 后,再次用水合氯醛(3mg/kg)麻醉大鼠,然后将大鼠俯卧位固定在大鼠脑立体定位仪上,取前囟后0.8mm,中线旁1.8mm,硬膜下3.7mm,将IGF-1(0.2μg/μL)[9]通过10μL微量进样器缓慢注入侧脑室,进针持续 10 min,之后用生理盐水冲洗后缝合并消毒。
1.5 Western blotting检测大鼠脑组织中IGF-1、P38、p-P38、caspase-3 和caspase-9蛋白表达水平
造模72h后立即处死大鼠,取出大脑后用PBS冲洗掉血液,脑组织剪碎后置于10mL离心管中,加入蛋白裂解液5mL,均浆后4℃裂解2h,4℃ 10000g 离心30min,取上清,用BCA 法测定蛋白浓度, -80℃保存。50μg的蛋白总量上样后进行聚丙烯酰胺凝胶电泳,一般采用恒压浓缩胶50v,60min分离胶80v,1h 45min左右。电泳直至溴酚染料前沿下至凝胶末端处,即停止电泳。 转膜60v ,1h 40min后5%脱脂奶粉室温下封闭1h,分别加IGF-1(1:1000) 、P38(1:1000) 、p-P38 (1:1000) 、caspase-9 (1:1000) 、caspase-3 (1:1000 ) 、β-actin (1:2000)抗体,4℃孵育过夜,第2天1:10000稀释辣根过氧化物酶(HRP)标记的二抗,常温,缓慢摇晃1h ,ECL化学发光法显影。采用 Image-J 图像分析软件,计算各指标相对于内参的相对吸光度值。
1.6 细胞因子的检测
固定时间点各组大鼠眼球取血,用双抗体夹心ELISA试剂盒检测外周血血清中IL-1β、IL-6和TNF-α产生水平。酶标仪测定450nm处OD值。根据标准品的标准曲线,应用SoftMax Pro 4.3.1LS软件进行分析,计算细胞因子含量(pg/mL)。
1.7 统计学方法

2 结果
2.1 急性脑卒中大鼠脑组织中IGF-1蛋白的表达水平变化
与Sham组大鼠相比,MCAO-24h组大鼠脑组织中IGF-1蛋白的表达明显下降(1.01±0.20,0.71±0.05)(P<0.05);与MCAO-24h组相比, IGF-1处理组的IGF-1蛋白表达明显增加(0.71±0.05,1.54±0.12)(P<0.05),实验结果证明模型制备及其IGF-1处理均成功,见图1。
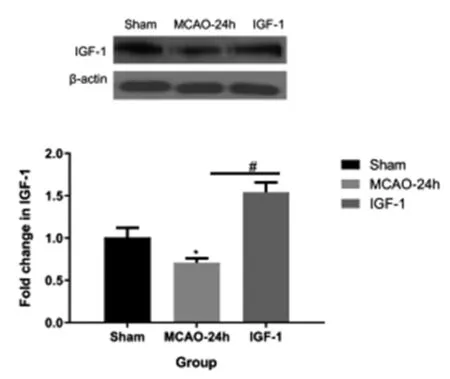
图1 急性脑卒中大鼠脑组织中IGF-1蛋白的表达
2.2 急性脑卒中大鼠外周血中IL-1β、IL-6和TNF-α的水平变化
与Sham组大鼠相比,MCAO-24h组大鼠脑组织中IL-1β、IL-6和TNF-α的分泌水平明显升高(P<0.01;P<0.05);与MCAO-24h组相比, IGF-1处理组IL-1β、IL-6和TNF-α的分泌水平明显减低(P<0.01;P<0.05),见图2。

图2 急性脑卒中大鼠外周血中IL-1β、IL-6和TNF-α的分泌水平
2.3 急性脑卒中大鼠脑组织中p-P38/P38蛋白的表达水平变化
与Sham组大鼠相比,MCAO-24h组p-P38蛋白的表达量明显增高(1.03± 0.06,1.51± 0.24)(P<0.05);与MCAO-24h组相比, IGF-1处理后明显降低了p-P38蛋白表达(1.51± 0.24,0.90± 0.20)(P<0.01),见图3。

图3 急性脑梗死大鼠脑组织中p38和p-p38蛋白表达
2.4 急性脑卒中大鼠脑组织中Caspase3和Caspase9凋亡蛋白的表达水平变化
与Sham组大鼠相比,MCAO-24h组Caspase3和Caspase9的蛋白表达量明显增加(1.10±0.03,1.61±0.06,1.59±0.08)(P<0.05,P<0.05);与MCAO-24h组相比,IGF-1处理明显降低了MCAO大鼠脑组织中Caspase3和Caspase9的蛋白表达(1.61±0.06,1.14±0.05,1.27±0.05)(P<0.05,P<0.05),见图4。

图4 急性脑卒中大鼠脑组织中Caspase3和Caspase9的蛋白表达
3 讨论
脑梗死是一种严重的缺氧缺血性坏死,加速大脑中的神经细胞凋亡[10]。其病理生理机制与氧化损伤,血脑屏障(BBB)破坏,炎症反应和神经元细胞凋亡有关[11]。研究报道,神经元损伤和脑梗死的进展是由于大脑缺血后炎症和细胞凋亡所致。缺氧和炎性细胞因子诱导的细胞应激可以激活p38MAPK信号通路[12]。据报道,脑梗死后p38MAPK被激活,而p38MAPK的下调可减少脑损伤和神经功能缺损,有助于缺血性脑卒中的神经保护[13]。因此,p38MAPK是应激反应中的重要信号通路[14],当p38MAPK被磷酸化激活后,通过调节基因转录同时诱导相关特定基因的表达,引起细胞增殖、分化和各种细胞因子的合成等,例如诱导Caspase8、Caspase9介导的凋亡通路,进而引起一系列的生物学效应[15]。然而,神经细胞快速凋亡是脑梗死的重要表现,这可能是通过诱导凋亡相关因子如半胱氨酸蛋白酶Caspase通过切割gasermin(GSDMS)的氨基端和羧基端连接体从而调控细胞凋亡[16]。Caspase-9是Caspase蛋白酶家族成员,是凋亡信号传导的主要执行者。一旦激活,启动子Caspase-9激发Caspase-3,随后诱导其形态和功能变化加速细胞凋亡。研究表明,Caspase-9和Caspase-3在脑梗死后大脑神经细胞凋亡中具有重要的调节作用[17]。由于Caspase-9是细胞线粒体凋亡启动因子[18]Caspase-3是细胞凋亡的效应性蛋白,因此P38MAPK激活后能够加剧细胞的凋亡[19]。与相关文献报道相一致,本实验结果发现,急性脑卒中大鼠外周血中炎症性细胞因子IL-1β、IL-6和TNF-α的分泌水平显著增加,p-P38MAPK蛋白表达明显增加,同时Caspase-3和Caspase-9表达也呈现明显增加。此结果说明急性脑卒中诱导了炎性细胞因子的分泌,激活了 P38MAPK信号通路,明显诱导了大脑神经细胞的凋亡。
IGF-1是重要的神经保护多肽,结构与胰岛素类似,对神经元缺血缺氧具有一定的保护作用。研究表明,急性脑梗死患者血清中IGF-1明显降低,而高水平的IGF-1有助于促进机体康复,因此,IGF-1参与脑组织损伤修复,利于脑组织缺氧症状的缓解[20]。IGF-1对大脑细胞生长和细胞增殖至关重要[21,22]。过表达IGF-1的转基因小鼠在大脑发育期间显示皮质体积和细胞数量增加[23]。报道称IGF-1具有促进大脑细胞有丝分裂的作用[24]。脑缺血损伤后,神经干细胞的细胞因子免疫网络被激活,上调和表达大量的细胞因子。IGF-1 通过胶质细胞的活化表达上调,神经干细胞、神经元和胶质细胞在损伤区域通过 IGF-1 参与大脑的损伤修复[25]。本实验结果发现,IGF-1处理后明显降低了急性脑卒大鼠外周血中炎症性细胞因子IL-1β、IL-6和TNF-α的分泌水平,抑制p-P38MAPK蛋白表达,同时Caspase-3和Caspase-9表达也呈现明显降低。此结果说明IGF-1明显减低了急性脑卒中大鼠炎性反应和脑神经细胞的凋亡,发挥了对急性脑卒中大鼠的脑保护作用。
综上所述,IGF-1是参与急性脑梗死发生后脑组织细胞凋亡重要因子。其作用机制与其调控p38MAPK信号通路,阻断p-p38的活化,进而抑制下游凋亡因子Caspase-3和Caspase-9活化,起到保护大鼠脑组织神经细胞的作用。

