基于细胞水平的甜度定量测定方法及其在卷烟中的应用
陈微,凌军,朱保昆,者为,陈兴,苏莉,颜克亮*
1 云南中烟工业有限责任公司技术中心,云南省昆明市五华区红锦路367号 650231;2 华中科技大学生命科学与技术学院,分子生物物理教育部重点实验室,湖北省武汉市洪山区珞喻路1037号 430074
甜味化学感受分子机制的研究对食品工业发展及食用者的健康具有十分重要的影响和意义[1-4]。人的甜味受体是由T1R2和T1R3组成的异源二聚体蛋白复合体(T1R2/T1R3),每一个受体都包含了一个T1R2亚基及一个T1R3亚基[5]。T1R2和T1R3都是C类G蛋白偶联受体,拥有7个跨膜结构域。甜味信号的传导需要下游的G蛋白、PLCβ2及TRPM5等相关蛋白的介导,进而引起下游PKC、Ca2+、PKA等相关分子的活化。研究发现甜味受体T1R2和T1R3可以通过结合GLP-1来控制体内葡萄糖的平衡和葡萄糖转运子的激活。这些相关分子是可供检测的下游信号分子[6-11]。
卷烟抽吸时的甜感能明显提升舒适性,在卷烟产品开发领域,如何使卷烟具有更好的甜感是一直是相关研发人员关注的研究方向。通常以卷烟感官质量评吸为主,一定程度上结合化学成分分析进行相关开发工作。感官质量评价主要依靠人的感官评吸,由于香气物质的复杂性、评吸人员的个体、阅历等差异,客观上可能对感官评价结果带来差异。
目前检测甜度的方法主要分为两大类[12-16],分析化学检测方法和生物学检测方法。其中分析化学检测方法主要有高效液相色谱法、电子舌检测方法、甜度计检测方法、分光光度计检测方法;生物学方法有人工测评等。分析化学方法检测可以精准地检测到糖分含量,但无法在生理水平上定量甜度;生物学检测方法虽然可以在生理水平上定量甜度,但是人工测评的主观性较强、人的口味有差异,无法精确定量甜度。这两种方法都未能相对直观、定量地从生理水平对卷烟添加物或卷烟烟气进行甜感评价。因此本文建立一种细胞水平上的甜度定量测定方法,并用该方法通过测定烟用香精香料及卷烟产品烟气的相对甜度值对其甜感进行评价。
1 材料与方法
1.1 主要仪器、试剂与材料
滇南特色香料植物5种:密蒙花(BuddlejaofficinalisMaxim.)、三七花(Panax notoginseng(Burk.) F. H. Chen ex C. Chow)、余甘子(PhyllanthusemblicaLinn.)、拐枣(HoveniaacerbaLindl.)、百香果(PassifloraeduliaSims)。
葡萄糖(天津市致远化学试剂有限公司,分析纯)、三氯蔗糖(广东翁江化学试剂有限公司,分析纯)、PBS(Medicago, 瑞典)、钙离子荧光染料(HARVEY,美国)、DMSO(天津市永大化学试剂有限公司,分析纯)、Fluo-4 AM(HARVEY,美国)、人胚肾细胞系(HEK293)(CCTCC,武汉)、真核细胞表达载体(pcDNA3.0)及质粒(赛默飞世尔公司,上海)、Flex缓冲液(实验室自制)、T1R2和T1R3受体均为实验室自建。
PTI快速离子成像系统(EasyRatioPro)、FV1000共聚焦显微镜(Olympus)、DMi8荧光显微镜(Leica)。
1.2 方法
1.2.1 荧光标记重组甜味素受体质粒及细胞系构建
细胞系构建时所用的T1R2(taste receptor,type 1,member 2)的ID号是NM_152232,其基因长度为2520 bp;T1R3(taste receptor,type 1,member 3)的ID号是NM_152228,其基因长度为3475 bp;均来自人类(Homo sapiens)。
选择真核细胞表达载体(pcDNA3.0),T1R2添加his标签(标签序列:CATCATCATCATCATCAT),T1R3添加flag标签(标签序列:GATTACAAGGAT GACGACGATAAG),构建甜味素受体T1R2/T1R3的质粒。将所构建的重组质粒通过电转方式转染人胚肾细胞HEK293中,筛选出转染带his标签的T1R2质粒和带flag标签的T1R3质粒的细胞系。
1.2.2 小分子标签的重组甜味素受体细胞系特征鉴定
用共聚焦显微镜观察T1R2-his/T1R3-flag细胞系,确定小分子标签的重组甜味素受体蛋白在细胞中的表达定位;以PTI钙成像技术检测小分子标签的重组甜味素受体细胞系对糖刺激应答后受体下游信号分子—钙离子的响应。
1.2.3 方法验证
以稳转T1R2-his/T1R3-flag的单克隆细胞(稳转T1R2/T1R3细胞)为工具,利用钙离子荧光检测技术,建立可以标准化检测样品甜度的体系。以PBS刺激作为对照,以葡萄糖(终浓度为300 mmol/L)和三氯蔗糖(终浓度为10 mmol/L)作为实验组,将带已染色的T1R2-his/T1R3-flag细胞玻片浸润在PBS中,选择单个细胞,从0 s开始,在200000 ms时分别滴加终浓度葡萄糖和三氯蔗糖溶液刺激,检测胞质内钙离子的变化。
1.2.4 相对甜度测定与计算
不同浓度葡萄糖溶液(浓度为50 mmol/L~250 mmol/L)处理稳转T1R2/T1R3细胞能引起胞质钙离子荧光信号的变化,以HEK293细胞为阴性对照,荧光变化比值为正值,且荧光变化比值与溶液中葡萄糖浓度表现出正相关。相对甜度值计算公式为:
相对甜度值=(RT1Rs样品-RCON样品)/(RT1Rs(葡萄糖)-RCON(葡萄糖))
其中,RT1Rs为处理稳转T1R2/T1R3细胞后的荧光变化值,Rcon为HEK293细胞(阴性对照)的荧光值,Rsweet(相对甜度值)为二者相差值。
1.2.5 卷烟烟气相对甜度值测定及对比分析
选用3个云烟(云烟A、B、C)及20个其他规格卷烟(QT1~QT20)。收集1支卷烟充分燃烧产生的主流烟气,充分吸收于10 mL Flex缓冲液,作为待测烟气溶液样本。分别检测100 μL烟气溶液处理HEK293细胞和稳定表达T1R2/T1R3的HEK293细胞后胞内Fluo-4荧光强度,得出荧光变化比值Rcon,RT1Rs和Rsweet。以150 mmol/L葡萄糖的荧光变化比值Rsweet为标准单位,得到测试样品相对葡萄糖的甜度值。
将23个卷烟所测定的相对甜度值与卷烟感官评价结果(《卷烟中式卷烟风格感官评价方法》 YC/T 497—2014中“口味评价”方法)进行对比分析。
1.2.6 特色香料相对甜度值测定及对比分析
1.2.6.1 特色香料制备
采用不同工艺制备特色香料:密蒙花经超声波辅助乙醇提取,浓缩得到浸膏,再经乙醇萃取精制得密蒙花净油;三七花/余甘子经水蒸汽蒸馏,过滤减压浓缩得三七花/余甘子提取物;拐枣经超声波辅助乙醇提取,过滤浓缩得拐枣浸膏;百香果(鲜)经去皮、打浆、过滤浓缩得到百香果浓缩汁。
将特色香料依次用Flex缓冲液稀释100倍,部分样品在稀释100倍过程中出现沉淀,针对此类样品,先用DMSO作5倍稀释,再用Flex缓冲液稀释20倍。检测100倍稀释的样品缓冲液处理后细胞内钙离子荧光染料Fluo-4 AM的荧光发射强度,收集并处理荧光强度数据,得出荧光变化比值。
1.2.6.2 添加特色香料的卷烟样本相对甜度值测定及对比分析
将前述5个特色香料样品中分别添加到云烟(B)烟支中,添加量为1 µL/支,制成待检烟支。参照1.2.4中方法制备得到烟气溶液、检测样品甜度值。将测得的相对甜度值与卷烟感官评价结果(《卷烟中式卷烟风格感官评价方法》 YC/T 497—2014中“口味评价”方法))进行比较分析。
2 结果与讨论
2.1 小分子标签的重组甜味素受体细胞系的构建
2.1.1 荧光标记重组甜味素受体质粒构建
选择使用的载体为真核细胞表达载体,T1R2添加his标签,T1R3添加flag标签。成功构建了甜味素受体T1R2/T1R3的质粒。
构建的质粒图谱如图1所示。
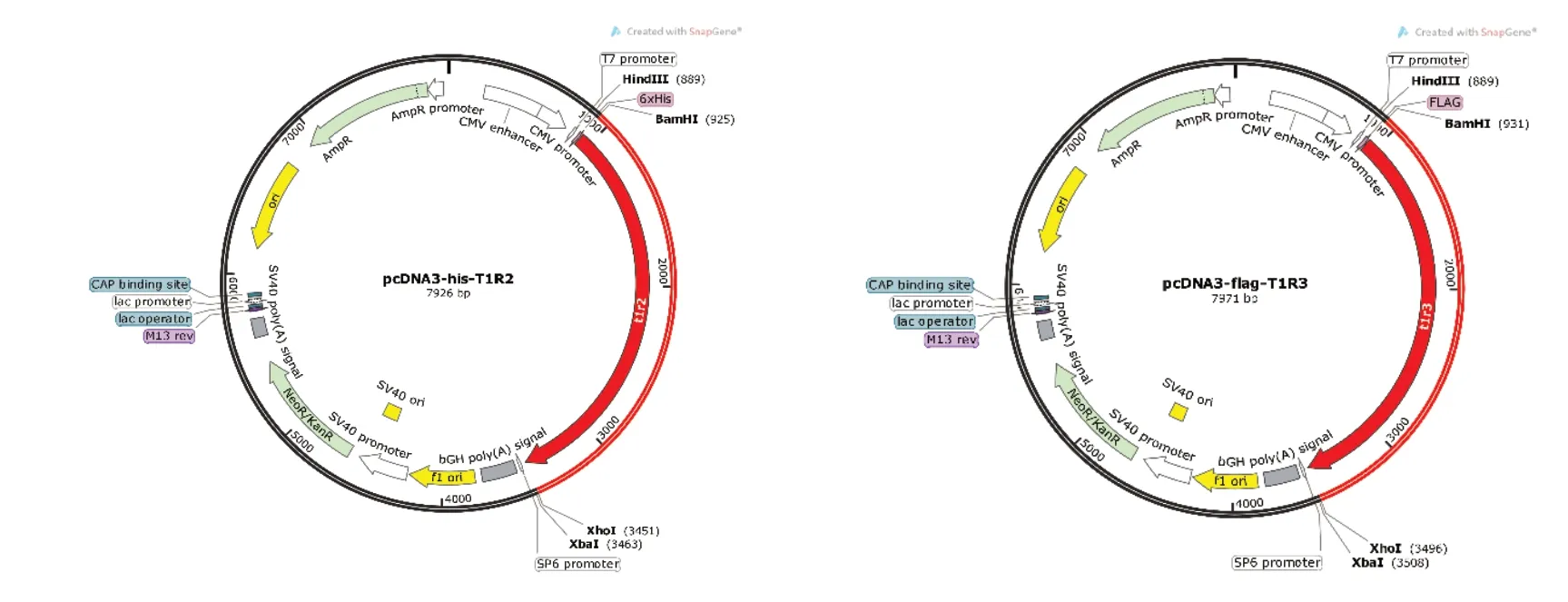
图1 构建的质粒图谱Fig. 1 Constructed plasmid profile
2.1.2 受体细胞系构建
将重组质粒通过电转方式转染人胚肾细胞HEK293中,所转入重组质粒的细胞能表达红色及绿色荧光蛋白(见图2),表明重组质粒转入HEK293细胞并稳定表达受体蛋白。

图2 重组甜味受体表达情况观察Fig. 2 Expression of recombinant sweet receptor
2.1.3 小分子标签的重组甜味素受体细胞系特征鉴定
(1)显微鉴定。共聚焦显微镜观察T1R2-his/T1R3-flag细胞系,结果如图3所示。可见在N端连接his标签蛋白的T1R2受体蛋白及在N端连接flag标签蛋白的T1R3受体蛋白主要分布在细胞膜上。当表达量过大时,细胞质中也会有大量融合蛋白出现。同时,显微镜下观察的结果表明T1R2和T1R3能够同时在HEK293细胞中大量表达。

图3 小分子标签的重组甜味受体蛋白在细胞中的表达Fig. 3 Expression of small molecule labeled recombinant sweet receptor protein in cells
(2)钙离子浓度变化。实验结果如图4所示。对照组中,T1R2-his/T1R3-flag细胞在PBS的刺激下呈现出不规则变化,在仪器检测结果中,胞质内钙离子峰值的最高值和最低值在200以内。胞质内钙离子的变化总体趋于平衡。

图4 胞质内钙离子的变化Fig. 4 Changes of intracellular calcium ions
实验组一中,T1R2-his/T1R3-flag细胞在葡萄糖溶液(终浓度为300 mmol/L)加入之后,胞质内钙离子浓度立刻上升,达到最高峰值后,胞质内钙离子浓度下降。在仪器检测结果中,胞质内钙离子峰值的最高值和最低值相差800左右。
实验组二中,T1R2-his/T1R3-flag细胞在三氯蔗糖溶液(终浓度为10 mmol/L)加入之后,胞质内钙离子浓度在500000 ms时开始上升,达到最高峰值后,胞质内钙离子浓度下降。在仪器检测结果中,胞质内钙离子峰值的最高值和最低值相差700左右。
综合以上结果可见:将实验组与对照组相比,在加入葡萄糖溶液后,T1R2-his/T1R3-flag细胞胞质内的钙离子浓度立刻(或延迟)呈现出先升高后下降的趋势。这个结果与对照组差异明显,这表明用一定浓度的葡萄糖刺激T1R2-his/T1R3-flag细胞,会激活膜上的甜味受体T1R2/ T1R3,并引起下游信号分子—钙离子的变化。
2.1.4 高表达甜味素受体细胞系对糖的应答体系的鉴定和优化
实验结果表明,不同浓度的葡萄糖溶液处理稳转T1R2/T1R3细胞能够引起胞质钙离子荧光信号的变化(见图5),HEK293及T1R2/T1R3细胞荧光信号测定值见图6-A。以HEK293细胞为阴性对照,荧光变化比值为正值(见图6-B),且荧光变化比值与溶液中葡萄糖浓度表现出正相关性,表明该测定方法中T1R2/T1R3甜味受体能够特异性响应甜味化合物,并能够通过测定荧光变化比值对甜味化合物进行相对定量。

图5 150 mmol/L 葡萄糖溶液处理HEK293 细胞和稳转T1R2/T1R3 细胞的荧光变化Fig. 5 Fluorescence changes of HEK293 cells treated with glucose solution (150 mmol/L) and stable T1R2/T1R3

图6 不同浓度葡萄糖溶液处理HEK293 细胞和稳转T1R2/T1R3 细胞的荧光变化比值Fig. 6 Fluorescence change ratio of HEK293 cells treated with different concentrations of glucose solution and stable T1R2/T1R3 cells
2.2 利用高表达甜味受体细胞系定量检测卷烟样本相对甜度值
2.2.1 高表达甜味受体细胞系检测甜味受体对卷烟样本的应答
由检测结果可见,23 种卷烟样品的相对甜度值分布在1.27 ~4.23 之间,不同规格卷烟相对甜度值有所差异,最高测定值为云烟(A),最低值为QT12。与感官评价结果(口味风格甜味分值)相比具有较好的一致性(见图7),表明本方法可用于测定卷烟样本的相对甜度值,并能较好地反映甜度的变化。

图7 23 种卷烟样本相对甜度值与口味风格(甜味)分值比较Fig. 7 Comparison of relative sweetness value and taste style(sweetness) score of 23 cigarette samples
2.2.2 高表达甜味受体细胞系检测甜味受体对添加特色香料卷烟样本的应答
提取制备得到5 个特色香料,分别添加于云烟(B)烟支中,添加量为1 µL/支,应用前述建立的细胞水平定量测定方法进行相对甜度值测定;并组织评吸人员对其进行感官评价。结果如图8、图9 和表1 所示。

图8 特色香料与卷烟烟气相对甜度值比较Fig. 8 Comparison of relative sweetness value of characteristic flavor and cigarette smoke

图9 卷烟烟气相对甜度值与口味风格(甜味)分值比较Fig. 9 Comparison of relative sweetness value and taste style(sweetness) score of cigarette smoke

表1 特色香料及应用于云烟(B)相对甜度值和感官评价结果Tab. 1 Relative sweetness of characteristic flavor and Yunyan (B)smoke and sensory evaluation of Yunyan(B) with corresponding characteristic flavor
从细胞水平定量检测特色香料相对甜度值结果来看,以百香果浓缩汁相对甜度最高(S4 = 10.006),其次是拐枣浸膏(S3 = 8.078),以三七花提取物相对甜度最低(S25 = 0.136);从添加特色香料的卷烟烟气相对甜度值来看,添加百香果浓缩汁的卷烟烟气样品相对甜度最高(S4-烟气 = 2.18),其次是添加拐枣浸膏(S3 = 2.14)和余甘子提取物(S10 =2.14)的卷烟样本,与未添加提取物的卷烟烟气相对甜度值(2.10)相比均有不同程度的提高。
与卷烟感官评吸结果对比来看:添加百香果浓缩汁(S4)烟气甜度增加明显,口腔回甜明显;添加拐枣浸膏(S3)的卷烟增加了果香香韵,较为协调,甜感较好;添加余甘子提取物(S10)的卷烟口腔甜润,烟气柔和,但烟气质感略有下降;添加密蒙花(S25)的卷烟余味略甜,口腔和喉部刺激刺激增加。
可见细胞水平定量检测特色香料、添加特色香料的卷烟烟气两组相对甜度值结果与卷烟感官评价结果具有一致性;5 种特色香料中,以百香果整体应用效果最好,在增加甜度的基础上,没有其他负面的效应。
3 结论
本文成功构建了一种细胞水平定量检测相对甜度值的方法,应用于特色香料及卷烟烟气甜度测定,其结果与卷烟感官评吸结果具有一致性,表明该方法可用于以增加甜感为目的的卷烟烟用香精香料评价及烟气甜感评价;同时,本文筛选出一种能获得较好烟气甜感与口腔甜感的烟用香料——百香果提取物。

