海洋假交替单胞菌生物膜产ROS特性研究
吕 菁 萍, 李 泽 龙, 张 鹤 睿, 王 竞
( 大连理工大学 环境学院, 辽宁 大连 116024 )
0 引 言
目前,对于海洋产ROS细菌的研究仅集中在游离态菌体,生物膜形态对海洋产ROS细菌的影响鲜见报道.在实际海洋环境中,存在着大量可供微生物附着的载体,如海洋礁石、海洋甲壳动物、藻类残骸以及由地质演化、大气沉降、人类活动等形成的一些碳质颗粒物等[9].而海洋微生物更倾向于在载体表面附着,并形成生物膜,这些生物膜往往在海洋环境中发挥着重要作用[10-11],被认为是海洋环境中最普遍的生命形式[12-13].以生物膜形式存在的微生物有着更广泛的信息交流及更精密的调控机制,在生物活性等方面均有所提高[14].因此,研究海洋细菌生物膜产ROS的特性可以加深对海洋无光环境中生物源ROS的了解.
1 材料与方法
1.1 实验材料
实验所用的海洋假交替单胞菌GCY从中国大连市黑石礁海域(北纬38°52′,东经121°33′)沉积物中分离并富集培养得到,在整个实验过程中用到的均是纯培养菌体.
实验所用培养基均用人工海水配制[17],并调节培养基初始pH至8.0左右.酵母浸粉培养基配方为酵母浸粉6 g·L-1;2216E培养基配方为酵母浸粉1 g·L-1,蛋白胨5 g·L-1.
本实验选用泡沫炭载体作为碳质材料的代表,实验所用药品均购自阿拉丁化学试剂有限公司.
1.2 生物膜的培养及表征
1.2.1 生物膜的培养 生物膜的培养方法参照前人实验,并在此基础上作出了改进[18-19].将泡沫炭剪成1 cm×1 cm×2 cm的小块,用无菌人工海水清洗数次,并用烘箱烘干灭菌.将无菌炭块固定在支架上,放置于装有100 mL酵母浸粉培养基的250 mL锥形瓶中,将活化后的菌体接种到泡沫炭上.在恒温摇床内培养96 h,得到稳定生物膜.
1.2.2 生物膜生物量的测定 载体上生物量的测定采用超声分离法[19-20],并加以改进:首先在无菌操作台中,将挂膜后的泡沫炭取出,并轻轻冲洗以去掉弱吸附微生物,超声预处理30 min将吸附于载体上的微生物转到100 mL无菌生理盐水中,然后通过紫外分光光度计在600 nm下检测微生物量.依据干质量曲线换算可得膜上微生物干质量:
y=1.05x+0.240 04;R2=0.997
1.2.3 生物膜形貌表征 采用扫描电子显微镜(SEM)来对微生物生物膜的形貌与形态进行表征,样品制备过程如下:用0.5 mol·L-1无菌PBS溶液洗涤生物膜2~3次,再使用2.5%戊二醛缓冲溶液(pH=7.2)固定24 h,用无菌PBS溶液清洗炭块2~3次,加入不同质量分数的乙醇溶液(15%、30%、50%、70%、80%、90%和100%)梯度脱水,每个梯度预脱水处理15 min,再将样品放入真空冷冻干燥箱里以40 ℃干燥3 h.干燥后的样品固定在导电胶带上进行喷金处理.在扫描电子显微镜下,观察样品表面的形貌与形态.
1.2.4 胞外聚合物的测定 使用碱提法,取10 mL 菌液,离心(10 000 r·min-1,20 min)后得到的上清液即为溶解态胞外聚合物(EPS).再向沉淀中加入7.14 mL超纯水和0.06 mL的36.5%甲醛溶液,反应1 h后再向体系中加入2.86 mL的1 mol·L-1NaOH溶液提取2 h,在10 000 r·min-1下离心分离20 min后将上清液过膜,即为结合态EPS.分别对两组样品中的多糖以及蛋白质进行测量.多糖测定使用苯酚-硫酸法,蛋白质测定使用考马斯亮蓝法.
1.3 ROS及相关酶的测定
为探究GCY生物膜与游离菌体GCY产ROS的差异,将GCY生物膜设为实验组,游离菌体GCY为对照组,取胞外液测定其ROS产量,及L-氨基酸氧化酶(L-amino acid oxidase,LAAO)、铁载体等胞外活性物质活性.对生物膜进行超声剥落,与游离菌体进行对照,比较代谢相关酶的活性变化.
1.3.2 代谢活性的测定 脱氢酶活性(dehydrogenase activity,DHA)的检测采用TTC法[24].电子传递系统活性(electron transport system activity,ETSA)的检测采用INT还原法[25-26].
1.3.3 L-氨基酸氧化酶活性 向胞外液中加入等体积的5 g·L-1亮氨酸溶液作为反应底物,在25 ℃条件下反应30 min,测定反应前后H2O2浓度的差值,其差值即为30 min内产生的H2O2.
1.3.4 铁载体 铁载体的检测使用铬天青CAS法,将配制好的CAS检测液与胞外液样品等体积混匀后,于4 ℃下放置30 min,再使用紫外分光光度计在630 nm下测定吸光度.以酵母浸粉培养基作为空白对照,排除培养基成分的干扰.
2 结果与讨论
2.1 生物膜的表征
菌株GCY为海洋假交替单胞菌,该菌属的许多菌株已被证实具有形成生物膜的能力[27].通过实验,结合菌株干质量曲线计算可知单位体积泡沫炭上的微生物干质量为22 mg·cm-3,将制备好的样品按照前文所述方法,使用SEM观察其表面形貌.可以明显看出,菌体与其分泌的胞外聚合物覆盖在碳材料表面,生物膜系统趋于稳定(图1).

图1 GCY生物膜SEM表征Fig.1 SEM observation of GCY biofilm
EPS是由微生物代谢所分泌的高分子聚合物,如蛋白质、多糖等.EPS将微生物包埋在絮体中,是微生物生物膜的重要组成.因此,对GCY生物膜及游离菌体GCY的EPS进行检测.
多糖是具有黏性的大分子聚合物,在生物膜的形成过程中起重要作用.生物膜EPS和游离菌体EPS的多糖含量分别为313.55 mg·L-1及220.85 mg·L-1(图2),由此可以得出,碳质载体的存在会刺激微生物分泌多糖类物质,有助于微生物在碳质载体表面的初始黏附并形成稳定生物膜.蛋白质是EPS的重要组分,生物膜EPS及游离菌体EPS中蛋白质含量分别为310.41 mg·L-1及254.85 mg·L-1(图2).生物膜EPS中蛋白质含量的提升,暗示其可能具有更强的生物代谢活性.两体系内EPS以结合态为主,均占到总EPS质量的90%以上.生物膜总EPS含量高于游离菌体,说明以生物膜形式生长的菌体具有更好的抵御外界不良环境的能力.
2.2 生物膜与游离菌体ROS产量
为探究生物膜与游离菌体的ROS产量差异,分别对两体系内的ROS进行检测.菌株GCY可以产生胞外H2O2,这一现象已被Gu等[8,17]报道.生物膜体系的H2O2产量总体上要高于游离菌体体系.有趣的是,GCY生物膜可以在菌株生长的对数期生成较高浓度的H2O2,在1 μmol·L-1以上,18 h以及24 h的生物膜体系H2O2产量可分别达到游离菌体体系的3.10倍和1.94倍(图3).而之前的研究往往在对数期末期或稳定期开始检测到H2O2的生成[17,24],生物膜的存在会使H2O2的产生提前.
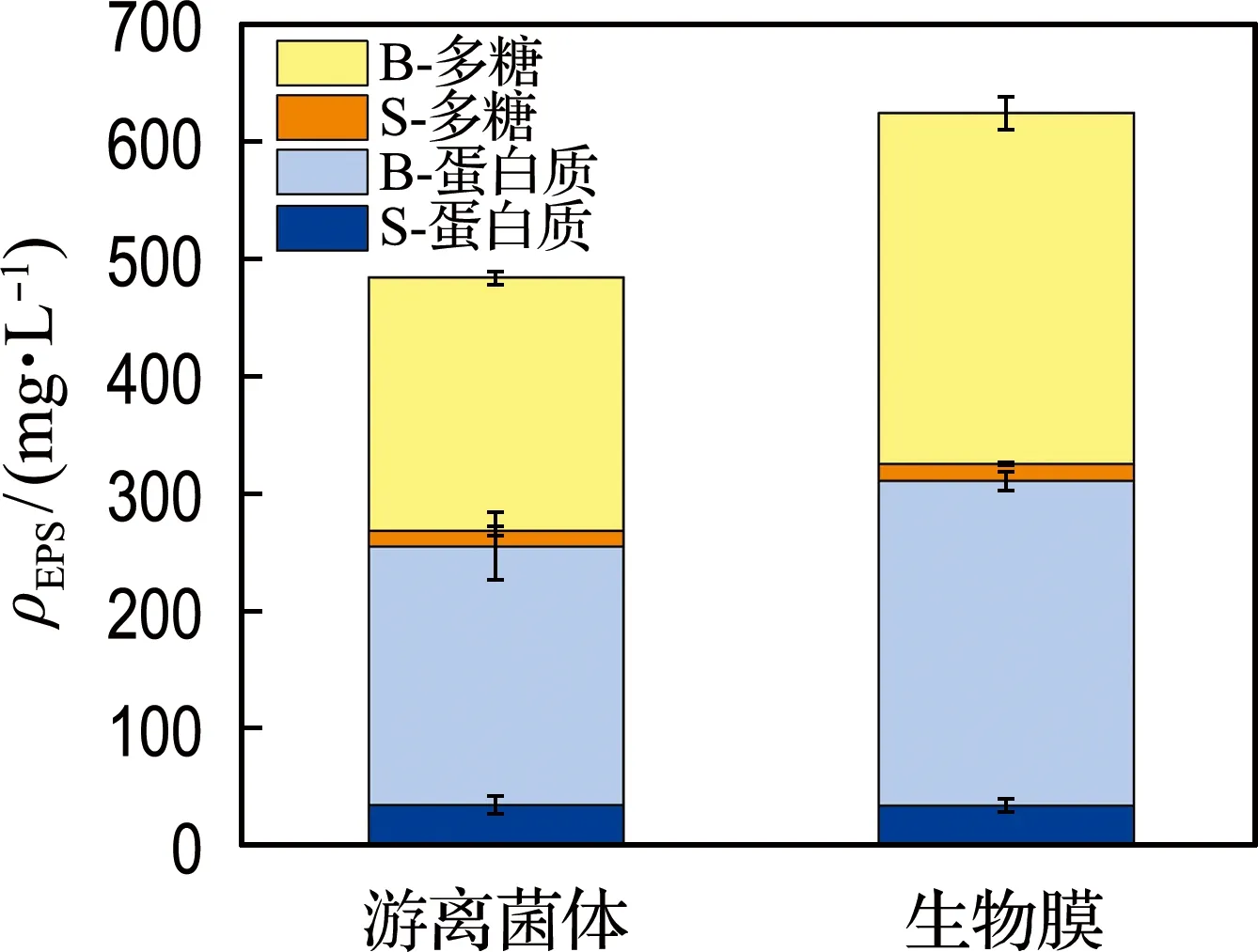
图2 生物膜及游离菌体EPS分泌Fig.2 EPS production of biofilm and free cells
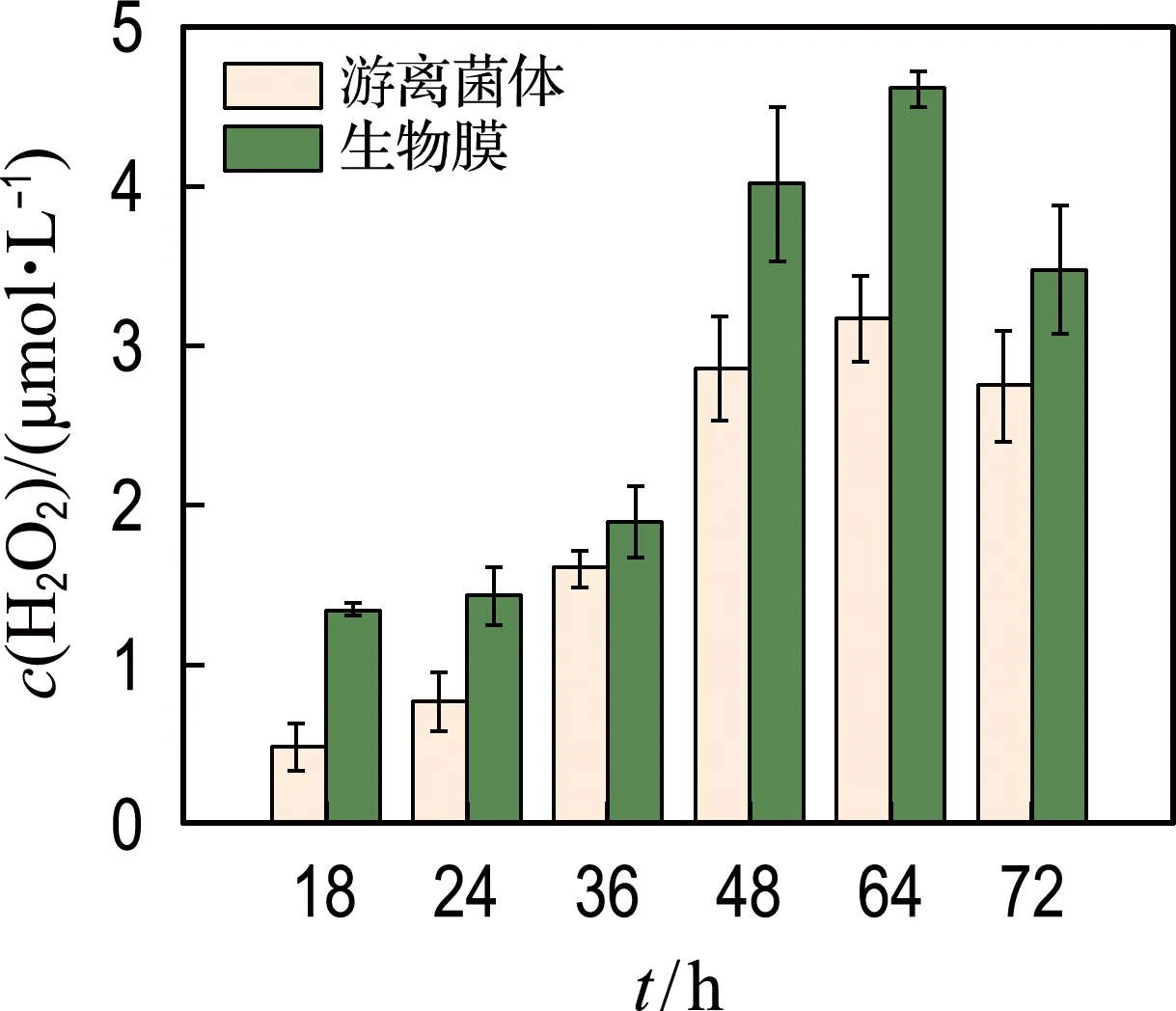
图3 菌株胞外H2O2产量Fig.3 The generation of extracellular H2O2
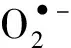
(a) 对数期
2.3 生物膜ROS形成机理分析
本课题组已经在GCY的基因组中发现了基因lodA,并证实了其编码的L-氨基酸氧化酶参与了菌株GCY生成H2O2的过程[24].因此,本实验对胞外体系的L-氨基酸氧化酶酶活性(以H2O2为基准)进行测定.菌株GCY在生长的各个阶段均检测到L-氨基酸氧化酶酶活性,在稳定期48 h时,生物膜体系的L-氨基酸氧化酶酶活性可达游离菌体体系的1.33倍.值得注意的是,在对数期24 h 时,生物膜体系内也检测到了较高的L-氨基酸氧化酶酶活性,这也解释了生物膜体系中H2O2产生提前的原因(图6).
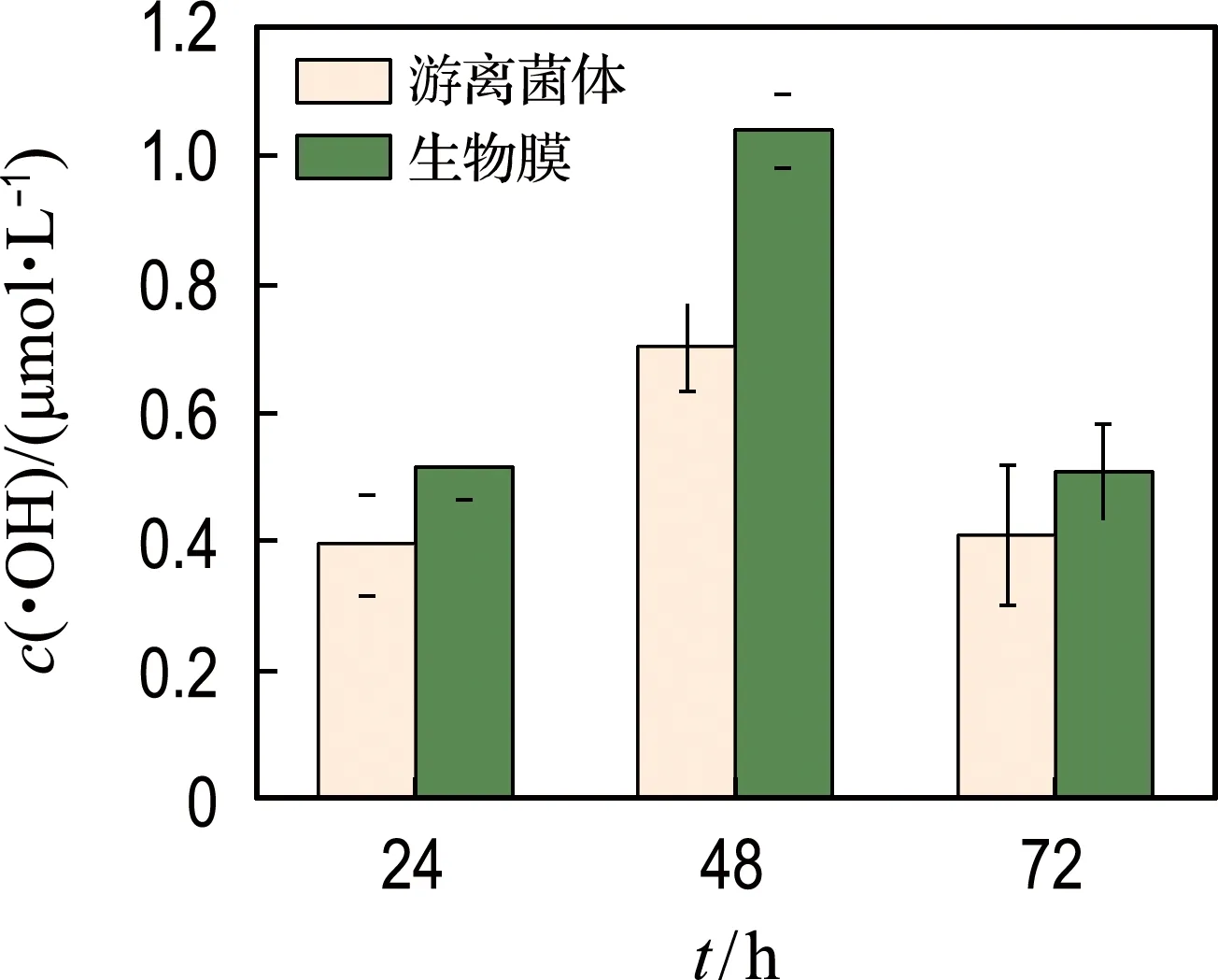
(a) 胞外•OH产量
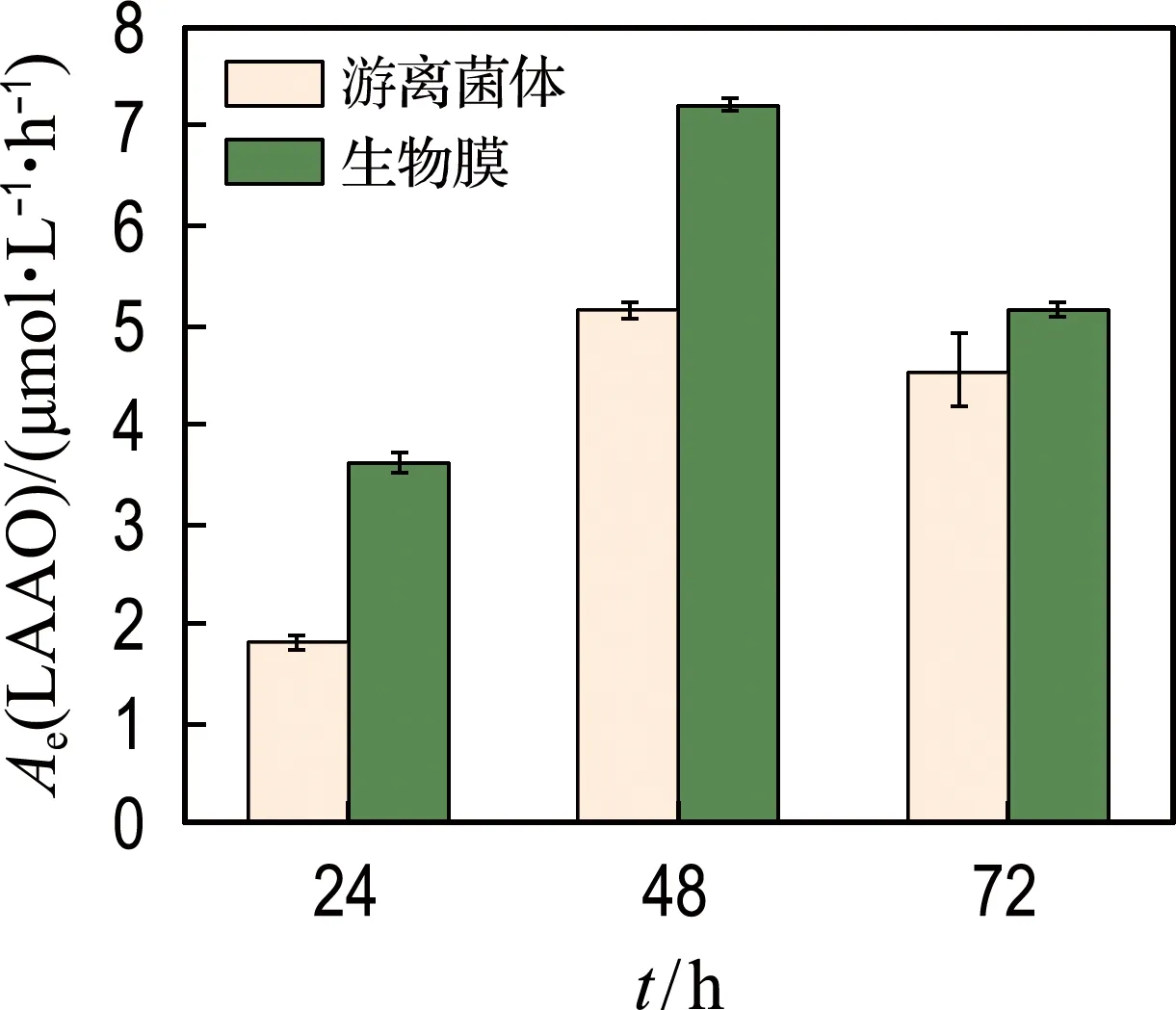
图6 L-氨基酸氧化酶活性Fig.6 L-amino acid oxidase activity
ETSA可以表示经氧化呼吸链传递给最终电子受体的电子数量,进而指示微生物的代谢活性.在菌株生长的整个阶段,生物膜上微生物的ETSA 均要显著高于游离菌体体系,最高可达游离菌体体系的1.74倍.可见,生物膜上微生物的代谢活性有所提高,尤其是呼吸链电子传递方面的代谢活性(图7(a)).
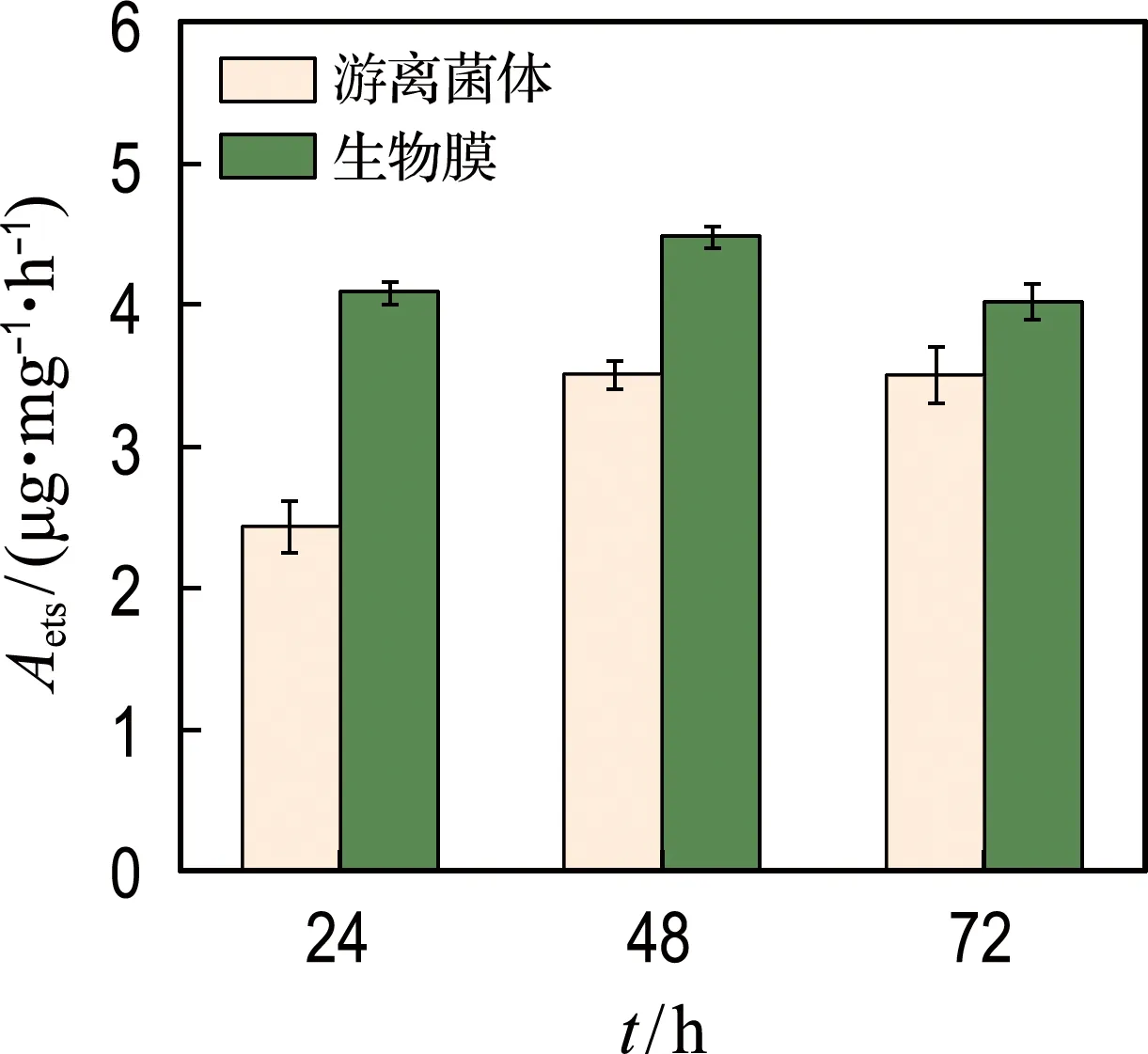
(a) ETSA
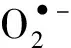
3 结 语