葡萄花色苷的组成及生物合成研究进展
朱磊,李新月,胡禧熙,刘云清,于昕楚,武欣,臧延青,汤华成
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.黑龙江省农产品加工工程技术研究中心;3.国家杂粮工程技术研究中心;4.黑龙江省农科院大庆分院)
花色苷是植物色素中最重要的一类,它存在于高等植物的器官当中,主要将红、橙、蓝、紫等不同的颜色呈现出来,其中,花和果实中的花色苷最为丰富。自然界中存在着种类繁多的花色苷,目前已经从植物中鉴定出了600余种花色苷化合物[1]。这些天然的花色苷是合成食品色素的理想替代品,具有巨大的潜力,而葡萄是花色苷的主要来源之一。
葡萄花色苷的母核为花色素,由于花色素在自然界中极其不稳定,需要经过一系列的修饰作用形成不同种类的花色苷及其衍生物[2]。这些花色苷的生物合成途径可以分为两个阶段:第一阶段为苯丙烷类代谢途径,第二阶段为类黄酮途径,整个合成过程受内部因素(结构基因、调节基因和MYB单倍体)和外部因素(植物激素和环境)的调控。重点阐述不同花色苷及其衍生物的组成及生物合成,为今后葡萄中花色苷的相关研究提供参考。
1 葡萄花色苷的结构及分布
花色苷母核结构为花色素,由一个吡喃环(C)和两个芳香环(A和B)组成(图1)[3],主要包括花翠素(Delphinidin,Dp)、花青素(Cyanidin,Cy)、甲基花翠素(Petunidin,Pt)、甲基花青素(Peonidin,Pn)、二甲花翠素(Malvidin,Mv)和花葵素(Pelargonidin,Pg)(表1)[4]。

表1 六种基本花色素Table 1 Six primitive anthocyanidin
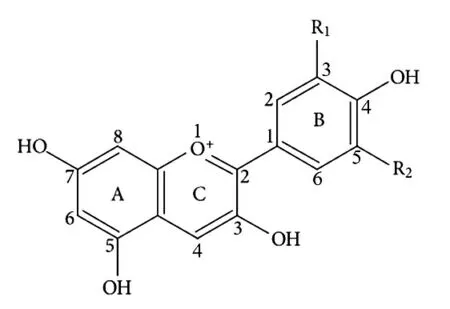
图1 花色素的基本结构Fig.1 General structure of anthocyanin
葡萄花色苷受到严格的遗传控制,在不同葡萄品种中分布差异很大。Christophe等[5]研究表明,花色苷只在有色葡萄品种中检测到,白葡萄品种尚未检测到,且在黑色品种的果实中花色苷占总酚含量的42%~51%,占主导地位,红色品种的葡萄花色苷约占总酚含量的21%左右。一直以来,都认为白葡萄中没有花色苷的存在,在分析化学和生物学中,这一定性特征被用来定义白葡萄与有色葡萄的区别。然而,Andreasilva等[3]提出白葡萄品种“西利亚”可以酿制出粉红色葡萄酒的原因是葡萄皮和果肉中存在少量花色苷。随着检测技术的发展,Arapitsas等[6]通过色质联用技术在白葡萄品种“霞多丽”“长相思”和“雷司令”的果皮中检测出来痕量的花色苷,这一观点被证实。
2 葡萄花色苷的修饰作用
2.1 羟基化作用
葡萄花色苷的A、B、C环上都可以发生不同程度的羟基化。根据B环上羟基化的程度不同,可将花色苷分为单羟基化花色苷(含Pg的花色苷)、二羟基化花色苷(含Cy、Pn的花色苷)和三羟基化花色苷(含Pt、Dp、Mv的花色苷)。一方面,羟基化会使花色苷变得不稳定,但同时会让花色苷的生物活性增强[7]。另一方面,B环羟基化程度增强,花色苷的蓝色色调会增加[8]。
2.2 甲氧基化作用
花色苷可以分为非甲氧基化(含Dp、Pg、Cy的花色苷)和甲氧基化(含Pn、Pt、Mv的花色苷)两种类型。甲氧基化作用发生在B环C3和C5位,随着甲氧基化的增强,花色苷的稳定性和红色色调都会有所加强[9]。不同品种葡萄中甲氧基化花色苷所占总花色苷的占比各不相同,如欧亚种葡萄中的“天赐”“马瑟兰”“美乐”等高达90%以上[10],而北美种群的一些葡萄品种不到30%[11]。
2.3 糖基化作用
在葡萄中,糖基通过C3位或C3、C5位的糖苷键与花色素相连,分别形成花色素单糖苷和花色素双糖苷[11]。葡萄花色苷中最常见的糖基是单糖,绝大多数为葡萄糖[12]。糖基化作用可以提高花色素固有的不稳定性,Kim等[13]研究表明,只含花色素单糖苷的葡萄酒比含有花色素双糖苷的葡萄酒对热和光的稳定性差。前人认为,欧亚种葡萄中只存在花色素单糖苷[14],但随着研究的深入,在欧亚种葡萄中检测到了花色素双糖苷。Milica等[15]选取13个葡萄品种进行检测,发现所有葡萄提取物中都含有微量的二甲花翠素-3,5-O-双葡萄糖苷,其中,就包括欧亚种“美乐”“品丽珠”“西拉”等。邢冉冉[16]选取了具有真实性的赤霞珠葡萄为实验材料,使用液质联用技术进行检测,发现葡萄果实中含有4种花色素3,5-O-双葡萄糖苷。此外,圆叶葡萄中只含有花色素双糖苷[17]。在东亚种群葡萄中,花色素双糖苷含量较高,占总花色苷的50%~99%不等[18-19],而北美种群的河岸葡萄中,花色素双糖苷仅占总花色苷的37%左右[20]。
2.4 酰基化作用
在自然界中,花色苷的取代糖基(即糖部分)上的羟基(-OHs)通常通过酯键被有机酸酰化,从而产生酰化花色苷。在葡萄中,这种酰化反应一般发生在葡萄糖的C6位上,可以大大增加花色苷的结构多样性,有利于稳定颜色,还可以提高花色苷的颜色强度[21]。乙酰、香豆酰和咖啡酰是主要的酰化基团[22]。其中,香豆酰化类花色苷平均占总花色苷的20%~30%[23-26]。乙酰化类花色苷在欧亚品种葡萄比例较高,平均占总花色苷的22%[25],其他葡萄品种中的乙酰化类花色苷含量较低,如欧美杂交种“摩尔多瓦”乙酰化仅有5%[27]。咖啡酰化花色苷占总花色苷的7%以下[24,26,28-29],其中,“黑比诺”“蜜萄斯”等不含有咖啡酰化花色苷[25-26]。此外,Cristina等[30]在红酒中发现了微量的乳酸酰化的花色苷。然而,并非所有品种的葡萄都含有酰化花色苷,如山葡萄和圆叶葡萄[18,20]。
2.5 花色苷衍生色素
单体花色苷在葡萄产品和葡萄酒中不稳定,容易氧化。一系列复杂的机制有助于提高花色苷的颜色稳定性,其中就包括花色苷衍生物的形成,例如吡喃花色苷和聚合花色苷[31]。
吡喃花色苷是最重要的花色苷衍生色素之一,在红酒的发酵和陈酿过程中产生,有助于红葡萄酒向砖红色方向变化,并能高度促进其颜色稳定性[32]。吡喃花色苷的基本结构由A、B、C、D四个环组成,除了基本花色苷的3个环外,还包括C4位和C5位羟基间通过环化加成反应增加的一个吡喃环D(图2)[31],这个新的吡喃环D可以将不同种类的取代基连接在C10位上。根据C10位上的取代基团不同,吡喃花色苷分为Vitisins型吡喃花色苷、甲基吡喃花色苷、酚基吡喃花色苷、黄烷醇基吡喃型花色苷和吡喃花色苷二聚体等[33]。其中,Vitisins型吡喃花色苷是原有的花色苷与糖发酵过程中释放的某些代谢产物(如丙酮酸,乙酰乙酸和乙醛)通过加成反应所形成的产物,在葡萄酒中最丰富[34]。
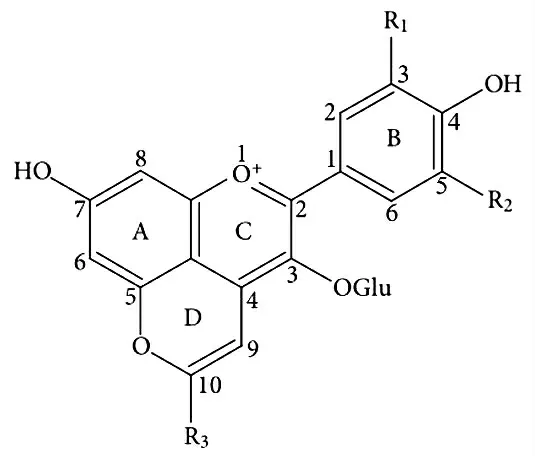
图2 吡喃花色苷的基本结构Fig.2 General structures of pyranoanthocyanins
另外,在葡萄酒陈酿过程中,葡萄酒中的单体花色苷与多酚类物质发生聚合作用,生成聚合花色苷,主要有3种类型,直接与黄烷醇连接形成的聚合花色苷、通过烷基与酚类物质连接形成的聚合花色苷、与鞣花单宁形成的聚合花色苷等[35]。该过程影响花色苷的平衡,使花色苷变得更加稳定,同时还可以保持聚合物中花色苷的颜色。据报道,在酒精发酵结束时,约有25%的花色苷与黄酮类化合物聚合,经过一年的陈酿,这一比例将上升到40%以上,直到几年后出现完全聚合为止,随着时间的推移,聚合作用将花色苷从红色转移到棕色,甚至橙色和黄色[36]。
3 葡萄花色苷的生物合成
3.1 葡萄花色苷的生物合成途径及关键酶
花色苷的生物合成经历苯丙烷类和类黄酮合成途径(图3)[12]。其中,柚皮素在黄烷酮-3-羟基化酶(F3H)的催化作用下,生成二氢黄酮醇,进而形成三个支路,最终生成六类基本花色苷。其中,类黄酮3′-羟化酶(F3'H)和类黄酮3′,5′-羟化酶(F3′5′H)催化二氢山奈酚羟基化为二氢槲皮素和二氢杨梅素[37]。Robinson等[38]利用F3′H和F3′5′H基因沉默的转基因葡萄来研究这2个基因对葡萄果实花色苷的影响,结果表明二者中单一基因表达量降低并没有显著改变葡萄皮中花色苷的含量,而是导致了花色苷组成的变化。当编码F3′5′H基因被沉默时,三羟基化花色苷的比例从86%下降到4%左右,F3′H基因被沉默时,三羟基花色苷比例明显增加,达到90%~95%。而当两个基因的表达量同时降低时,转基因的花色苷含量下降了20%~30%,这说明,F3′H和F3′5′H决定了花色素的B环羟基化模式,对羟基化花色苷的组成都具有重要意义。

图3 葡萄中花色苷的生物合成路径Fig.3 Biosynthesis pathway of anthocyanins in grapes
二氢黄酮醇4-还原酶(DFR)将二氢黄酮醇还原成相应的无色花色素[37]。在花色素合成酶(ANS)的催化作用下,无色花色素可以被氧化成相应的有色花色素。其中,ANS属于OGD家族,被认为是第一个将黄酮类物质引入花色素分支的关键酶,在花色苷的生物合成中起着关键作用[39]。接着,葡萄花色苷合成的控制位点类黄酮-3-O-糖基转移酶(3GT)催化不稳定的花色素进行糖基化反应,转化为稳定的花色素单糖苷[40]。研究人员发现只有3GT在葡萄浆果转色后表达,而且在有色葡萄中表达水平比在白葡萄中高很多[41],由此确定了3GT是决定葡萄浆果颜色的关键基因。甲基转移酶(OMT)催化花青素和花翠素的单糖苷甲基化,生成甲基花青素、甲基花翠素和二甲花翠素的糖苷。这些不同种类的花色素单糖苷在类黄酮-5-O-糖基转移酶(5GT)和花色素酰基转移酶(AT)的作用下,转化为更稳定的花色素双糖苷和酰基化花色苷[35]。此外,花色素双糖苷也可在AT的作用下生成酰基花色苷[42]。
3.2 葡萄花色苷的生物合成调控
3.2.1 调节基因
花色苷作为类黄酮途径的次级代谢产物,在转录水平上受到多个调控基因的复杂调控,MYB和MYC是最主要的两类调节因子。其中,MYB相关基因对葡萄花色苷生物合成的调控起到至关重要的作用,主要调节3GT的表达[43]。
目前,从葡萄中分离出来的MYB相关基因主要有mybA、mybB、mybC、mybD、mybE、mybF、mybG及mybH等[42]。VvmybA基因型是决定葡萄果皮颜色多样性的主要因素,主要包括VvmybA1基因型、VvmybA2基因型和VvmybA3基因型[44]。其中,VvmybA1是决定花色苷合成和葡萄呈色的主要基因,具有转录组织特异性,只在浆果皮中表达,包括VvmybA1a、VvmybA1b和VvmybA1c三种等位基因[45]。VvmybA1a的5′侧翼区域有一个逆转录转座子Gret1,它会导致转录因子功能丧失,不能合成花色苷[46],因此,自然界中出现了白葡萄。VvmybA1b和VvmybA1c都具有转录功能,VvmybA1c不含有Gret1,VvmybA1b中含有一个单拷贝的长末端重复序列(solo-LTR)作为功能调节基因[47]。
除VvmybA1外,来自葡萄的另外两个VvmybA调节基因家族VvmybA2和VvmybA3也已被克隆和鉴定[46]。据报道,VvmybA1和VvmybA2功能极其相似,都能调节3GT的表达,促进葡萄的颜色积累,VvmybA3的功能未知,还需进一步探究[45]。此外,部分MYB转录因子是花色苷生物合成途径的负调节因子,例如mybL2、myb4[48-49]。
3.2.2 MYB单倍型
MYB单倍型是影响葡萄果皮花色苷含量的主要遗传因素,由于颜色位点上的两个相邻的MYB等位基因是共同遗传的,因此,将它们称为MYB单倍型(图4)[50]。单倍型HapC-N是最原始的MYB单倍型,由功能性VvmybA2r和VvmybA1c等位基因组成。HapC-Rs包含非功能性VvmybA2w和功能性VvmybA1c。HapA由非功能性的VvmybA1a和VvmybA2w组成。HapB源于HapA,包含功能性的VvmybA1b和非功能性的VvmybA2w。Amanda等[51]和Hiroshi等[52]研究表明,黑皮“黑皮诺”变为白皮“白皮诺”颜色转变的原因是由于HapC-N中的VvmybA1c和VvmybA2r等位基因的缺失,这就导致了HapD成为无功能的单倍体。而“红高”果皮的颜色恢复是由于VvmybA1基因座上功能性VvmybA1BEN等位基因的出现,导致HapG成为有功能的单倍体,并推测功能性VvmybA1BEN等位基因是VvmybA1a与VvmybA3同源重组的结果。
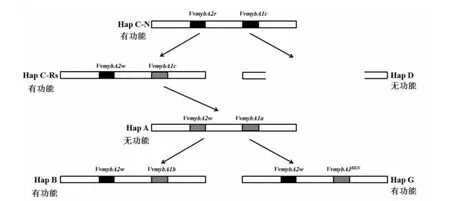
图4 葡萄中MYB单倍型在颜色位点的进化模型Fig.4 Model of the evolutionary of MYB haplotypes at the color locus in Vitis species
颜色位点的功能性单倍型的数量影响葡萄果皮中的花色苷积累。研究表明,白色品种葡萄的非功能性HapA(HapA/HapA)是纯合的,而有色葡萄至少包含一种功能性单倍型。此外,具有两个功能性单倍型的葡萄中花色苷含量高于仅具有单个功能性单倍型的葡萄[53]。果皮中花色苷含量高的品种(如“司特本”、“美乐”和“早熟坎贝尔”)都包含两个功能性单倍型,所有具有一个功能性MYB单倍型的品种(如“利扎马特”和“粉多加意”),花色苷含量较低[50]。
3.2.3 植物激素
葡萄中花色苷的累积与脱落酸(ABA)紧密相关,Jeong等[54]研究结果表明,ABA可以促进葡萄果皮中CHS、CHI、DFR、F3H、ANS、3GT和VvmybA1等基因的表达,促进花色苷的合成。此外,通过外施ABA可以提高葡萄果实花色苷含量,而不会对收获葡萄的质量产生负面影响[55-56]。曹慕明等[57]研究表明ABA能显著提高“巨峰”中的花色苷,综合各项指标,250 mg·L-1的ABA处理的效果最优。马文婷等[58]研究结果表明,300 mg·L-1的ABA处理增加了“蛇龙珠”葡萄果实中花色苷的含量且改变了基本花色苷的比例,其中,花翠素与花青素的比例显著升高。
乙烯(ETH)作为一种植物激素,在果实成熟前大量合成,可加速葡萄中花色苷的积累。在实际操作中,经常用乙烯处理葡萄浆果刺激CHS、F3H、ANS、DFR、LDOX和3GT等相关基因的长期表达,从而促进花色苷的合成[59]。于淼等[60]研究表明,乙烯可以提高VlmybA1和VlmybA1-2的转录水平。此外,乙烯处理可以增加花色苷的含量,Human等[61]研究表明,施用乙烯可以提高甲基花青素的含量,同时花色素单糖苷的比例也会上升。
茉莉酸甲酯(MeJA)是内源性植物调节剂,在生物胁迫下充当信号分子,并参与触发花色苷的合成,进而促进葡萄果实着色。在实际应用中,经常将MeJA喷施到葡萄叶面上,可以激活PAL和促进DFR、ANS、UFGT、MYB等基因的表达[62]。此外,Portu等[63]研究表明,经过MeJ处理的葡萄可获得较高花色苷浓度的葡萄酒,葡萄酒中的总花色苷含量增加,其中,单体花色苷及酰化花色苷有显著上升。
此外,一些植物激素对葡萄浆果中花色苷的积累有负面影响。例如,将2,4-二氯苯氧乙酸(2,4-D)或1-萘乙酸(1-NAA)应用于葡萄浆果,可抑制花色苷生物合成相关基因的表达以及调节因子VvmybA1,从而抑制花色苷的合成和积累[64]。
3.2.4 环境
葡萄花色苷的生物合成除了由自身基因型决定外,还会受到很多外部环境因素的影响,如光照、温度、水分等。这些都会影响结构基因和调节基因的表达,改变葡萄花色苷的含量和组成,从而对其合成与积累存在直接或间接的影响[65]。
与其他水果不同,葡萄在有无光照的条件下均能在果皮中积累花色苷。Spayd等[66]表明,光照充足的葡萄中花色苷含量高于光照较弱的葡萄,但当暴露强度超过一定限度时,花色苷含量降低[67]。同样,遮光处理会在一定程度上造成CHS、F3H和VlmybA1在转录水平上的表达量降低,从而减少花色苷的累积[68]。与含量相比,光照对花色苷的组成影响更大。经过遮光处理的葡萄含有更高比例的三羟基化花色苷和酰化花色苷[69]。因此,为了最大限度地提高葡萄浆果中花色苷的产量,适度的阳光照射是必要的,但不同品种之间的程度不同。此外,光质和光照时间的长短也会影响花色苷的累积,如紫外线会促进花色苷的合成,长日照比短日照更有利于花色苷的累积[70]。
除了光照,适当的温度(25℃左右)会促进花色苷的积累[71]。Gao等[72]研究表明,葡萄内源ABA受温度的影响,高温状态下会使其降低,从而影响VvmybA1的表达,导致花色苷的合成受到抑制。Chiara等[73]研究表明,低温处理会在一定程度上促进PAL、3GT的表达,进而促进花色苷的含量,经验证,低温条件下的葡萄总花色苷含量是高温处理的2倍。同样,温度也会改变葡萄花色苷的组成,高温增加香豆酰化Mv、Pt和Dp衍生物的含量,而低温和遮阴则导致Cy和Pn衍生物含量升高[65-66]。
水分不足的情况下会使总花色苷含量提高30%~50%,但葡萄脱水过多,花色苷的含量反而下降[74]。在实际操作中,研究人员经常通过水分胁迫的方法来管理葡萄果园的水分状况,从而对葡萄花色苷进行调控。Yang等[75]通过转录组和代谢组学相结合,表明水分胁迫可以促进CHS、F3H、3GT等一般生物合成基因的表达进而使花色苷和合成花色苷的物质含量升高。另外,还可以刺激F3′5′H、OMT等与B环修饰有关的基因,丰富相关羟基化和甲氧基化花色苷的含量[76]。此外,水分胁迫可以促进Vvmyb1、Vvmyba1、Vvmyb5a和Vvmybc的表达,从而促进葡萄花色苷的累积[77]。
4 结语
在国内,由于葡萄具有资源优势、可综合利用、应用领域广的特点,葡萄中的花色苷具有广大的开发前景[78]。但是,目前对葡萄花色苷的研究还不够全面。在转录因子方面,科研人员主要对VvmybA1基因型进行了比较全面的研究,对存在于葡萄中的其他MYB转录因子研究不足,值得深入研究。目前,5GT转录调控方面的报道较少,根据3GT的推测,MYBA转录因子很有可能调控5GT的表达,或者还存在其他调节基因专门调控5GT的表达,仍需进一步研究。外部因素(植物激素和环境因素)对花色苷生物合成途径中的结构基因和调节基因表达的影响已有大量报道,但这些报道的结论各不相同,不能相互关联,这些结果都有待验证。

