用氧化—沉淀法从废电池浸出液中去除铁
欧阳石保,张清华,付雄聪,乔延超,陈若葵,阮丁山
(1.广东邦普循环科技有限公司,广东佛山 528137;2.湖南邦普循环科技有限公司,湖南长沙 410600;3.广东省电池循环利用企业重点实验室,广东佛山 528137)
废旧锂电池经放电、破碎和筛分后,得到的电池粉料用硫酸体系浸出[1-6],浸出液中除含镍、钴、锰、锂主金属外,还有铁、铝、铜等成分。为了得到含镍、钴、锰、锂的精制溶液,需要去除铁、铝、铜杂质成分。溶液中的铜离子可以通过加入还原性铁粉去除[7-8],但会引入Fe2+。氧化Fe2+的方法有双氧水氧化法[9-11]、空气氧化法[12]和氯酸钠氧化法[13-14]。由于双氧水易分解,氧化利用率不高;空气氧化法反应时间长、氧化效果较差;氯酸钠氧化法的氧化效果较好,但氯酸钠与有机物、还原性物质摩擦、碰撞,易发生爆炸。所以,试验研究了用MnO2氧化废电池浸出液中的Fe2+,之后再用Na2CO3沉淀Fe3+,以期为类似溶液除铁提供一种可供选择的方法。
1 试验部分
1.1 试验原料与试剂
废电池浸出液由湖南某企业提供,为硫酸体系浸出废电池后加入铁粉除铜后的溶液,主要成分见表1。
试剂:二氧化锰、碳酸钠,均为分析纯,阿拉丁试剂(上海)有限公司产品。

表1 废电池浸出液主要成分 g/L
1.2 试验方法与原理
取500 mL废电池浸出液于1 000 mL烧杯中,加入适量MnO2,在HH-1数显恒温水浴锅(常州澳华仪器有限公司)中加热、搅拌,反应后取浸出液测定Fe2+质量浓度,计算Fe2+氧化率。Fe2+氧化后的浸出液加适量Na2CO3调pH使Fe3+转化为Fe(OH)3沉淀。反应一段时间后,取上清液测定铁离子质量浓度,计算铁离子去除率。
溶液中的Fe2+质量浓度采用重铬酸钾标准溶液滴定法测定,Fe3+质量浓度采用电感耦合等离子发射光谱仪(ICAP-7200,美国赛默飞公司)测定,溶液pH用pHS-25型pH计(上海仪电科学仪器股份有限公司)测定。
MnO2与Fe2+之间的氧化反应见式(1);Na2CO3与Fe3+反应生成氢氧化铁沉淀,反应见式(2)。

(1)
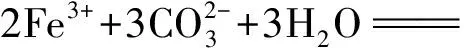
(2)
2 试验结果与讨论
2.1 MnO2用量对Fe2+氧化率的影响
试验条件:废电池浸出液体积500 mL,pH= 1.5,Fe2+初始质量浓度1.3 g/L,反应温度65 ℃,搅拌速度400 r/min,反应时间40 min。MnO2用量对Fe2+氧化率的影响试验结果如图1所示。
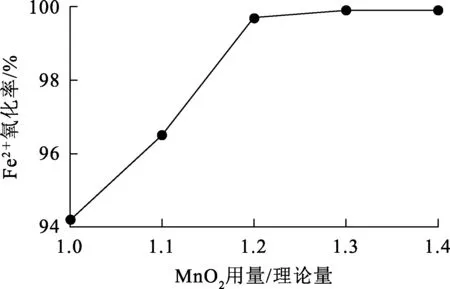
图1 MnO2用量对Fe2+氧化率的影响
由图1看出:随MnO2用量增加,Fe2+氧化率升高;MnO2用量为反应所需理论量1.2倍时,Fe2+氧化率达99.7%;继续增加MnO2用量,Fe2+氧化率率基本保持稳定。综合考虑,确定MnO2用量以理论量的1.2倍为宜。
2.2 浸出液pH对Fe2+氧化率影响
试验条件:废电池浸出液体积500 mL,Fe2+初始质量浓度1.3 g/L,MnO2用量为理论量1.2倍,反应温度65 ℃,搅拌速度400 r/ min,反应时间40 min。浸出液pH对Fe2+氧化率的影响试验结果如图2所示。可以看出:随浸出液pH升高,Fe2+氧化率逐渐降低;浸出液pH升至1.5时,Fe2+氧化率为99.8%;pH升至2.0时,Fe2+氧化率降至94.2%。MnO2与Fe2+反应需要H+参与,随pH升高,体系中的H+减少甚至不足,导致反应不充分,Fe2+氧化率降低。综合考虑,确定浸出液pH不宜超过1.5。

图2 浸出液pH对Fe2+氧化率的影响
2.3 反应温度对Fe2+氧化率的影响
试验条件:废电池浸出液体积500 mL,pH=1.5,Fe2+初始质量浓度1.3 g/L,MnO2用量为理论量1.2倍,搅拌速度400 r/min,反应时间40 min。 反应温度对Fe2+氧化率的影响试验结果如图3所示。

图3 反应温度对Fe2+氧化率的影响
由图3看出:随温度升高,Fe2+氧化率升高;温度升至65 ℃时,Fe2+氧化率达99.7%;继续升温,Fe2+氧化率升高不明显。温度升高,分子间运动加剧,有利于提高反应速率。综合考虑,确定适宜的反应温度为65 ℃。
2.4 反应时间对Fe2+氧化率的影响
试验条件:废电池浸出液体积500 mL,pH=1.5,Fe2+初始质量浓度1.3 g/L,MnO2用量为理论量1.2倍,反应温度65 ℃,搅拌速度400 r/min。反应时间对Fe2+氧化率的影响试验结果如图4所示。

图4 反应时间对Fe2+氧化率的影响
由图4看出:随反应时间延长,Fe2+氧化率先升高后趋于平稳;反应40 min,Fe2+氧化率达99.7%; 之后再继续反应,Fe2+氧化率趋于稳定变化不明显。综合考虑,确定适宜的反应时间为40 min。
2.5 搅拌速度对Fe2+氧化率的影响
试验条件:废电池浸出液体积500 mL,pH=1.5,Fe2+初始质量浓度1.3 g/L,MnO2用量为理论量1.2倍,反应温度65 ℃,反应时间40 min,搅拌速度对Fe2+氧化率的影响试验结果如图5所示。
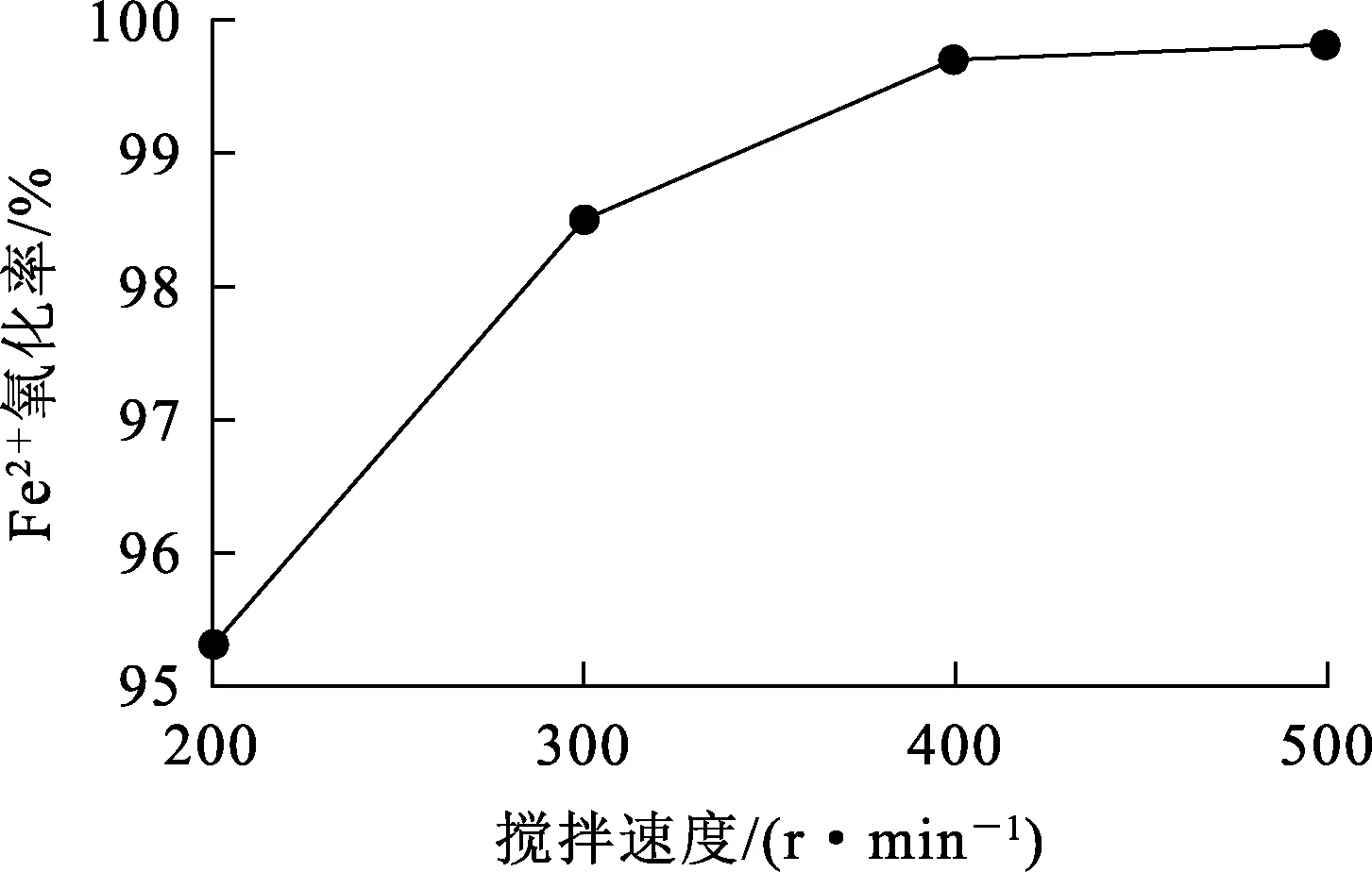
图5 搅拌速度对Fe2+氧化率的影响
由图5看出:随搅拌速度增大,Fe2+氧化率逐渐升高。搅拌速度较低时,传质速度较慢,反应速率较低,Fe2+氧化率不高;提高搅拌速度,传质速度加快,Fe2+氧化率迅速升高;但搅拌速度增大至400 r/min后,Fe2+氧化率趋于稳定变化不大。综合考虑,确定适宜的搅拌速度为400 r/min。
2.6 浸出液中Fe3+的去除
对适宜条件下氧化Fe2+后的浸出液过滤,滤液中加入Na2CO3调节pH使Fe3+转变成Fe(OH)3沉淀而去除。在60 ℃、搅拌速度400 r/min 条件下反应30 min,溶液pH对铁去除率的影响试验结果见表2。可以看出,溶液pH为4.0时,铁去除率达99.8%,去除效果较好。
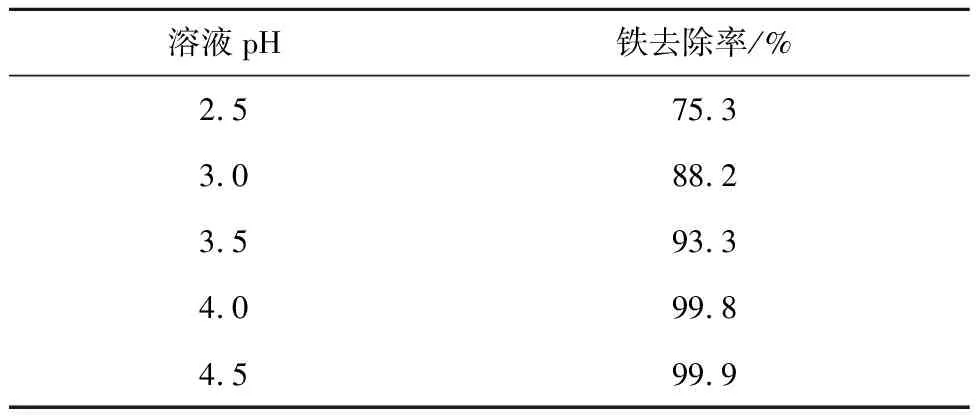
表2 用Na2CO3调溶液pH对铁去除率的影响
3 结论
采用氧化—沉淀法从废电池浸出液中去除杂质铁是可行的。先用MnO2将浸出液中的Fe2+氧化成Fe3+,之后再用Na2CO3将Fe3+转化成氢氧化铁沉淀,从而将杂质铁去除。适宜条件下,铁去除率高达99%。该方法操作简单,成本低廉,有利于工业生产。

