高效液相色谱法同时测定巴氏杀菌乳中 α-乳白蛋白和β-乳球蛋白
胡 敏,张彩云,李志君,段国霞
(内蒙古伊利实业集团股份有限公司,内蒙古 呼和浩特 010110)
巴氏杀菌乳是指在72 ℃条件下经过15~30 s的短时巴氏杀菌处理得到的液体产品[1-2]。GB 19645—2010《食品安全国家标准 巴氏杀菌乳》[3]中明确,巴氏杀菌乳蛋白质含量≥2.9 g/100 g。蛋白质是生命体中最丰富和最重要的大分子之一,在生命活动中起重要作用,是牛乳中最重要的营养物质之一。乳中的蛋白质,根据其在牛乳pH值调节到4.6时溶解度特性的不同可分为两大类,一类为酪蛋白(约占乳蛋白质含量的80%),一类为乳清蛋白(约占乳蛋白质含量的20%)[4-7]。乳清蛋白中α-乳白蛋白和β-乳球蛋白为主要成分,分别占乳清蛋白总量的12%~19%和48%~50%[8-10],乳清蛋白对热不稳定,巴氏杀菌乳可使15.4%的乳清蛋白发生变性[11]。
α-乳白蛋白是唯一能结合钙的乳清蛋白,属于小分子蛋白质,是必需氨基酸和支链氨基酸的重要来源。α-乳白蛋白富含色氨酸,是神经发育的重要因子,能够调节睡眠、食欲和情绪[4]。β-乳球蛋白是由162 个氨基酸残基、2 个二硫基团(S-S)和1 个硫氢基团(-SH)组成的一种分子质量约18.3 kDa的球状蛋白,至少有9 种变体(A、B、C、D、E、H、I、J和W),已知最常见的是A、B变体[12-13]。β-乳球蛋白与叶酸结合,可以有效增强其稳定性;与脂溶性维生素和脂肪酸等结合,可以改善牛乳的风味、促进营养物质的吸收,也可以延缓某些脂肪酸和维生素的氧化降解,起到保护作用[14]。
随着经济的发展和人们生活水平的提高,消费者对牛乳中营养物质的需求日渐增强。对牛乳蛋白的研究集中于对健康具有促进作用的蛋白质及酪蛋白降解后形成的生物性肽[15]。巴氏杀菌乳因其较高的营养价值[16], 最大限度保留生乳的纯正口味,被消费者青睐[17]。但目前检测巴氏杀菌乳中α-乳白蛋白和β-乳球蛋白尚无国标方法。本研究采用最为常用的高效液相色谱(high performance liquid chromatography,HPLC)法同时检测α-乳白蛋白和β-乳球蛋白,选择分离度较好的C4色谱柱,通过调整柱温、色谱检测条件,将α-乳白蛋白与β-乳球蛋白(A和B)彻底分离,为巴氏杀菌乳中α-乳白蛋白和β-乳球蛋白的检测提供一定依据与参考。
1 材料与方法
1.1 材料与试剂
样品:市售巴氏杀菌乳及其生产用生乳、市售灭菌乳。其中,巴氏杀菌乳为72 ℃条件下经15~30 s短时巴氏杀菌处理得到的液体产品[1-2];生乳为从符合国家有关要求的健康奶畜乳房中挤出的无任何成分改变的常乳[18];灭菌乳(α-乳白蛋白和β-乳球蛋白含量约为200 mg/L): 以生牛(羊)乳为原料,添加或不添加复原乳,在连续流动的状态下,加热到至少132 ℃并保持很短时间灭菌,再经无菌灌装等工序制成液体产品[19]。
α-乳白蛋白标准品(纯度≥94%)、β-乳球蛋白标准品(纯度≥95%) 美国Sigma公司;乙腈(色谱纯)、盐酸(优级纯) 成都市科隆化学品有限公司;三氟乙酸(色谱纯) 上海安谱实验科技股份有效公司;实验室用水均采用电阻率不低于18.2 MΩ·cm的超纯水。
1.2 仪器与设备
UItiMate 3000 HPLC仪(配备紫外检测器) 美国 赛默飞公司;ME204分析天平、FE20实验室pH计 梅特勒-托利多仪器(上海)有限公司;Synergy超纯水机 德国Merk Millipore公司。
1.3 方法
1.3.1 样品前处理
移取10 mL巴氏杀菌乳样品于100 mL烧杯中,加入25 mL 40 ℃水进行稀释,用1.0 mol/L HCl调节pH值为4.6,然后转移到50 mL容量瓶中,用水定容、过滤,滤液过0.22 μm水系滤膜,上机测定。
1.3.2 色谱条件
色谱柱:Xbridge Protein BEH C4柱(250 mm× 4.6 mm,3.5 μm);流速1.0 mL/min;进样量10 µL;柱温60 ℃;检测器:紫外检测器;检测波长210 nm;流动相A:体积分数0.1%三氟乙酸-水溶液,流动相B:体积分数0.09%三氟乙酸-乙腈溶液。梯度洗脱程序见表1。

表1 流动相梯度洗脱程序Table 1 Mobile phase gradient elution procedure
1.3.3 标准溶液的配制
标准储备液配制:α-乳白蛋白标准储备液(1.0 mg/mL): 准确称取按其纯度折算为100%的α-乳白蛋白标准品0.05 g,加水定容至50 mL容量瓶,并进行分装,置于 -18~-20 ℃密封可保存1 个月;β-乳球蛋白标准储备液(2.0 mg/mL):准确称取按其纯度折算为100%的β-乳球蛋白标准品0.1 g,加水定容至50 mL容量瓶,并进行分装,置于-18~-20 ℃密封可保存1 个月。
标准工作溶液配制:分别吸取适量的α-乳白蛋白标准储备液、β-乳球蛋白标准储备液,加水稀释成α-乳白蛋白质量浓度分别为10、50、70、100、200、300、500 mg/L,β-乳球蛋白质量浓度分别为20、50、70、100、300、600、900 mg/L的混合标准工作溶液。
1.3.4 结果计算
试样中α-乳白蛋白、β-乳球蛋白含量按下式计算。
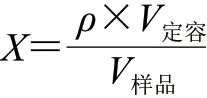
式中:X为试样中α-乳白蛋白或β-乳球蛋白含量/(mg/L);ρ为由标准曲线得到的样品溶液质量浓度/(mg/L);V定容为样品溶液定容体积/mL;V样品为样品体积/mL。
1.4 数据处理
采用Excel和Origin软件对数据和图谱进行处理。
2 结果与分析
2.1 酪蛋白沉淀温度的选择
根据牛乳中酪蛋白在其等电点溶解度最低的原理,在一定温度下,将牛乳pH值调整到酪蛋白等电点,酪蛋白即发生沉淀,酪蛋白不溶于水和有机溶剂[20-21],根据以上特性,采用酸沉淀法对酪蛋白进行沉淀,分离不变性的乳清蛋白。观察20、30、40 ℃温度下酪蛋白的沉淀效果及速率,确定水温为40 ℃时稀释样品、进行pH值调节,样品凝结更快,酪蛋白沉淀效果最好。
2.2 色谱柱的选择
查阅文献[22]、T/TDSTIA007—2019《奶及奶制品中β-乳球蛋白的测定 液相色谱法》[23]选用安捷伦Zorbax SB-C18色谱柱、资生堂Capcell PAK C18色谱柱、Waters Xbridge Protein BEH C4色谱柱,分别对质量浓度为100 mg/L 的α-乳白蛋白和β-乳球蛋白混合标准工作液进行测定。
由图1~3可知,相比较C18色谱柱,Xbridge Protein BEH C4色谱柱分离度较好。相同检测条件下,采用Xbridge Protein BEH C4色谱柱时,α-乳白蛋白、β-乳球蛋白A和β-乳球蛋白B能完全分离,且峰型好、方便积分。
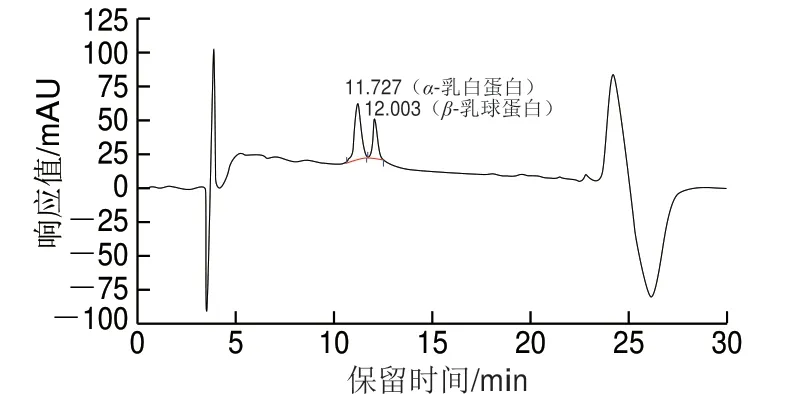
图1 安捷伦Zorbax SB-C18色谱柱检测α-乳白蛋白、 β-乳球蛋白HPLC图谱Fig. 1 HPLC chromatogram of α-lactalbumin and β-lactoglobulin on Agilent Zorbax SB-C18 column
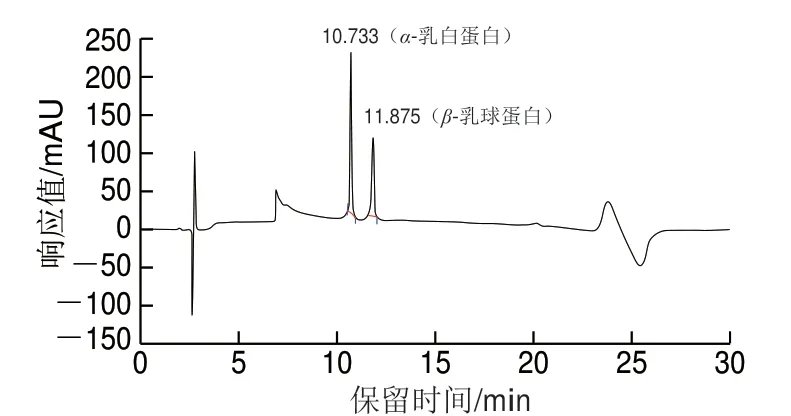
图2 资生堂Capcell PAK C18色谱柱检测α-乳白蛋白、 β-乳球蛋白HPLC图谱Fig. 2 HPLC chromatogram of α-lactalbumin and β-lactoglobulin on Shiseido Capcell PAK C18 column
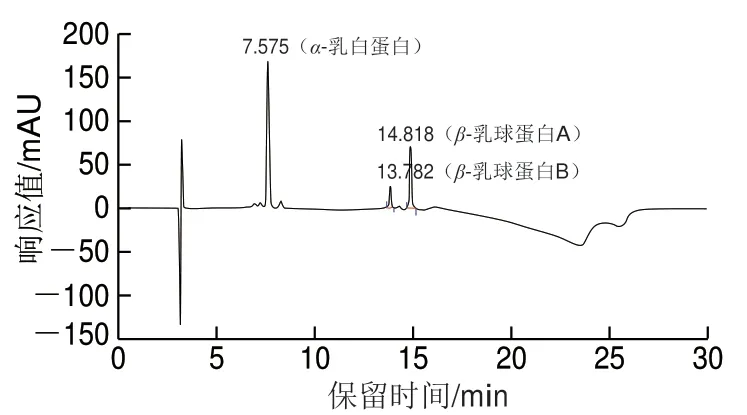
图3 Xbridge Protein BEH C4色谱柱检测α-乳白蛋白、 β-乳球蛋白HPLC图谱Fig. 3 HPLC chromatogram of α-lactalbumin and β-lactoglobulin on Xbridge Protein BEH C4 column
2.3 流动相体积比的选择
采用体积分数0.09%三氟乙酸-乙腈溶液和体积分数0.1%三氟乙酸-水溶液作为流动相,参考T/TDSTIA 007—2019[23]、李慧[24]等的流动相梯度洗脱条件进行测定,α-乳白蛋白在10.70 min出峰,受杂峰影响,基线有偏移;β-乳球蛋白A和β-乳球蛋白B分别在18.83、21.10 min出峰,出峰时间较晚,整体运行时间较长。经确认,在多肽及蛋白质的反相液相色谱分离中,初始洗脱条件下流动相中有机溶剂体积分数较低,多肽及蛋白质与固定相间的疏水作用较强,多肽及蛋白质几乎完全被固定相吸附。而一旦流动相中的有机溶剂达到特定的体积分数,使多肽或蛋白质与固定相的作用小于与流动相的作用时,多肽或蛋白质就会完全从固定相上洗脱下来,几乎不再与固定相发生作用[25]。
故实验过程中,将第1阶段洗脱程序中0.1%三氟乙酸-水溶液体积分数增大[12]、加强杂质洗脱强度,减少α-乳白蛋白出峰处的杂峰干扰,同时整体运行时间从21.10 min缩短到14.90 min,峰型得到更好的改善。在兼顾保留时间和分离效果的前提下,将第1阶段洗脱条件中0.1%三氟乙酸-水溶液体积分数增大至65%。
2.4 标准曲线和线性范围
将不同质量浓度的α-乳白蛋白、β-乳球蛋白系列标准工作液在本研究确定的条件下测定。结果表明,α-乳白蛋白和β-乳球蛋白标准曲线的相关系数均为0.999 9,线性良好。
2.5 加标回收率和精密度
在不含α-乳白蛋白、β-乳球蛋白的灭菌乳、巴氏杀菌乳中分别添加不同质量浓度的α-乳白蛋白、β-乳球蛋白标准品,每个样品平行测定6 次(灭菌乳)或2 次(巴氏杀菌乳),计算加标回收率和相对标准偏差(relative standard deviation,RSD)。
由表2可知:α-乳白蛋白加标量为200~1 032 mg/L 时,平均加标回收率为97.9%~104.0%、RSD为0.00%~1.09%;β-乳球蛋白加标量为600~4 727 mg/L 时,平均加标回收率为96.1%~103.0%,RSD为0.00 %~2.23%。
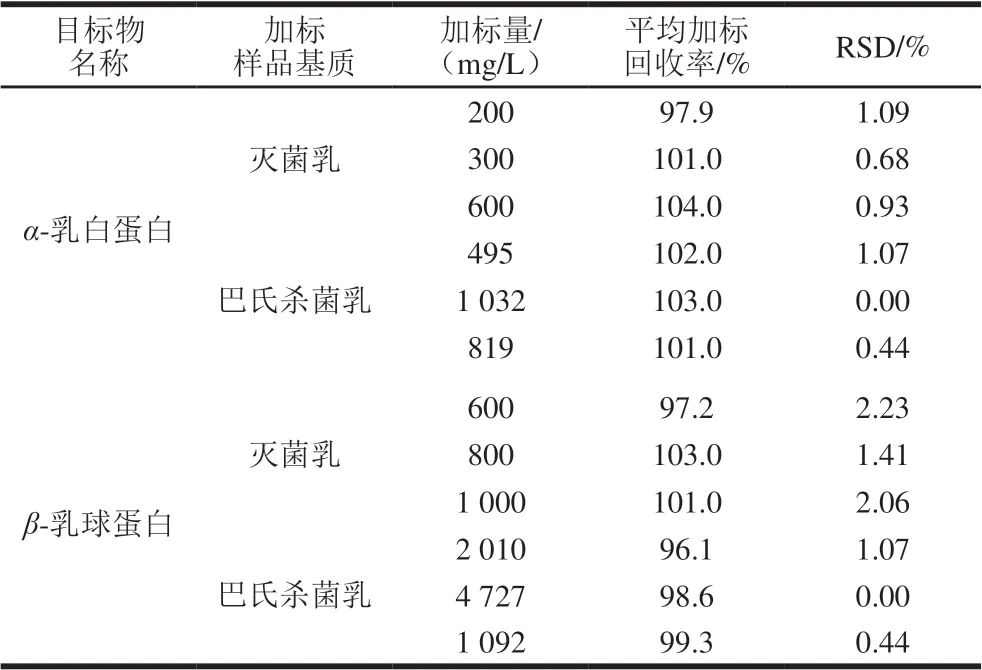
表2 灭菌乳、巴氏杀菌乳中α-乳白蛋白和β-乳球蛋白的 加标回收率与RSDTable 2 Recovery and RSD of added α-lactalbumin and β-lactoglobulin in sterilized milk and pasteurized milk
由表3可知,对市售巴氏杀菌乳进行6 次重复测定,α-乳白蛋白、β-乳球蛋白RSD分别为0.48%和0.56%,说明该方法测定市售巴氏杀菌乳中α-乳白蛋白和β-乳球蛋白含量具有很好的精密度。
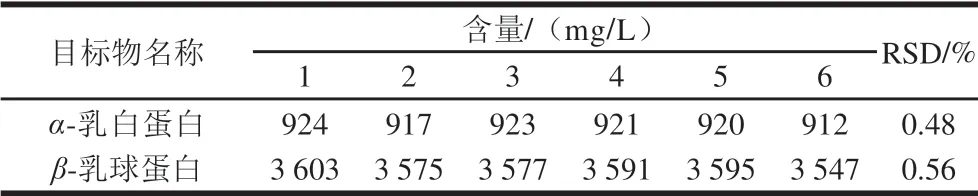
表3 市售巴氏杀菌乳精密度测定结果(n=6)Table 3 Precision RSD for determination of α-lactalbumin and β-lactoglobulin in commercial pasteurized milk (n = 6)
2.6 定量限
在不含α-乳白蛋白、β-乳球蛋白的灭菌乳中分别添加理论含量为25 mg/L的α-乳白蛋白、β-乳球蛋白标准品,进行定量限测定。由图4可知,色谱图杂质峰干扰较小,可进行准确定量测定,同时,RS/N≥10,确定该方法α-乳白蛋白、β-乳球蛋白的定量限均为25 mg/L。
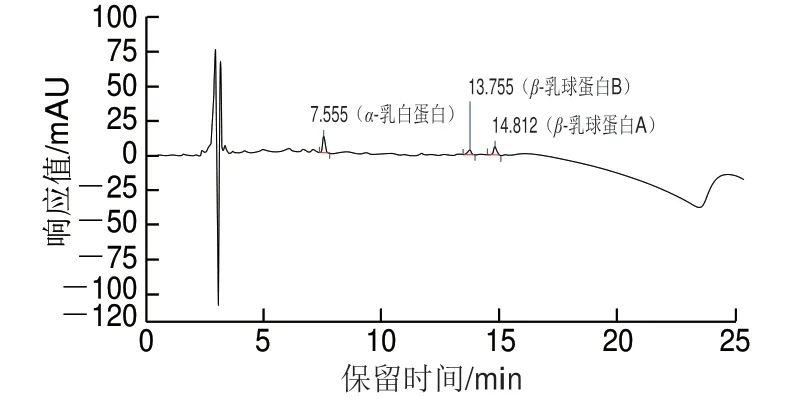
图4 灭菌乳α-乳白蛋白、β-乳球蛋白加标样品HPLC图Fig. 4 HPLC chromatograms of sterilized milk spiked with α-lactalbumin and β-lactoglobulin
2.7 不同实验室间测定结果比较
由表4可知,采用本方法测定3 个不同批次的巴氏杀菌乳,不同实验室间测定结果无明显差别,α-乳白蛋白和β-乳球蛋白含量测定结果经格拉布斯检验法计算,均无离群值,表明方法稳定性好。
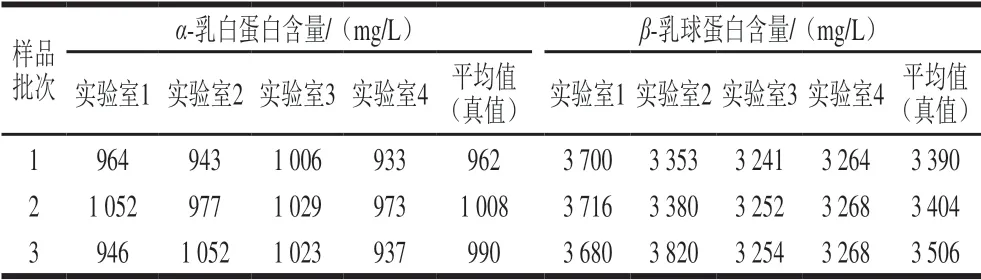
表4 不同实验室间3 个不同批次巴氏杀菌乳测定结果Table 4 Comparison of results of different laboratories for α-lactalbumin and β-lactoglobulin in pasteurized milk
2.8 生乳和市售巴氏杀菌乳中α-乳白蛋白和β-乳球蛋白含量测定结果
由表5可知,巴氏杀菌乳α-乳白蛋白和β-乳球蛋白含量均较生乳低。
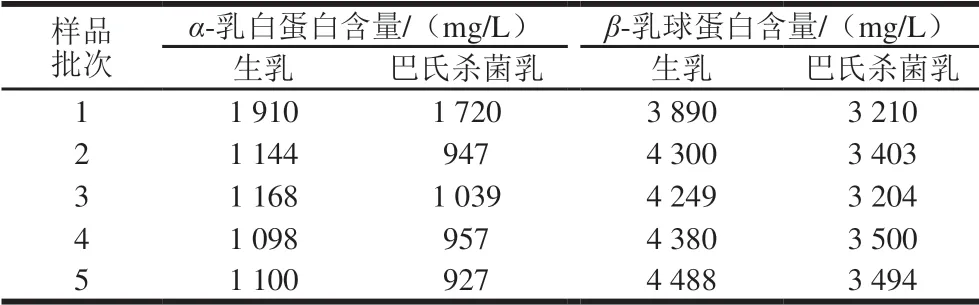
表5 生乳与巴氏杀菌乳中α-乳白蛋白和β-乳球蛋白含量比较Table 5 Comparison of α-lactalbumin and β-lactoglobulin contents in raw milk and pasteurized milk
3 结 论
建立一种适用于巴氏杀菌乳中α-乳白蛋白和β-乳球蛋白含量测定的HPLC法。对参考T/TDSTIA 007—2019[23]的样品前处理条件、色谱条件进行讨论及合理优化。结果表明,该方法具有较好的准确度、精密度和重现性,适用于巴氏杀菌乳的α-乳白蛋白和β-乳球蛋白含量测定。

