苯并[a]芘在厚壳贻贝体内的富集及代谢特征
李 磊,曾梦妮,王翠华,马丽艳,张 璇,黄冬梅,蒋 玫
(1.中国水产科学研究院东海水产研究所,上海 200090;2.宝船生物医药科技(上海)有限公司,上海 201203)
苯并[a]芘(benzo[a]pyrene,BaP)是多环芳烃(polycyclic aromatic hydrocarbons,PAHs)中高致癌物质的典型代表。多环芳烃可通过降雨、地下河流等方式最终流入海洋[1]。我国多处海域受到PAHs污染,对青岛沿岸、象山港、海南洋浦湾等区域的海水检测显示,水体中BaP浓度为0.12~2.35 ng·L-1[3-4]。水环境中的BaP主要以溶解态、吸附于悬浮物中、与沉积物结合等形式存在,因其具有较高亲脂性、疏水性和低生物降解性,可通过摄食作用、鳃呼吸作用以及表皮接触渗透等方式进入水生生物体并累积[5]。BaP进入生物体后,机体会产生解毒反应,BaP经组织细胞中的混合功能氧化酶激活转化为3-羟基苯并[a]芘(3-hydroxybenzo(a)pyrene,3-OH BaP)等羟基化合物、醌类或环氧化物[6]。
海洋中双壳贝类因滤食性摄食方式,易在体内富集多环芳烃等环境污染物,常作为监测海洋环境污染的良好指示生物[7-8]。有学者先后研究了水体中多环芳烃在贝类体内的吸收速率常数和释放速率常数[9]、累积和净化动力学参数[10]等富集动力特征,针对消化盲囊、鳃、闭壳肌等不同组织在贝类体内的蓄积规律进行了分析[11-12]。厚壳贻贝(Mytilus coruscus)作为双壳贝类,在中国各海域均有分布。因此,研究厚壳贻贝对PAHs的蓄积规律对评价我国沿海水体的PAHs污染状况具有重要意义。
本研究通过对厚壳贻贝在不同浓度BaP溶液中的富集和释放实验,获得内脏团、外套膜和闭壳肌对BaP的富集及释放规律,分析BaP代谢产物3-OH BaP在3个组织中的时间与剂量效应关系,初步阐明了BaP在厚壳贻贝各组织的代谢规律,以期为BaP在贝类体内的转化机制研究提供参考数据。
1 材料与方法
1.1 实验材料
实验用海水为海水晶配制的人工海水,盐度为26,水温控制在(23±2)℃。厚壳贻贝取自浙江省枸杞岛养殖海域,平均壳长为(119.6±7.7)cm,壳宽为(55.0±3.0)cm,体质量为(130.6±17.3)g。实验前将厚壳贻贝暂养7 d,期间连续曝气,并投喂螺旋藻粉。选取健康个体进行实验,实验容器为20 L的玻璃缸体,实验用水为14 L。BaP标准品和3-OH BaP标准品均购自美国Sigma公司。丙酮、甲醇和乙腈均为美国默克公司生产的色谱纯。
1.2 BaP的富集和释放
1.2.1 富集和释放实验
为了验证0.01%(丙酮体积占实验水体总体积比率)丙酮作为BaP助溶剂的可行性,在实验开始前对添加BaP试验组和添加了0.01%丙酮处理的BaP试验组中贻贝组织的BaP含量进行统计学检验。结果表明,二者无显著性差异(P>0.05),说明0.01%丙酮作为BaP的助溶剂是可行的。
实验分为富集和释放两个阶段,分别进行10 d和5 d。在预实验的基础上设置0.2、1.0、3.0 μg·L-13个浓度组,以人工海水(其中加入的丙酮体积占实验水体总体积的0.01%)作为对照组,每个试验组设置3个平行,每个实验容器各放入16只厚壳贻贝。实验期间每天换水1次,换水率100%,每天定时投喂螺旋藻粉。分别于实验的1、3、6、10、12、15 d从每个实验容器中各随机抽取2只贝类,分离其内脏团、外套膜、闭壳肌3种组织于-80℃保存,待测分析每种组织内的BaP和3-OH BaP的残留量。
1.2.2 组织样品前处理
每种厚壳贻贝组织样品分别称取1 g于10 mL的匀浆器中,加入2 mL超纯水制成组织匀浆液。取上述匀浆液100μL,加入200μL乙腈,涡旋混合10 min,10000 r·min-1离心10 min,取上清液供高效液相色谱分析。同时开展BaP和3-OH BaP的加标回收实验,以满足检测质控要求,回收率为90%~110%。
1.2.3 色谱条件
色谱柱:CenturySIL C18-BDS(150 mm×4.6 mm,5μm);BaP流动相:甲醇-水(90∶10),激发波长265 nm,发射波长450 nm;3-OH BaP流动相∶甲醇-水(87∶13),激发波长365 nm,发射波长450 nm;流速1.0 mL·min-1;进样量15μL;柱温25℃。
1.3 标准曲线
用乙腈分别稀释BaP和3-OH BaP标准溶液,配制浓度分别为0.1、0.2、0.4、0.6、0.8、1.0、10.0 ng·mL-1的BaP标准系列溶液,浓度为1.0、4.0、8.0、10.0、25.0、50.0 ng·mL-1的3-OH BaP标准系列溶液,色谱条件测定同1.2.3。BaP在0.1~10.0 ng·mL-1范围内,线性回归方程为y=116.56x+10.156,相关系数R=0.9996;3-OH BaP在1~50 ng·mL-1范围内,线性回归方程为y=3.0172x+3.2594,相关系数R=0.9967。以信噪比S/N=3求得BaP和3-OH BaP检出限分别为0.1μg·kg-1和0.3μg·kg-1。
1.4 数据统计分析
所有数据采用SPSS24.0软件进行统计学处理,显著性差异检验采用单因素方差分析(ANOVA)和双变量相关性检测法,相关性分析采用Dunnet多重比较和皮尔逊(Pearson)方法。
2 结果与分析
2.1 3种组织对BaP的富集与释放规律
各试验组的厚壳贻贝内脏团对BaP的富集和释放情况如图1所示。在富集阶段,内脏团中BaP富集含量均随时间的增加而增加,1.0和3.0 μg·L-1浓度组间无显著性差异(P>0.05),但显著高于0.2μg·L-1浓度组和对照组(P<0.05)。在清水释放阶段(11~15 d),3个浓度组内脏团BaP含量随时间的延长逐渐下降。释放前期阶段(12 d),3个浓度组间无显著性差异(P>0.05);释放后期阶段(15 d),高浓度组(3μg·L-1)内脏团中BaP含量变化显著高于1.0μg·L-1和0.2μg·L-1低浓度组(P<0.05)。
各试验组的厚壳贻贝外套膜对BaP的富集和释放情况如图2所示。外套膜中BaP富集含量在富集阶段均随时间的增加而增加;3个浓度组间有显著性差异(P<0.05),且与对照组差异显著(P<0.05)。在清水释放阶段(11~15 d),3个浓度组外套膜BaP含量随时间的延长逐渐下降。释放前期阶段(12 d),3个浓度组外套膜BaP含量有显著性差异(P<0.05);释放后期阶段(15 d),2个高浓度组(1.0μg·L-1和3.0 μg·L-1)与低浓度组(0.2μg·L-1)差异显著(P<0.05)。

图2 厚壳贻贝外套膜对BaP的富集和释放情况Fig.2 Enrichment and release of BaP in outer membrane of M.coruscus
各试验组的厚壳贻贝闭壳肌对BaP的富集和释放情况如图3所示。在富集阶段,闭壳肌中BaP富集含量均随时间的增加而增加;1.0 μg·L-1和3.0μg·L-1浓度组间差异不显著(P>0.05),但显著高于0.2μg·L-1浓度组和对照组(P<0.05)。在清水释放阶段(11~15 d),闭壳肌组织BaP含量随时间的延长逐渐下降。释放前期阶段(12 d),2个高浓度组闭壳肌中BaP含量显著高于0.2μg·L-1浓度组;释放后期阶段(15 d),3个浓度组间无显著差异(P>0.05)。
从图1~图3可知,厚壳贻贝各组织对BaP的富集含量高低表现为内脏团>外套膜>闭壳肌。

图1 厚壳贻贝内脏团对BaP的富集和释放情况Fig.1 Enrichment and release of BaP in visceral mass of M.coruscus

图3 厚壳贻贝闭壳肌对BaP的富集和释放情况Fig.3 Enrichment and release of BaP in closed shell muscle of M.coruscus
厚壳贻贝3种组织对BaP的吸收速率与释放速率如表1所示。从表1可知,富集阶段(1~10 d)和清水释放阶段(11~15 d),厚壳贻贝3种组织对BaP的吸收速度和释放速率基本都随BaP暴露浓度增加而增加。从表1可见,各组织对BaP的吸收速率和释放速率大小表现为内脏团>外套膜>闭壳肌。

表1 厚壳贻贝3个组织对BaP的吸收速率和释放速率Tab.1 Enrichment and release rates of BaP in three tissues of M.coruscus
2.2 3种组织中代谢物3-OH BaP含量与BaP的时间效应关系
在BaP暴露下,厚壳贻贝内脏团、外套膜、闭壳肌中3-OH BaP含量随暴露时间的变化如图4~图6所示。
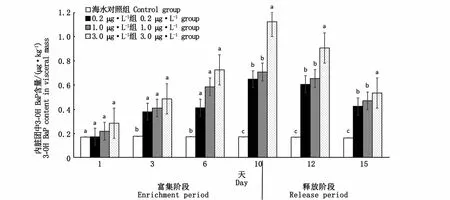
图4 厚壳贻贝内脏团中3-OH BaP与BaP的时间效应关系Fig.4 Time effect relationship between 3-OH BaP and BaP in visceral mass of M.coruscus
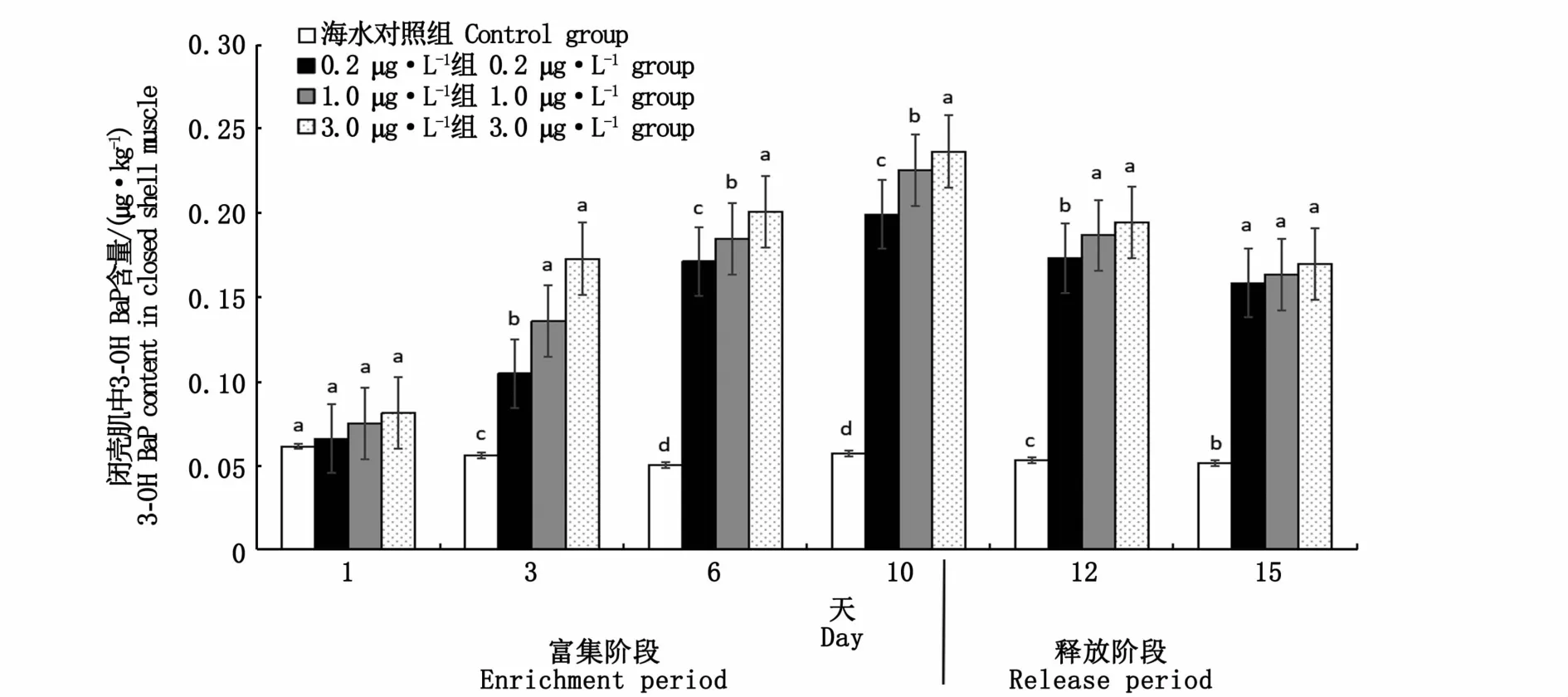
图6 厚壳贻贝闭壳肌中3-OH BaP与BaP的时间效应关系Fig.6 Time effect relationship between 3-OH BaP and BaP in closed shell muscle of M.coruscus
在富集阶段,富集前期(1~6 d),厚壳贻贝内脏团中3-OH BaP含量各浓度组间差异不显著,富集后期(10 d)高浓度组3.0μg·L-1内脏团中3-OH BaP含量显著高于0.2μg·L-1和1.0 μg·L-1浓度组(P<0.05),除第1天外,厚壳贻贝内脏团中3-OH BaP含量各浓度组与对照组均有显著差异(P<0.05)。厚壳贻贝外套膜中3-OH BaP含量在整个富集阶段,均表现为3.0μg·L-1浓度组显著高于0.2μg·L-1和1.0μg·L-1浓度组(P<0.05),且与对照组有显著差异(P<0.05)。第1天,厚壳贻贝闭壳肌中3-OH BaP含量浓度组间差异不显著(P<0.05),第3、6、10天,各浓度组差异显著(P<0.05)。
在清水释放阶段,厚壳贻贝内脏团、外套膜、闭壳肌中3-OH BaP含量均随释放时间的增加而减少,各组织中3-OH BaP含量仍随BaP暴露浓度增加而增加。厚壳贻贝各组织中代谢物3-OH BaP含量的释放率变化规律表现为内脏团(44.7%~52.0%)>外套膜(41.5%~43.5%)>闭壳肌(19.4%~28.1%)。

图5 厚壳贻贝外套膜中3-OH BaP与BaP的时间效应关系Fig.5 Time effect relationship between 3-OH BaP and BaP in the outer membrane of M.coruscus
2.3 3种组织3-OH BaP含量与BaP累积量的剂量效应关系
在不同BaP暴露浓度下,厚壳贻贝内脏团、外套膜、闭壳肌中BaP累积量与3-OH BaP含量变化的相关关系如表2所示。厚壳贻贝在暴露阶段末期(10 d),内脏团、外套膜、闭壳肌中代谢物3-OH BaP含量随着BaP实际累计量的增加而增加。各浓度组内脏团中BaP实际累积量与3-OH BaP含量的皮尔逊相关系数为0.920~0.944;外套膜中3-OH BaP含量与BaP累积量的皮尔逊相关系数为0.833~0.936;闭壳肌中3-OH BaP含量与BaP累积量的皮尔逊相关系数为0.899~0.941,均表现为显著的正相关。
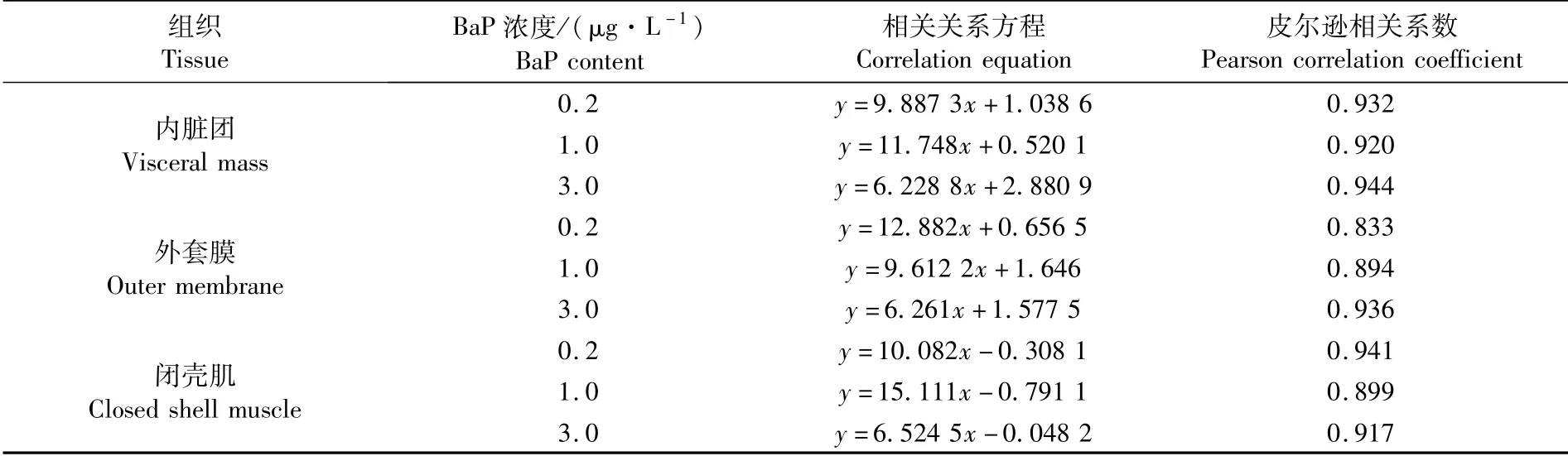
表2 富集阶段末期3个组织中3-OH BaP与BaP含量变化的相关关系Tab.2 Correlation between 3-OH BaP and BaP content in three tissues of M.coruscus exposed to BaP at the end of enrichment period
3 讨论
3.1 BaP胁迫下的3种组织BaP累积量的时间效应关系
本研究结果表明,在富集阶段,厚壳贻贝暴露在不同浓度BaP溶液中,其内脏团、外套膜、闭壳肌中BaP富集含量均表现为剂量效应和时间效应的正相关关系。因为BaP自身具有较高的辛醇-水分配系数(Kow)和较高的疏水性,丙酮助溶后可提高其生物利用性,增加了厚壳贻贝对BaP的富集作用[9],在水溶液环境中易被生物体吸收。SKARPHÉðINSDÓTTIR等[13]研究了BaP对蓝贻贝DNA加合物形成的影响,发现贻贝体内BaP浓度随着暴露时间的延长而增加,本研究结果与其一致。水生生物可以产生有效的解毒机制来消除污染物,但这种机制是需要时间来逐步释放的,且并不能完全消除污染物[14]。在清水释放阶段结束时,从图1~图3可明显看出,各组织中BaP仍有残留。
3.2 BaP胁迫下3种组织BaP的累积量和3-OH BaP含量的变化特征
本研究显示,3个组织对BaP的吸收速率大小为内脏团>外套膜>闭壳肌,这种组织差异性可能与不同组织的生化组成和生理特性有关。PAHs具有很强的亲脂性,已有研究证明,组织内的脂质含量是生物对亲脂性多环芳烃累积的重要和决定性因素[15],而脂肪含量高的组织更容易富集多环芳烃[16]。外套膜和闭壳肌的脂肪含量为3.1%[17],内脏团中的消化盲囊脂肪含量最高达16.1%[18],导致了内脏团相对较高的BaP富集能力。
在清水释放阶段(11~15 d),3个组织中BaP含量在释放阶段前期迅速降低,3个组织对BaP释放率大小表现为内脏团>外套膜>闭壳肌。生物体内各组织对BaP的释放主要受控于新陈代谢活动、扩散作用以及排泄作用[19],内脏团中含有各种代谢酶,能够将BaP转化为代谢物或直接排出以降低其含量,从而维持机体较低的污染浓度[20],外套膜中BaP的排出主要通过血细胞的渗出进行,相对于内脏团多种酶的作用来说要弱得多[21];而闭壳肌基本由肌球蛋白和肌动蛋白组成,无代谢、消化等功能[22]。
3.3 BaP胁迫下代谢产物3-OH BaP作为生物标志物
目前,3-OH BaP在环境监测中常作为生物暴露于BaP的生物标志物[23]。本研究显示,厚壳贻贝3个组织中BaP实际累积量与3-OH BaP含量变化均呈明显的正相关性。由于不同浓度的BaP在进入生物体后,各组织呈现出一种防御解毒反应,激活了细胞内混合功能氧化酶,将BaP转化为羟基代谢物,BaP浓度越高,生物的这种应激反应就越强烈[24]。在外界BaP持续不断地胁迫下,生物机体通过混合功能氧化酶激活转化为主要羟基化合物3-OH BaP产生解毒反应[25]。因而厚壳贻贝内脏团、外套膜、闭壳肌中3-OH BaP含量变化与BaP暴露时间呈显著时间效应关系(表2)。由此可见,厚壳贻贝暴露在BaP水溶液环境中,代谢产物3-OH BaP的含量变化可以较好地反映环境中BaP的污染水平,并表征厚壳贻贝被BaP污染后的应激效应,能够作为BaP的环境监测中贝类生物较灵敏的生物标志物。

