一种CPPs介导的基因转化方法的建立及其应用
闫可心,闫宗斌,韩金成,薛书江,于龙政,宋建臣,许应天
(延边大学 农学院,吉林 延吉 133002)
细胞穿膜肽(cell penetrating peptides,CPPs)也称为膜穿透肽(membrane penetrating peptide,MPPs)、转运蛋白(membrane transduction peptides,MTPs)、蛋白质转导域(protein transductions,PTDs)[1]、“特洛伊木马”肽(Trojan horse peptides) 或转导肽(transduction peptide) 等[2],是一类氨基酸数目为5~30 的小分子多肽。由于它可以运载亲水分子如核酸、肽、蛋白质等生物大分子物质进入细胞内之后可降解,却不会引起细胞损伤,而广泛应用于分子生物学、医药学等各个领域[3-7],但至今尚未有有关基因转化方面的报道。因此,本研究探讨CPPs介导基因转化的可行性,为分子生物学中的基因转化提供一种新的方法。
1 材料与方法
1.1 血液样本、载体和菌液瑟氏泰勒虫阳性抗凝血采自吉林省珲春市天一牧场,保存于本实验室。DH5α菌、BL21(DE3)菌、pET-30a(+)、pMD19-T simple vector均购自宝生物工程(大连)有限公司。
1.2 主要试剂DNaseⅠ、ExTaq DNA聚合酶购自TakaRa公司;限制性内切酶EcoRⅠ和XhoⅠ、T4 DNA ligase、T4 DNA ligase Buffer、血液DNA提取试剂盒、质粒提取试剂盒(Plasmid Mini Kit Ⅰ)和凝胶回收试剂盒(Gel Extraction Kit)均购自OMEGA公司;广谱蛋白marker、IPTG(异丙基硫代-β-D-半乳糖苷)、考马斯亮蓝R-250、SDS-PAGE凝胶制备试剂盒均购自北京索莱宝公司;其他为分析纯试剂。
1.3 CPPs工作液的制备根据田菊等[8]报道的新型穿膜肽序列,委托北京博奥森公司合成。其细胞穿膜肽序列为:CGRLWMRWYSPWARRYGC。用ddH2O溶解CPPs,最终质量浓度为2.35 g/L,分装冻存于-20℃冰箱备用。
1.4 CPPs-DNA复合物最适比例将CPPs工作液与5 μL已知浓度的pMD19-T质粒按照电荷比为0∶1,1∶1,2∶1,4∶1,8∶1,16∶1,32∶1和64∶1混合[9],涡旋混匀,在室温下孵育30 min,得到不同电荷比的CPPs复合物溶液。将CPPs复合物与10×loading Buffer混合,用1%的琼脂糖凝胶电泳初步确定CPPs与质粒pMD19-T结合比例。按上述方法制备不同复合物,每个样品加入5 U/μL DNase Ⅰ酶2,5 μL的10×DNase 1 Buffer后补充ddH2O至50 μL,在37℃孵育30 min,加终浓度为1%的SDS,用1%的琼脂糖凝胶电泳分析CPPs的亲和力,最后确定CPPs和pMD19-T的最适比例。
1.5 CPPs-DNA复合物孵育温度的优化按前期试验优化的条件制备CPPs-DNA复合物,分别在室温、37℃、冰水浴条件下孵育30 min,复合物转入大肠杆菌DH5α菌液中,热激法,即冰水浴30 min,42℃水浴75 s,立即冰水浴2 min,之后分别加入液体LB 400 μL,210 r/min摇菌1 h,留约100 μL的上清液重新吹打菌液,涂在含有氨苄青霉素的固体LB培养基上,37℃过夜培养。每个条件做3个重复,计算转化率,确定CPPs-DNA复合物制备条件。
转化率=转化体总数/质粒DNA加入量
转化体总数=菌落数×稀释倍数×转化反应原液总体积/涂板菌液体积,
1.6 CPPs-DNA复合物孵育时间的优化将上述优化条件制备的电荷比为16∶1的CPPs-DNA复合物在室温下分别孵育15,30,45,60 min,其他同1.5通过热激法进行转化,每个样本做3个重复,并计算转化率。
1.7 大肠杆菌不同保存条件对转化率的影响培养3 h(D600约为0.6)的大肠杆菌菌液保存在4℃冰箱1,3,5,7 d和-20℃冰箱中保存7 d及3,6,12月,保存时加有终浓度为30 %的甘油,分别取菌液100 μL,加入电荷比为16∶1的CPPs-DNA复合物,其他同1.5通过热激法进行转化,每组3个平行,计算转化率。
1.8 不同转化条件对转化率的影响-20℃保存的大肠杆菌DH5α菌液冰水浴解冻,加入电荷比为16∶1的CPPs-DNA复合物混匀后,分别在37℃下孵育15,30 min和室温孵育15,30 min,分别加入液体LB 400 μL,210 r/min摇菌1 h,留约100 μL的上清液重新吹打菌液,涂在含有氨苄的固体LB培养基上,37℃过夜培养。每组3个平行,计算转化率。
1.9 CPPs基因转化法的应用按照常规方法构建牛瑟氏泰勒虫p33基因的克隆质粒和表达质粒,其中2次转化过程采用CPPs法进行。
1.10 数据处理应用Excel和SPSS 22.0统计软件进行数据处理及平均数差异检验,结果以平均值±标准差表示,以P<0.05为差异显著性判断标准。
2 结果
2.1 CPPs-DNA复合物的最适电荷比例CPPs 与质粒pMD19-T按不同电荷比混合后孵育30 min再进行琼脂凝胶电泳。结果显示,当CPPs 与质粒pMD19-T的电荷比大于8∶1时,未见 DNA 迁移条带(图1),表明 CPPs 与质粒pMD19-T 的最适电荷比8∶1。将上述复合物与DNaseⅠ酶孵育后,再加 1% SDS 溶液使 DNA 从复合物中释放,进行琼脂凝胶分析CPPs的亲和力。结果显示,CPPs 与质粒pMD19-T 的电荷比为≥8∶1时可见完整的 DNA 迁移条带(图2) ,并且在16∶1最为明显。综合2种结果 CPPs 与质粒pMD19-T最适电荷比为16∶1,且具有一定的保护作用。
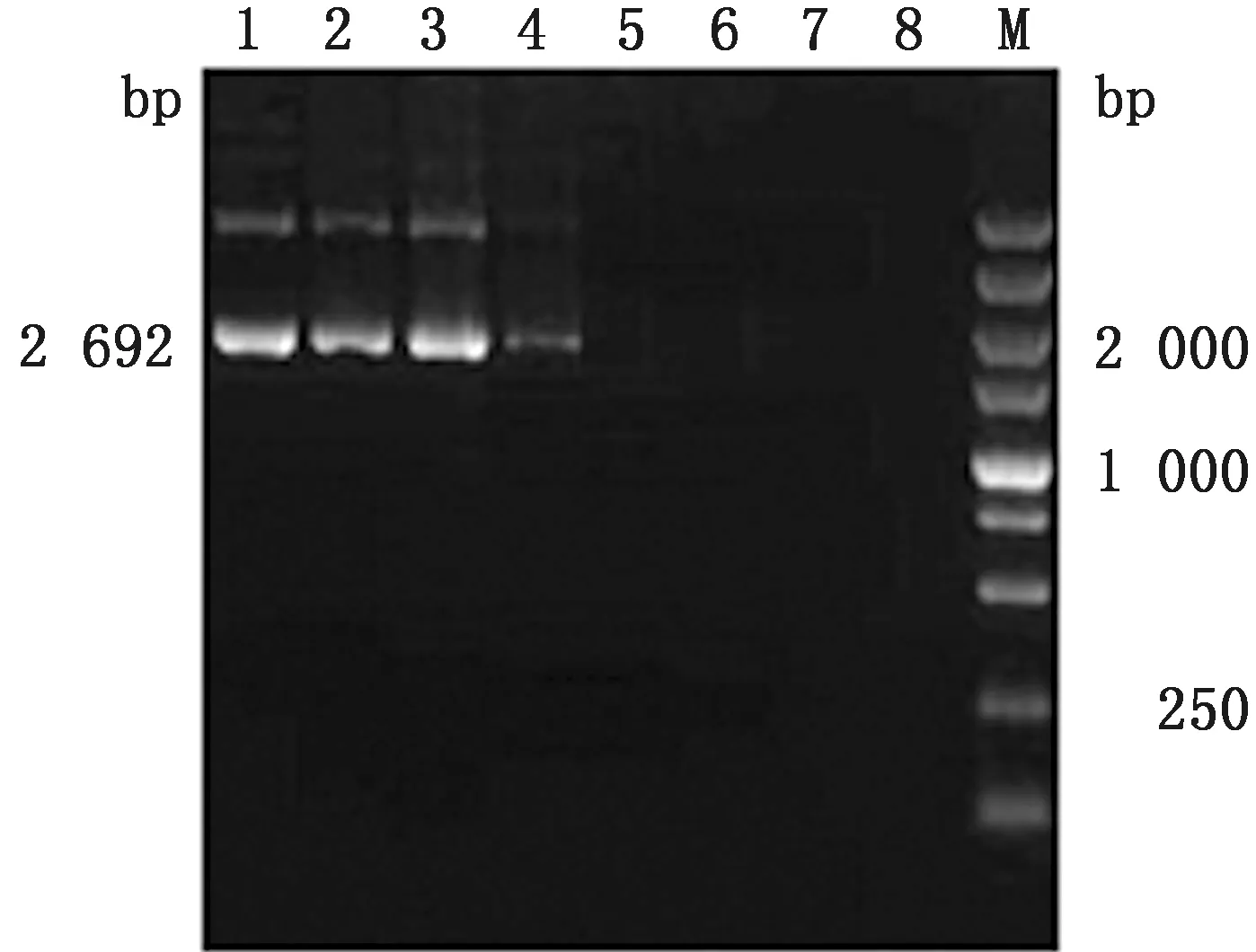
M.DL 5000 DNA Marker;1~8.分别是CPPs与 DNA 按电荷比为 0,1∶1,2∶1,4∶1,8∶1,16∶1,32∶1和64∶1混合孵育 30 min图1 CPPs-DNA复合物的结合比例

M.DL 5000 DNA Marker;1~8.分别是CPPs与 DNA 按电荷比为0,1∶1,2∶1,4∶1,8∶1,16∶1,32∶1和64∶1混合孵育30 min后,再经DNaseⅠ及1% SDS 处理;9.未经DNaseⅠ处理的单纯的质粒 DNA图2 CPPs-DNA复合物的亲和力
2.2 CPPs-DNA复合物孵育温度对转化率的影响将CPPs与质粒pMD19-T按照电荷比为16∶1的比例混合后,分别在室温、37℃、冰水浴3个条件下孵育30 min,直接进行热激法转化,并计算转化率。结果显示,CPPs-DNA复合物的孵育温度对质粒DNA转化的影响较大,室温孵育时的转化率最高,可达(6.81±0.68)×105CFU/μg,与37℃和冰水浴孵育时的转化率有显著性差异(P<0.01)。

表1 CPPs-DNA复合物不同孵育温度的转化率 ×105 CFU/μg
2.3 CPPs-DNA复合物的孵育时间对转化率影响将CPPs-DNA复合物在室温下分别孵育15,30,45和60 min,加到DH5α菌液中,热激法,计算出平均转化率,空白对照组没有长菌。由图3可见,当复合物在室温下孵育15min时转化率很低,但孵育30 min 时转化率可以达到(8.87±0.40)×105CFU/μg,不同孵育时间有差异统计学意义,且差异极显著(P<0.01)。
2.4 大肠杆菌保存条件对转化率的影响新鲜培养的大肠杆菌DH5α菌液分别保存在4℃冰箱1,3,5和7 d;-20℃冰箱中保存7 d及3,6,12月,之后取出放在冰水中,各加入现制备的CPPs-DNA复合物,热激法转化计算转化率。从图4可以看出,大肠杆菌菌在4℃冰箱只能保存1 d,而在-20℃冰箱保存3月的转化率可达(5.58±0.19)×105CFU/μg,仍达到常规转化要求。
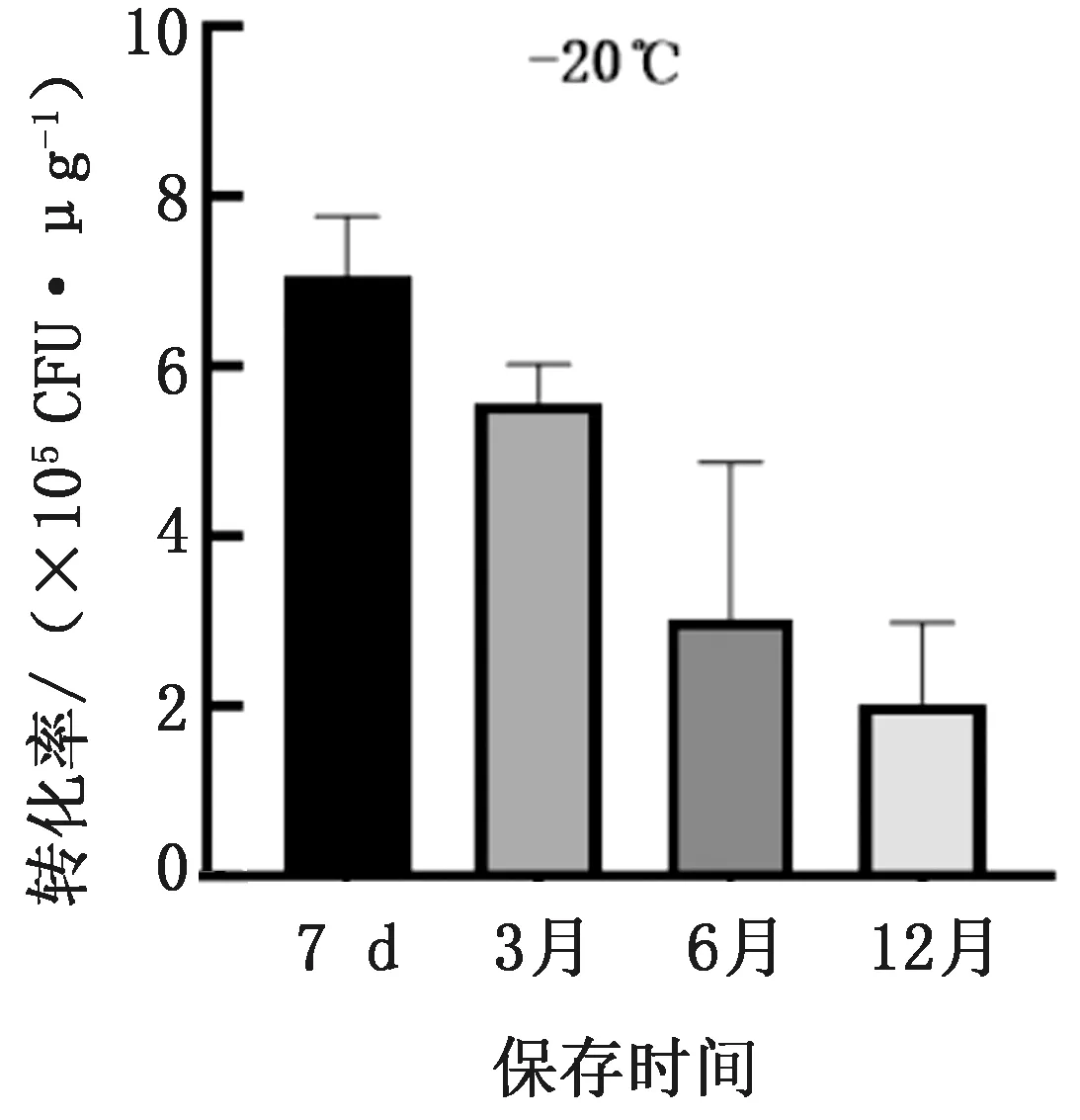
图4 大肠杆菌保存在-20℃时的转化率
2.5 大肠杆菌解冻温度对转化率的影响-20℃冰箱取出的大肠杆菌菌液,分别在室温、冰水浴、37℃温度下解冻,之后将室温下孵育30 min现制备的CPPs-DNA复合物加到DH5α菌液中,进行转化,并计算转化率。结果如表2所示,-20℃冰箱取出的大肠杆菌菌液通过冰水浴解冻后平均转化率可以达到(10.71±1.99)×105CFU/μg,DH5α菌液在不同温度下解冻有差异统计学意义,且差异极显著(P<0.01)。
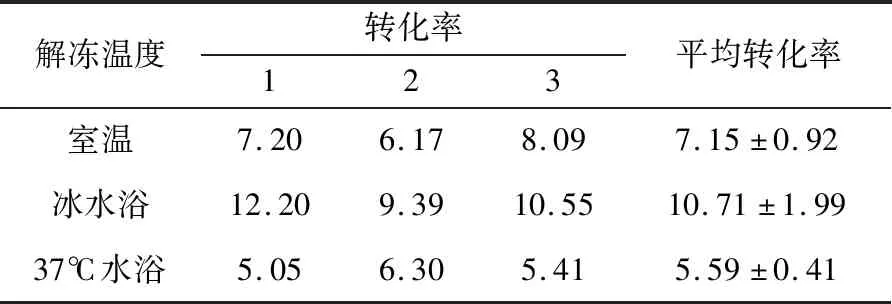
表2 大肠杆菌解冻温度对转化率的影响 ×105 CFU/μg
2.6 转化条件对转化率的影响复合物在室温下孵育30 min后分别转到冰水浴解冻的-20℃保存的大肠杆菌DH5α菌液中,混匀后,不再用热激法,而是分别在37℃下孵育15,30min和室温孵育15,30 min,之后计算转化率。如表3显示,复合物加入到菌液后在37℃下孵育15,30 min,其转化率均未达到常规转化要求,而在室温孵育15 min 其转化率已达到常规转化要求,30 min时的转化率高达(7.85±0.51)×105CFU/μg,与其他组差异显著(P<0.05)。
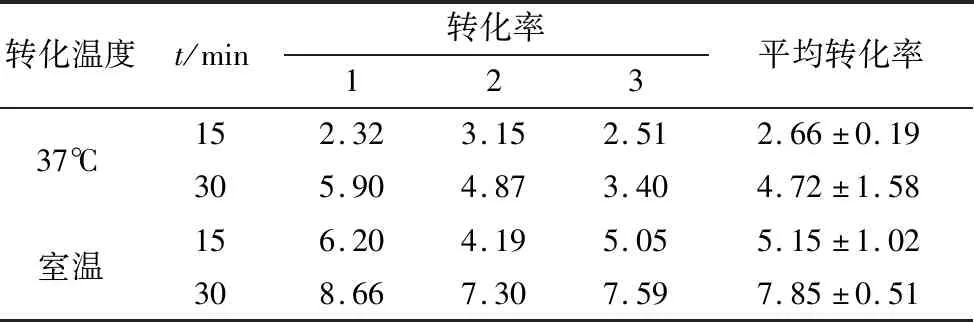
表3 转化条件对转化率的影响 ×105 CFU/μg
2.7 CPPs基因转化法的应用按照所优化的CPPs基因转化法将常规PCR扩增出的目的片段(图5)克隆到pMD19-T载体,获得的重组克隆质粒pMD19-T-p33经PCR扩增和EcoRⅠ和XhoⅠ双酶切出预期大小的片段(图6),说明目的基因成功扩增并插入到pMD19-T中。测序结果表明,克隆得到的牛瑟氏泰勒虫p33基因片段长786 bp,与GenBank上序列同源性为99.0%。
按常规法构建重组表达质粒pET-30a-p33,经EcoRⅠ和XhoⅠ双酶切得到预期大小的条带,证明目的基因已经定向插入表达载体pET-30a中。
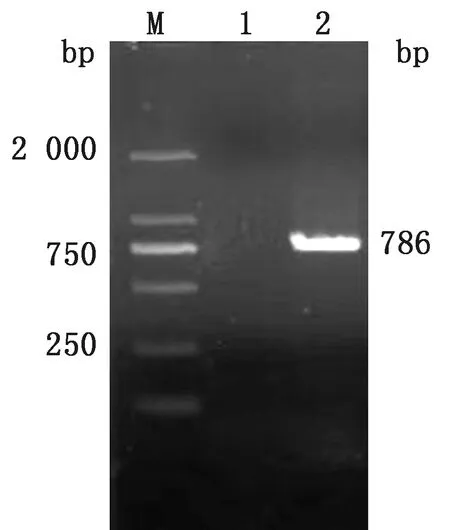
M.DL2000 DNA Marker;1.水对照;2.p33基因的扩增产物图5 p33基因的PCR扩增

M.DL2000 DNA Marker;1.pMD19-T-p33的酶切产物;2.未经酶切的pMD19-T-p33图6 重组质粒pMD19-T-p33的双酶切鉴定图
3 讨论
在分子生物学实验中DNA 重组技术和基因表达是最常用的研究方法,这些研究中DNA连接产物的转化是关键步骤[10]。而常规基因转化需要制备大量的感受态细胞,CaCl2法是目前实验室最常用的制备方法。其原理是Ca2+与细胞膜上的多聚无机磷酸和多聚羟基丁酸化合物结合形成复合物,进一步破坏细胞膜上的脂质双分子层,使得外源DNA更易渗入[10],CaCl2法转化率较高,但是存在繁琐的大肠杆菌感受态细胞的制备、超低温保存和转化率不稳定等问题[11]。为了弥补这些不足点,本研究探讨了CPPs在常规基因转化方面应用的可行性。
细胞穿膜肽是一种具有穿膜活性的非病毒载体,可以携带各种大分子物质进入细胞内,并保持其生物活性,是一种具有广阔前景的运输载体[2]。虽然CPPs如何作用于细胞质膜,以及如何穿透质量膜的机制目前还不是十分清楚,但其在分子生物学和医药领域诱人的应用前景却是毋庸置疑的。研究发现,将CPPs与一些DNA混合后,CPPs作为有效的基因靶脑载体介导核酸进入细胞后,从溶酶体逃逸,完成输送物质的生物学效应[7]。细胞穿膜肽有天然的,也有人工合成的。根据KAMIDE等[12]报道细胞穿膜肽序列中的精氨酸取代第一个赖氨酸时其穿膜能力会增加,将 2 个苏氨酸更换成色氨酸和丙氨酸有利于穿膜作用。因此,本研究参考田菊等[8]报道的穿膜肽序列人工合成穿膜肽开展了本研究。
质粒 DNA 从CPPs-/DNA 复合物中有效、适时地释放出来是其基因转化的一个关键因素,两者的亲和力太低就会导致 DNA 提前释放或被 DNA 酶等水解[13]。本研究用琼脂糖凝胶电泳和DNaseⅠ酶探讨了CPPs-DNA复合物最适电荷比例。结果表明,CPPs-DNA最适电荷比为16∶1。在最适制备条件的优化中发现,室温、37℃和冰水浴3个条件中只有室温孵育30 min时其转化率达到常规转化要求,说明孵育温度对转化率有显著影响,该结果与田菊等[8]报道一致。在大肠杆菌保存条件的优化中发现,-4℃冰箱保存时只能保存1 d,而-20℃冰箱保存3月时的其转化率仍达到常规转化要求。在转化条件优化中发现,37℃孵育的转化率仍未达到常规转化要求,而室温孵育15 min的转化率也达到常规转化要求,30 min时的转化率更好,为(7.85±0.51)×105CFU/μg,该结果与CPPs-DNA最适制备条件优化结果一致。本研究首次成功将CPPs基因转化法应用到牛瑟氏泰勒虫p33基因可质粒和表达质粒的构建。目前公认的细胞穿膜肽的穿膜细胞机制有多种。一种是穿膜肽与小分子结合后通过静电作用和形成氢键的易位或转导作用进入细胞;另一种是穿膜肽与大分子结合后通过能量依赖的内吞作用,特别是巨胞饮作用内化进入细胞[14]。认为,本研究中CPPs基因转化法的可能是第一种机制。因为大部分CPPs由碱性氨基酸组成,带正电荷的CPPs可以和带负电荷的DNA在一定电荷比条件下混合,静电相互作用而形成CPPs-DNA 复合物,形成的复合物便可进入细胞内,表达所携带的目的基因[15]。虽然本研究探讨了CPPs-DNA复合物的制备条件以及转化条件,但由于至今其确切的作用机制尚不十分清楚,其影响因素有待进一步深入探讨。
总之,CPPs介导基因转化的最佳条件为现制备的CPPs-DNA复合物电荷比为16∶1,室温孵育30 min,热激法加入到-20℃保存用冰水浴解冻的的大肠杆菌菌液中,无需制备感受态细胞。本研究首次成功将CPPs基因转化法应用到牛瑟氏泰勒虫p33基因克隆质粒和表达质粒的构建。该结果将分子生物学基因转化提供了一种新方法,也为CPPs的应用开辟了新的思路。

