1 株圆环病毒3 型美国毒株全基因组克隆与遗传演化分析
郑 晶,郝桂英,谢 礼,安 微,杨 苗,陈瑛琪,张 婧,郑 巧,陈 溪,陈孝宇,林 华
(1.成都海关技术中心,四川省食品安全检测重点实验室,四川成都 610041;2.西昌学院动物科学学院,四川西昌 615013;3.大连海关技术中心,辽宁大连 116014;4.武汉海关技术中心,湖北武汉 430010)
猪圆环病毒(porcine circovirus,PCV)是一种小型、无囊膜、单股负链环状DNA 病毒[1],属于圆环病毒科、圆环病毒属[2],是已知最小的病毒之一。该病毒能在猪和其他动物中引起广泛疾病[3-4]。目前在已有报道中,根据抗原性和基因型的不同,其可分为PCV1[5]、PCV2[6]、PCV3[7]和PCV4[8]3 个血清型。PCV3 可引起猪的皮炎肾病综合征、繁殖障碍以及心脏和多系统的炎症反应。PCV3 感染后,患病母猪受孕率降低,流产率增加,可出现产死胎或木乃伊胎现象;患病仔猪出现多器官系统功能紊乱[9]。2016 年美国首次报道发现PCV3,随后波兰[10]、韩国[11]、中国[12]及意大利[13]等国家也相继报道。PCV3 在世界范围内迅速扩散,引起了各国高度重视和密切关注。
PCV3 全基因组长度约2 000 bp,包含11 个可能的开放阅读框(ORF1—ORF11)。其中有3 个主要的开放阅读框:ORF1 编码由297 个氨基酸(aa)组成的复制酶蛋白Rep,ORF2 编码由214 个aa 组成的衣壳蛋白Cap,ORF3 编码由231 个aa 组成的功能未知蛋白质[7]。目前,国际上尚无普遍公认的PCV3 亚型分类规则。大部分学者根据基因组DNA全长序列差异,将PCV3分为两个亚型(PCV3a和PCV3b)[14];也有学者根据Cap 蛋白存在的两个氨基酸突变(A24V 和R27K)不同,将PCV3分为3 个亚型(PCV3a、PCV3b 和PCV3c)[15-16]。根据现有流行病学报道,中国[17]、印度[18]、越南[19]、泰国[20]及美国[14]等主要流行PCV3a、PCV3b 两个亚型,其他国家或地区对PCV3 不同亚型的流行情况鲜有报道。本研究通过对染病的美国种猪采集组织样品进行多种病原核酸扩增,确认病料组织PCV3 阳性,然后扩增PCV3 全基因组,并将其与GenBank 上不同地区PCV3 参考毒株全基因组序列进行遗传进化比对分析,根据基因组差异进行分型,以期了解该序列与不同地区PCV3 毒株的遗传进化关系,为PCV3 分子流行病学研究及防控提供参考。
1 材料与方法
1.1 试验材料
1.1.1 样品 2021 年4 月,四川省某企业进口美国种猪中发现疑似染疫猪,临床表现为进行性消瘦、呼吸困难、皮肤苍白。对死亡猪采集肺脏、脾脏、淋巴结及小肠等组织样品,放置于-70 ℃保存备用。
1.1.2 主要试剂 MagMAXTMCORE NucleicAcid Purification Kit 核酸提取试剂盒,购自赛默飞世尔科技公司;2×HotStartTaqplus Master Mix(Quick Load)、ddH2O,购自近岸蛋白质科技有限公司;大肠杆菌DH5α、pMD18-T 载体、DL5 000 DNA Marker、DNA 胶回收试剂盒,购自宝生物工程(大连)有限公司;氨苄青霉素(ampicillin)、Trans2K DNA Marker、6×loading buffer,购自北京全式金生物技术有限公司;胰蛋白胨(tryptone)和酵母提取物(Yeast Extract),购自英国Oxoid公司;氯化钠、氢氧化钠、琼脂糖(agarose),购自西班牙BIOWEST 公司。
1.1.3 引物设计与合成 参考GenBank 中收录的PCV3 美国株(GenBank 登录号:MK496297.1)全基因组序列,分别设计合成用于扩增PCV3 全基因组的2 对引物(表1)。引物由擎科生物(成都)科技有限公司合成。
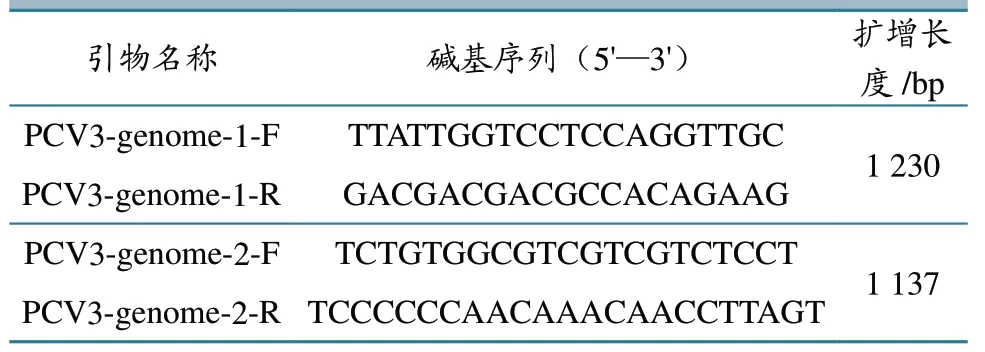
表1 引物序列
1.2 样品处理及RNA/DNA 提取
无菌条件下将采集的病死猪肺脏、脾脏、淋巴结等组织研磨搅碎,按照MagMAXTMCORE NucleicAcid Purification Kit 核酸提取试剂盒说明书,从病料组织中提取基因组。
1.3 病原检测
按照相关标准[21-30]对病死猪组织分别进行猪细小病毒(PPV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪Delta 冠状病毒(PDCoV)、塞内卡病毒(SVV)、猪流行性腹泻病毒(PEDV)、猪劳森氏胞内菌(PPE)、猪支原体肺炎(M.HYO)、猪传染性胃肠炎病毒(TGEV)、PCV2及PCV3检测。
1.4 PCV3 基因组扩增
以检出PCV3 阳性的组织DNA 为模板,用已设计的2 对引物分别进行PCV3 基因组序列扩增。反应体系为25.0 μL:2×TaqMaster Mix 12.5 μL、模板DNA 2.0 μL、上游引物1.0 μL、下游引物1.0 μL、ddH2O 8.5 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,28 个循环;72 ℃延伸5 min。取5.0 μL 扩增产物进行1%琼脂糖凝胶电泳,观察结果。
使用DNA 回收试剂盒对与预期大小相符的2条片段进行胶回收,并分别与pMD18-T 载体4 ℃连接过夜;连接产物转化至E.coliDH5α 感受态细胞,取100 μL 均匀涂布至含有氨苄青霉素的LB琼脂培养基,37 ℃培养12~16 h;挑选单个阳性克隆菌落接种于含氨苄青霉素的LB 液体培养基,37 ℃振荡培养12 h,进行菌液PCR 鉴定。
1.5 PCV3 全基因组核苷酸序列比对与遗传进化分析
使用质粒提取试剂盒对阳性克隆菌液提取质粒,将酶切(EcoR Ⅰ和Hind Ⅲ)正确的重组质粒送擎科生物(成都)科技有限公司测序;对扩增产物大小约1 200 和1 100 bp 的核苷酸序列进行拼接,获得PCV3 全基因组序列,并与国内外38 个PCV3 参考毒株(表2)通过BLAST 在线进行核苷酸同源性比对;同时,用生物信息学软件进行遗传进化分析,采用Neighbor-Joining(NJ)法(1 000 次重复bootstrap 分析)生成系统进化树。
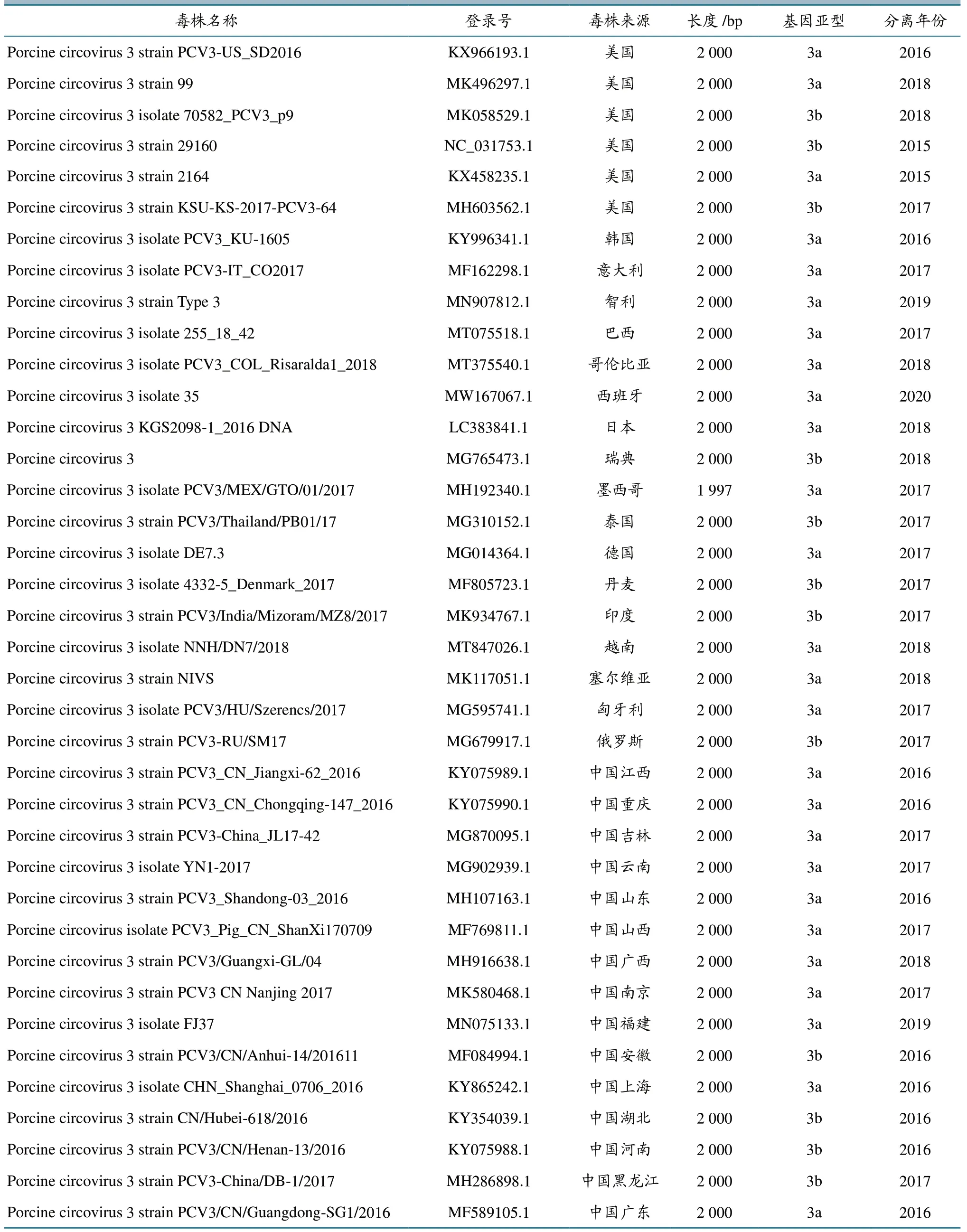
表2 PCV3 参考毒株全基因组序列信息
1.6 PCV3 毒株ORF1、ORF2 核苷酸序列及推导的氨基酸序列分析
用生物信息学软件分别将获得的美国毒株PCV3 ORF1 和ORF2 基因序列及推导的氨基酸序列与国内外38 个毒株进行比对分析。
2 结果与分析
2.1 病原检测
对病死猪组织分别进行PPV等9种病原检测,结果显示,仅检出PCV3 阳性。
2.2 PCV3 全基因组扩增
将PCV3 全基因组扩增产物经1%琼脂糖凝胶电泳,分别在约1 200 和1 100 bp 处出现扩增条带,其大小与预期基本相符(图1)。通过测序拼接后,获得全长约为2 000 bp 的PCV3 全基因组序列。
2.3 PCV3 毒株全基因组核苷酸序列比对与遗传进化分析
将获得的PCV3 美国毒株命名为PCV3_USA2021(Genbank 登录号:OL799306)。其与国内外38 个毒株核苷酸同源性和遗传进化分析结果显示,PCV3_USA2021 全基因组核苷酸序列与38 个参考毒株序列同源性为98.7%~99.8%,其中,PCV3_USA2021 与美国毒株(PCV3-US_SD2016)、巴西毒株(255_18_42)、中国重庆毒株(PCV3_CN_Chongqing-147_2016)、中国吉林毒株(PCV3-China_JL17-42)、中国山东毒株(PCV3_Shandong-03_2016)、中国广西毒株(PCV3/Guangxi-GL/04)等6 个毒株全基因组序列同源性最高,与俄罗斯毒株(PCV3-RU/SM17)和中国安徽毒株(PCV3/CN/Anhui-14/201611)同源性最低。
遗传进化关系分析结果(图2)显示,PCV3_USA2021 毒株与美国毒株(PCV3-US_SD2016)形成一个小的分支,与中国云南毒株(YN1-2017)、中国吉林毒株(PCV3-China_JL17-42)、中国山东毒株(PCV3_Shandong-03_2016)、中国重庆毒株(PCV3_CN_Chongqing-147_2016)、中国江西毒株(PCV3_CN_Jiangxi-62_2016)、中国广西毒株(PCV3/Guangxi-GL/04)、哥伦比亚毒株(PCV3_COL_Risaralda1_2018)、巴西毒株(255_18_42)、智利毒株(Type 3)、美国毒株(99)、日本毒株(KGS2098-1_2016 DNA)、韩国毒株(PCV3_KU-1605)等均处于一个大分支上,属于PCV3a亚群。
2.4 PCV3 毒株ORF1 基因核苷酸序列比对及推导氨基酸序列分析
将获得的美国毒株PCV3_USA2021 ORF1 基因序列(长度891 bp)与国内外38 个毒株进行核苷酸同源性和遗传进化分析。结果显示,PCV3_USA2021 与38 个参考毒株ORF1 基因核苷酸序列同源性为99.1%~99.9%。其中PCV3_USA2021 与美国毒株(PCV3-US_SD2016)、智利毒株(Type 3)、巴西毒株(255_18_42)、西班牙毒株(35)、中国吉林毒株(PCV3-China_JL17-42)、中国山东毒株(PCV3_Shandong-03_2016)、中国山西毒株(PCV3_Pig_CN_ShanXi170709)等7 条毒株ORF1 基因序列同源性最高,与俄罗斯毒株(PCV3-RU/SM17)及墨西哥毒株(PCV3/MEX/GTO/01/2017)同源性最低。
PCV3_USA2021 ORF1 基因序列推导的Rep 蛋白氨基酸序列(长度297 aa)与国内外38 个毒株同源性为95.3%~100%。其中,PCV3_USA2021 与美国毒株(PCV3-US_SD2016)、德国毒株(DE7.3)、智利毒株(Type 3)、巴西毒株(255_18_42)、越南毒株(NNH/DN7/2018)、西班牙毒株(35)、中国江西毒株(PCV3_CN_Jiangxi-62_2016)、中国重庆毒株(PCV3_CN_Chongqing-147_2016)、中国湖北毒株(CN/Hubei-618/2016)、中国山西毒 株(PCV3_Pig_CN_ShanXi170709)、中 国 吉林毒株(PCV3-China_JL17-42)、中国山东毒株(PCV3_Shandong-03_2016)、中国广西毒株(PCV3/Guangxi-GL/04)、中国福建毒株(FJ37)等14 条毒株推导的Rep 蛋白氨基酸序列同源性最高,与中国广东毒株(PCV3/CN/Guangdong-SG1/2016)同源性最低。
2.5 PCV3 毒株ORF2 基因核苷酸序列比对及推导氨基酸序列分析
将获得的美国毒株PCV3_USA2021 ORF2基因序列(长度645 bp)与国内外38 个毒株进行核苷酸同源性和遗传进化分析。结果显示,PCV3_USA2021 与国内外38 个毒株ORF2 基因核苷酸序列同源性为98.0%~100%。其中PCV3_USA2021 与美国毒株(PCV3-US_SD2016)ORF2基因同源性最高,与中国安徽毒株(PCV3/CN/Anhui-14/201611)同源性最低。
PCV3_USA2021 ORF2 基因序列推导的Cap蛋白氨基酸序列(长度214 aa)与国内外38 个毒株同源性为97.7%~100%。其中,PCV3_USA2021与美国毒株(PCV3-US_SD2016、99 和2164)、塞尔维亚毒株(NIVS)、西班牙毒株(35)、巴西毒株(255_18_42)、哥伦比亚毒株(PCV3_COL_Risaralda1_2018)、匈牙利毒株(PCV3/HU/Szerencs/2017)、韩国毒株(PCV3_KU-1605)、墨西哥毒株(PCV3/MEX/GTO/01/2017)、意大利毒株(PCV3-IT_CO2017)、日本毒株(KGS2098-1_2016 DNA)、智利毒株(Type 3)、中国山西毒株(PCV3_Pig_CN_ShanXi170709)、中国广东毒株(PCV3/CN/Guangdong-SG1/2016)、中国福建毒株(FJ37)、中国南京毒株(PCV3 CN Nanjing 2017)、中国重庆毒株(PCV3_CN_Chongqing-147_2016)、中国江西毒株(PCV3_CN_Jiangxi-62_2016)、中国广西毒株(PCV3/Guangxi-GL/04)、中国吉林毒株(PCV3-China_JL17-42)等21 条毒株推导的氨基酸序列同源性最高,与俄罗斯毒株(PCV3-RU/SM17)同源性最低。
采用生物信息学软件对所得的美国毒株PCV3_USA2021 与国内外38 个毒株Cap 蛋白进行氨基酸位点突变分析。结果(表3)显示,39 条氨基酸序列之间存在16 个突变位点,分别位于5、7、24、27、56、75、77、88、104、124、132、139、150、156、169、211 aa 位置,而本次扩增毒株PCV3_USA2021 以上位点没有突变。
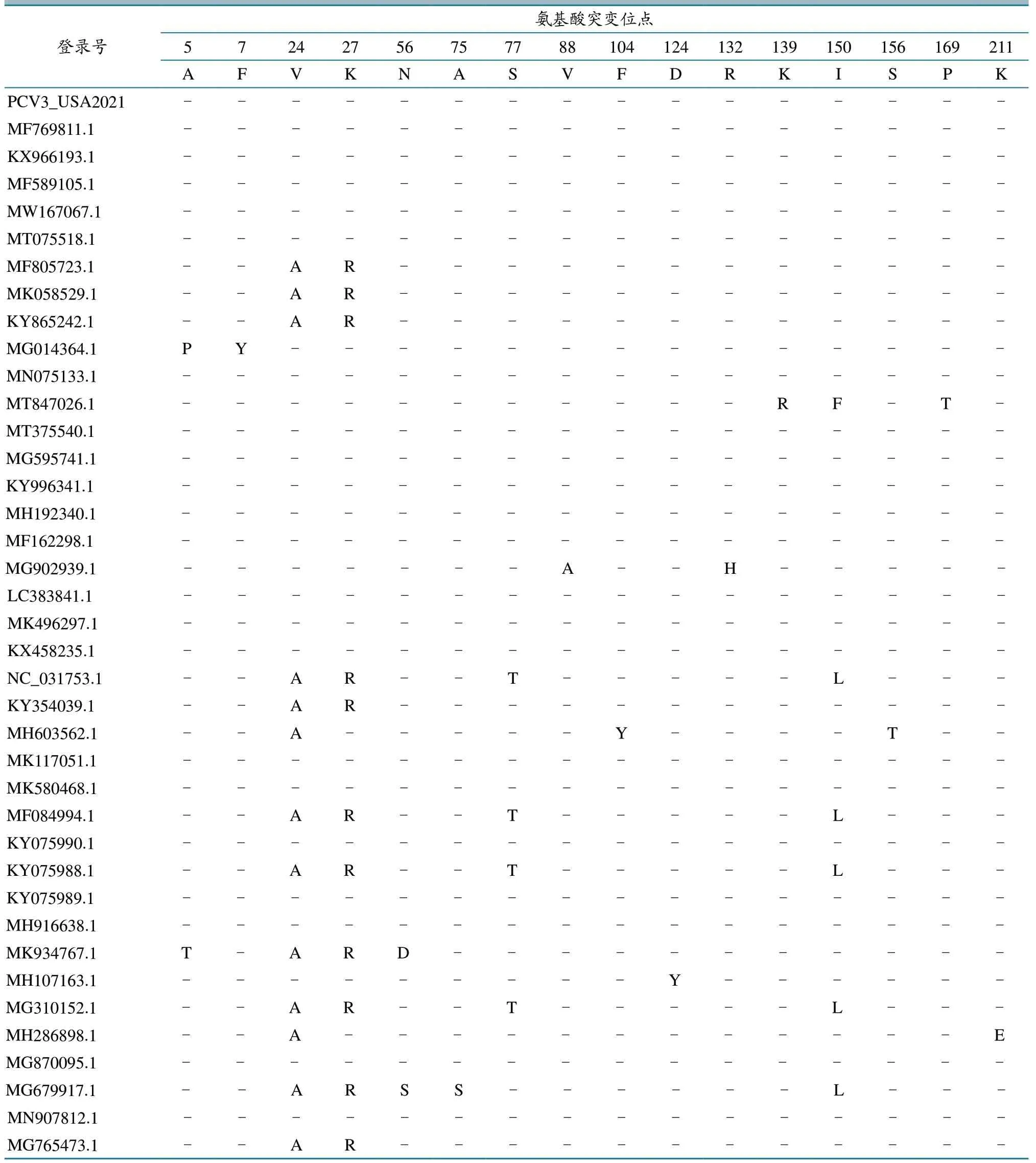
表3 PCV3 Cap 蛋白氨基酸突变位点比对分析
3 讨论
本研究通过采集死亡的进口美国种猪组织,设计引物扩增、拼接后,获取1 条全基因组长度约为2 000 bp 的PCV3 全基因序列,将对应毒株命名为PCV3_USA2021。然后将其与GenBank 收录的38 个国内外不同地区PCV3 参考毒株进行全基因组序列、ORF1 和ORF2 序列比对。分析结果显示,该毒株全基因组序列与参考毒株全基因组具有较高的同源性(98.7%~99.8%),表明不同地区PCV3 的分布没有明显的地域性,PCV3 基因遗传进化特性相对稳定。同时,获得的PCV3 毒株全基因组序列与国内外38 条PCV3 毒株之间的ORF1 及ORF2 的同源性(分别为99.1%~99.9%和98.0%~100%)均高于全基因组序列之间的同源性,且ORF2 基因推导的Cap 蛋白氨基酸之间同源性为97.7%~100%,其中与21 条毒株Cap 蛋白氨基酸序列完全一致。分析结果表明,PCV3 进化相对比较保守。其中,毒株PCV3_USA2021 与美国毒株(PCV3-US_SD2016)同源性最高(99.8%),且通过构建进化树分析发现,该毒株与美国毒株(PCV3-US_SD2016)亲缘关系最近。
根据全基因组序列比对获得的进化树分析结果,推定毒株PCV3_USA2021 为PCV3a 亚型。2016—2018 年美国中西部地区PCV3 流行情况研究报道[14]显示,PCV3a 和PCV3b 两种亚型在美国中西部广泛流行。本研究获取的毒株来自美国中西部地区(内布拉斯加州)进口种猪,与该报道的PCV3a 亚型在美国中西部流行情况一致。
PCV3 Cap 蛋白为主要结构蛋白,可诱导动物机体产生特异性免疫应答。Cap 蛋白氨基酸位点24 位于PCV3 抗体识别表位[19]。Cap 蛋白序列氨基酸位点比对结果显示,PCV3a 和PCV3b ORF2基因编码蛋白的氨基酸位点分别为缬氨酸(V)和丙氨酸(A),说明不同亚种PCV3 毒株可能在抗原性方面存在差异,需进一步研究。因此在种猪引种时,除做好病原检测外,还应结合产地疫病流行情况,选择针对流行毒株的疫苗,提高疫苗免疫保护率,减少经济损失。

