阿魏酸甲酯对缺氧损伤H9c2心肌细胞的线粒体保护作用研究
杨赞 周怡

摘 要 目的 探讨阿魏酸甲酯对 H9c2心肌细胞缺氧损伤后线粒体功能的影响。方法 将细胞分为正常组(不给药、不造模),缺氧模型组(仅造模),阿魏酸甲酯高、中、低(40、20、10 μmol/L)剂量组,阳性对照药组(环孢菌素A ,1 μmol/L)。各给药组细胞经药物预处理及缺氧损伤造模后,检测乳酸脱氢酶(LDH)、丙二醛(MDA)、肌酸激酶(CK)、三磷酸腺苷(ATP)水平,采用流式细胞仪检测细胞内活性氧(ROS)、线粒体膜电位、线粒体膜通透性转换孔开放情况的变化。结果 与缺氧模型组比较,阿魏酸甲酯高、中、低剂量组H9c2心肌细胞中LDH、MDA、CK水平和ROS荧光强度均显著降低,ATP水平均显著升高(P<0.01或P<0.05);线粒体膜电位红/绿荧光强度比值和线粒体膜通透性转换孔绿色荧光强度均显著升高(P<0.01或P<0.05)。结论 阿魏酸甲酯能逆转缺氧损伤H9c2心肌细胞的生化指标水平,稳定线粒体膜电位,降低线粒体膜通透性转换孔的开放程度,对缺氧损伤H9c2心肌细胞线粒体功能具有明显的保护作用,且这种保护作用呈剂量依赖趋势。
关键词 阿魏酸甲酯;心肌缺血;缺氧损伤;线粒体;H9c2心肌细胞
中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2022)01-0013-06
DOI 10.6039/j.issn.1001-0408.2022.01.03
ABSTRACT OBJECTIVE To investigate the effects of methyl ferulate (MF) on the mitochondrial function of H9c2 cardiomyocytes after hypoxia-induced injury. METHODS H9c2 cardiomyocytes were divided into normal group (no administration, no modeling), hypoxia model group (modeling alone), MF high-dose, medium-dose and low-dose groups (40, 20, 10 μmol/L) and positive control drug group (cyclosporin A, 1 μmol/L). After drug pretreatment and inducing hypoxia-induced injury, the levels of lactate dehydrogenase (LDH), malondialdehyde (MDA), creatine kinase (CK) and adenosine triphosphate (ATP) were tested. The intracellular reactive oxygen species (ROS), mitochondrial membrane potential (MMP), the opening of mitochondrial membrane permeability transition pore (mPTP) were detected with flow cytometry. RESULTS Compared with hypoxia model group, the levels of LDH, MDA, CK and ROS fluorescence intensity were decreased significantly in MF high-dose, medium-dose and low-dose groups, while the level of ATP was increased significantly (P<0.01 or P<0.05). The red/green fluorescence intensity ratio of MMP and the green fluorescence intensity of mPTP were increased significantly (P<0.01 or P<0.05). CONCLUSIONS MF can reverse the levels of biochemical indexes in H9c2 cardiomyocyte after hypoxia-induced injury, keep MMP stable, reduce the opening of mPTP, and has an obvious protective effect on the mitochondrial function of H9c2 cardiomyocytes injured by hypoxia, and this protective effect is dose-dependent.
KEYWORDS methyl ferulate; myocardial ischemia; hypoxia-induced injury; mitochondria; H9c2 cardiomyocytes
目前,缺血性心脏病占居民疾病死因构成的40%以上,严重威胁着人类健康[1]。近年来,随着心肌缺血治疗的发展,研究者提出了“能量饥饿”的概念[2],认为能量代谢紊乱是缺血性心脏病发病过程中普遍存在的现象,激发与扶持心肌内源性能量、使心脏重新恢复正常心肌代谢模式、增强心肌细胞抗损伤能力,是保护心肌缺血的新选择[2-4]。心脏作为高耗能的器官,需要每日消耗大量的三磷酸腺苷(adenosine triphosphate,ATP)[5]。線粒体通过氧化磷酸化过程产生大量ATP用以维持心肌细胞的舒张、收缩、离子泵功能[6-7]。心肌缺血过程会使线粒体的结构和功能发生改变,导致线粒体自身稳态平衡遭到破坏,引起细胞内活性氧(reactive oxygen species,ROS)增加,促发线粒体膜通透性转换孔开放,继而导致电子传递链解偶联、线粒体膜电位下降、ATP生成障碍[8]。因此,对线粒体功能的保护作用是药物抗心肌缺血的重要研究方向。阿魏酸甲酯为本课题组前期从藏药复方三味檀香散中鉴定到的活性成分,其可以提高缺氧损伤H9c2心肌细胞的存活率。本研究主要探讨阿魏酸甲酯对缺氧损伤H9c2心肌细胞线粒体功能的影响,以期在细胞层面明确阿魏酸甲酯对缺氧心肌细胞的保护作用。
1 材料
1.1 主要仪器
本研究所用主要仪器有:YXQ-LS-100A型电热压力蒸汽消毒器、GZX-9140MBE型电热恒温鼓风干燥箱、SW-CJ-2F型超净工作台、BSC-1300ⅡA2型生物安全柜(上海博讯实业有限公司),TDL-50B型低速台式离心机(上海安亭科学仪器厂),TG16-WS型高速台式离心机(长沙湘仪离心机仪器公司),ECLIPSE Ti-s型倒置荧光显微镜(日本Nikon公司),细胞计数板(上海医用仪器厂),细胞培养瓶及细胞培养板(美国CoStar公司),XB120A型电子分析天平(瑞士Precisa公司),ELX800酶联免疫检测仪(美国Bio-Tek公司),MCO-15AC-SC型CO2培养箱(日本Sanyo公司),Cytoflex型流式细胞仪(美国Beckman Coulter公司)。
1.2 主要药品及试剂
阿魏酸甲酯、环孢霉素A均购自河南奥科标准物质科技有限公司(批号分别为BD105676、C106893,纯度分别为99%、98%);DMEM高糖培养基、胎牛血清购自美国Gibco公司(批号分别为11995-065、10099-141);胰蛋白酶、青霉素-链霉素溶液(100×)、0.25%胰蛋白酶、线粒体膜通透性转换孔检测试剂盒、ROS检测试剂盒购自上海碧云天生物技术有限公司(批号分别为C0201、C0222、C0201、C2009S、S0033);JC-1线粒体膜电位检测试剂盒购自上海翊圣生物科技有限公司(批号40706ES60);磷酸盐缓冲液(phosphate buffer,PBS)购自北京中杉金桥生物技术有限公司(批号B040100);乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、肌酸激酶(creatine kinase,CK)检测试剂盒购自南京建成科技有限公司(批号分别为A020-2-2、A003-1-1、A032-1-1);大鼠ATP ELISA试剂盒购自上海酶联生物科技有限公司(批号ml059183);其余试剂均为分析纯或实验室常用规格。
1.3 细胞
本研究所用细胞为大鼠H9c2心肌细胞株,购自中国科学院上海细胞库。
2 方法
2.1 H9c2心肌细胞培养
H9c2心肌细胞培养于含10%胎牛血清、1%青霉素-链霉素双抗的DMEM高糖培养基中,2~3 d更换1次培养液,在细胞融合度为80%时按照1 ∶ 3比例进行传代,于37 ℃、5%CO2、饱和湿度培养箱中培养。
2.2 分组、造模及给药
将细胞分为6组:正常组,缺氧模型组,阿魏酸甲酯高、中、低剂量组,阳性对照药组。正常组:细胞常规培养2 h,不进行造模;缺氧模型组:参照文献[9-13]造模,将细胞维持在含有复合成分缓冲液(NaCl 137 mmol/L、KCl 12 mmol/L、MgCl2 0.5 mmol/L、CaCl2 0.9 mmol/L、羟乙基哌嗪乙硫磺酸20 mmol/L、2-脱氧-D-葡萄糖20 mmol/L,pH6.2)中诱导缺氧,并于37 ℃、0.1%O2、5%CO2、95%N2的缺氧培养箱中放置1 h;阿魏酸甲酯各剂量组:在缺氧造模前加入高、中、低剂量的阿魏酸甲酯(浓度分别为40、20、10 μmol/L)预处理1 h,再按照“缺氧模型组”的方法进行处理;阳性对照药组:在缺氧造模前加入环孢菌素A 1 μmol/L预处理1 h,再按照“缺氧模型组”的方法进行处理。实验中阿魏酸甲酯和环孢菌素剂量根据前期预实验结果进行设置。每组重复实验3次。
2.3 H9c2心肌细胞形态的观察
将细胞按照“2.2”项下方法分组处理后,置于倒置显微镜下观察H9c2心肌细胞形态的变化。
2.4 H9c2心肌细胞上清液中生化指标的检测
将细胞按照“2.2”项下方法分组处理后,采用相应的生化指标试剂盒检测。用无菌管收集细胞培养上清液,以3 000 r/min离心20 min后收集上清液,采用相应试剂盒检测LDH、MDA、CK的水平。以PBS(pH 7.2~7.4)稀释细胞悬液,使细胞密度达1×106 mL-1左右,通过反复冻融,使细胞破坏并释放出细胞内成分,以2 500 r/min离心20 min,收集上清液,采用ATP ELISA试剂盒检测ATP的水平。
2.5 H9c2心肌细胞中ROS的检测
采用流式细胞仪检测。使用胰酶消化细胞,将细胞悬液转移到15 mL离心管中,以1 500 r/min离心5 min,去除上清液,加入新鲜DMEM完全培养基,并用移液管将细胞吹打均匀。用细胞计数板计数细胞悬液的密度,使细胞密度达5×104 mL-1左右。将细胞悬液接种至6孔板,于37 ℃培养箱中培养。将细胞按照“2.2”项下方法分组处理后,使用胰酶消化细胞,加入DMEM完全培养基终止消化,制成细胞悬液,以3 500 r/min离心5~10 min收集细胞;使用PBS洗涤1~2次,离心收集细胞沉淀,每管加入100 μL ROS检测染色液,以37 ℃培养30 min后离心,收集细胞;使用PBS洗涤细胞1~3次,再用200 μL PBS重悬细胞,进行ROS荧光强度定量检测。检测的最大激发波长为490 nm,最大发射波长为525 nm。结果解析:平均荧光强度值越大,细胞中产生的ROS越多。
2.6 H9c2心肌细胞线粒体膜电位的检测
采用流式细胞仪检测。将细胞接种于6孔板,于37 ℃培养箱贴壁培养。将细胞按照“2.2”项下方法分组处理后,使用胰酶消化细胞,以1 500 r/min离心5 min后,于0.5 mL细胞培养液中重悬,加入0.5 mL JC-1染色工作液,颠倒数次混匀,于37 ℃细胞培养箱中培养20 min。在培養期间,按照1 mL JC-1染色缓冲液(5×)加入4 mL蒸馏水的比例,配制适量的JC-1染色缓冲液(1×),冰浴备用。细胞培养结束后,以2 000 r/min在4 ℃离心3~4 min,沉淀细胞,弃上清液,注意尽量不要吸除细胞;加入1 mL JC-1染色缓冲液(1×)重悬细胞,以2 000 r/min 在4 ℃离心3~4 min,沉淀细胞,弃上清液,再用适量JC-1染色缓冲液(1×)重悬后,进行线粒体膜电位荧光强度定量检测。检测JC-1单体时,最大激发波长为490 nm,最大发射波长为530 nm;检测JC-1聚合物时,最大激发波长为525 nm,最大发射波长为590 nm。结果解析:横坐标表示绿色荧光强度,纵坐标表示红色荧光强度,当红/绿荧光强度比值降低时,表示细胞线粒体膜电位降低。
2.7 H9c2心肌细胞线粒体膜通透性转换孔开放情况的检测
采用流式细胞仪检测。将细胞接种于6孔板,37 ℃培养箱贴壁培养。将细胞按照“2.2”项下方法分组处理后,使用胰酶消化细胞,加入终止液,以1 500 r/min离心5 min,收集细胞;用PBS洗涤1~2次,离心收集细胞沉淀;加入200 μL荧光淬灭工作液(在Calcein AM染色液中添加CaCl2),颠倒数次混匀,在37 ℃细胞培养箱中培养30 min。细胞培养结束后,以1 500 r/min离心5 min,收集沉淀细胞;使用PBS洗涤2次,再用200 μL PBS重悬细胞,进行线粒体膜通透性转换孔荧光强度定量检测。检测的最大激发波长为494 nm,最大发射波长为517 nm。结果解析:以绿色荧光的强弱表示线粒体膜通透性转换孔的开放程度,绿色荧光越强,开放程度越低。
2.8 统计学分析
采用SPSS 21.0统计软件进行数据分析。计量资料满足正态分布时以x±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
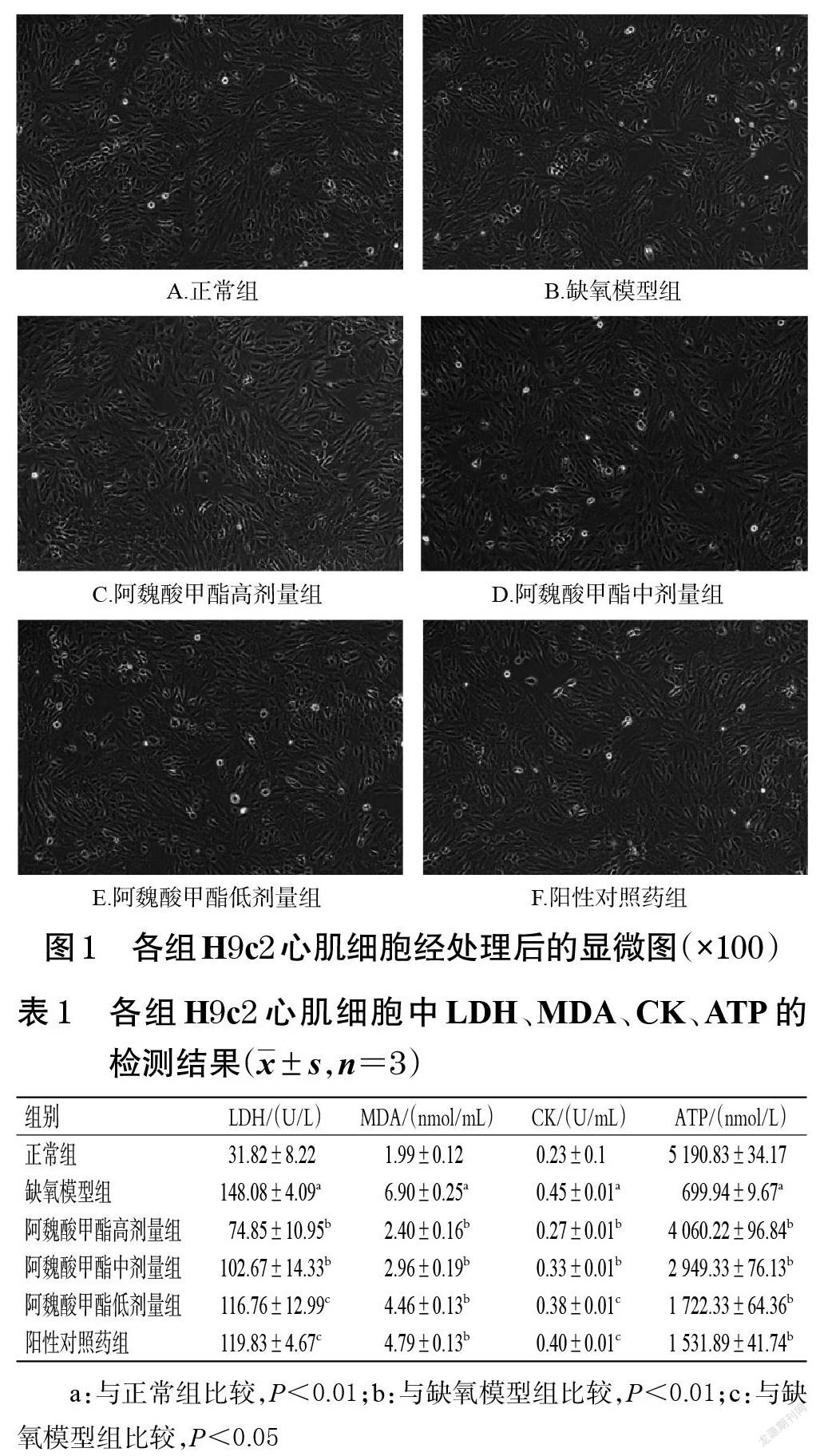
3.1 H9c2心肌细胞形态观察结果
倒置显微镜下可见,各组H9c2心肌细胞经处理后,细胞形态饱满,均一性良好(图1),表明阿魏酸甲酯高、中、低劑量和阳性对照药对 H9c2心肌细胞均无毒性。
3.2 阿魏酸甲酯对H9c2心肌细胞生化指标的影响
与正常组比较,缺氧模型组H9c2心肌细胞中LDH、MDA、CK水平均显著升高,ATP水平显著降低(P<0.01);与缺氧模型组比较,阿魏酸甲酯高、中、低剂量组及阳性对照药组H9c2心肌细胞中LDH、MDA、CK水平均显著降低,ATP水平均显著升高(P<0.01或P<0.05)。结果见表1。
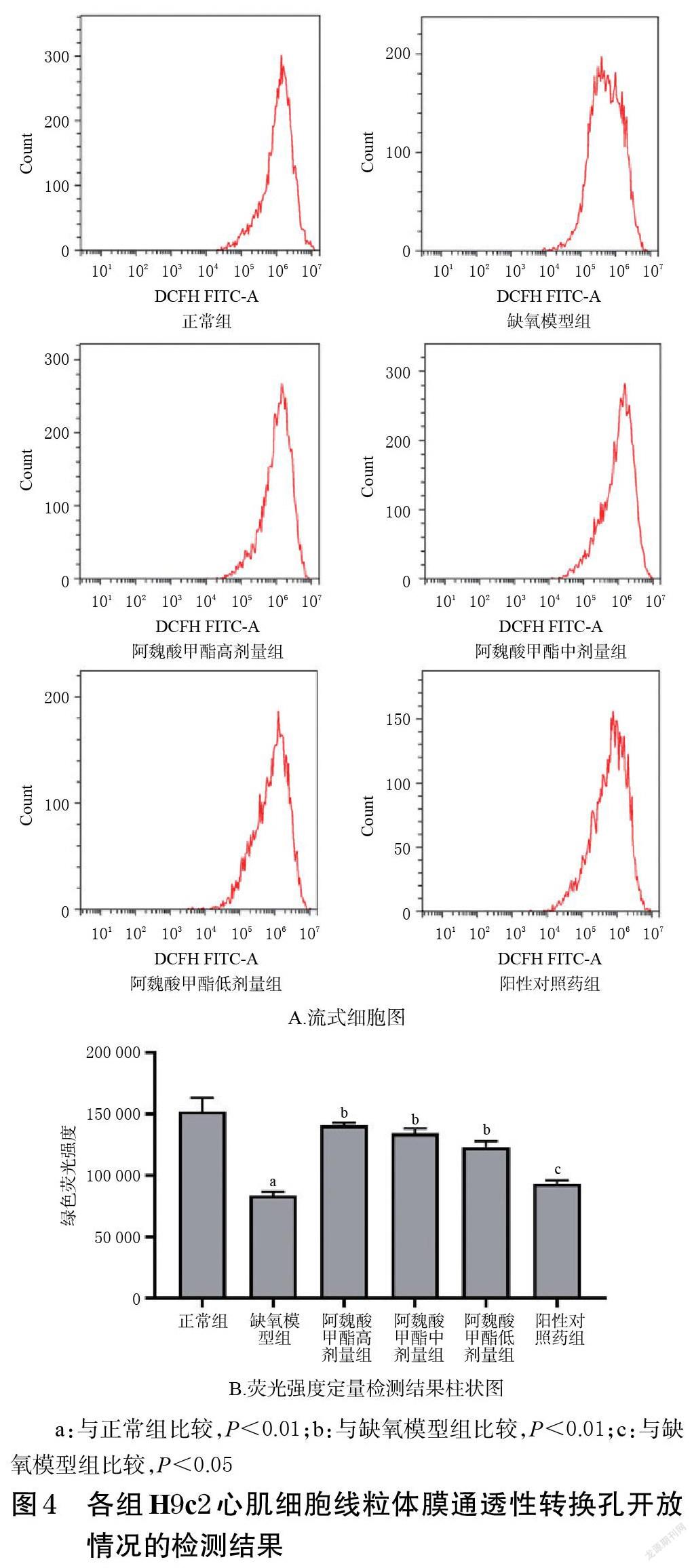
3.3 阿魏酸甲酯对H9c2心肌细胞中ROS的影响
与正常组比较,缺氧模型组H9c2心肌细胞中ROS荧光强度显著升高(P<0.01);与缺氧模型组比较,阿魏酸甲酯高、中、低剂量组及阳性对照药组H9c2心肌细胞中ROS荧光强度均显著降低(P<0.01或P<0.05)。结果见图2。
3.4 阿魏酸甲酯对H9c2心肌细胞线粒体膜电位的影响
与正常组比较,缺氧模型组H9c2心肌细胞线粒体膜电位的红/绿荧光强度比值显著降低(P<0.01);与缺氧模型组比较,阿魏酸甲酯高、中、低剂量组及阳性对照药组H9c2心肌细胞线粒体膜电位的红/绿荧光强度比值均显著升高(P<0.01)。结果见图3。
3.5 阿魏酸甲酯对H9c2心肌细胞线粒体膜通透性转换孔开放情况的影响
与正常组比较,缺氧模型组H9c2心肌细胞线粒体膜通透性转换孔绿色荧光强度显著降低(P<0.01);与缺氧模型组比较,阿魏酸甲酯高、中、低剂量组及阳性对照药组H9c2心肌细胞线粒体膜通透性转换孔绿色荧光强度均升高(P<0.01或P<0.05)。结果见图4。
4 讨论
阿魏酸甲酯即4-羟基-3-甲氧基肉桂酸甲酯,是阿魏酸的衍生物,具有抗氧化、抗菌、抗炎活性[14-15]。有研究表明,阿魏酸甲酯较阿魏酸具有更高的活性、更低的毒性,有较好的开发应用前景[16-17]。本课题组前期鉴定结果显示,阿魏酸甲酯为藏药复方三味檀香散中的活性成分,故本研究在细胞层面深入探讨其对缺氧损伤心肌细胞的保护作用。
本研究通过构建H9c2心肌细胞缺氧模型,以阿魏酸甲酯高、中、低剂量和阳性对照药(环孢菌素A)对各组细胞进行处理后,倒置显微镜观察可见细胞形态饱满、均一性良好,表明阿魏酸甲酯和环孢菌素A对H9c2心肌细胞均无毒性。本研究通过构建H9c2心肌细胞缺氧模型,观察阿魏酸甲酯预处理对细胞上清液中生化指标、ROS、线粒体膜电位、线粒体膜通透性转换孔开放情况的影响。
LDH、CK是检验心脏受损的重要指标之一,当心肌细胞发生损伤后,细胞破裂,细胞质中的LDH、CK会漏出,二者活力的大小直接反映心肌细胞受损程度[18]。本研究结果显示,相较于缺氧模型组,阿魏酸甲酯高、中、低剂量组H9c2心肌细胞上清液中LDH、CK水平显著降低,说明阿魏酸甲酯能够维持细胞膜的完整性,减少LDH、CK的漏出,对受损的心肌细胞具有保护作用,且这种保护作用呈剂量依赖趋势。
ROS作为一类含氧的化学物质,性质活泼且在细胞中易扩散;当心肌细胞处于缺血和缺氧状态时,ROS会过度生成,诱发氧化应激[19-21]。MDA是脂膜过氧化作用的产物之一,细胞内氧化程度越高,MDA水平越高[22]。在本研究中,与正常组比较,缺氧模型组ROS的荧光强度、MDA水平均显著升高,说明缺氧造成了细胞损伤;而经阿魏酸甲酯高、中、低剂量处理后,细胞中ROS的荧光强度和MDA水平均显著降低,表明阿魏酸甲酯可有效清除自由基,有一定的抗氧化作用,这与其他研究结论一致[23]。
保护线粒体功能是治疗心肌缺血的新选择。已有研究证实,缺血会严重损伤线粒体的功能并伴随ATP的生成障碍[24]。本研究发现,阿魏酸甲酯显著增加了细胞线粒体内ATP水平,表明其可刺激心肌内源性能量的生成。线粒体膜通透性转换孔是位于线粒体内膜上的非特异性通道,其开放会引起心肌不可逆损伤,表现为ATP生成障碍、ROS过度生成、钙超载,继而导致线粒体膜电位下降[25-26]。本研究结果显示,与缺氧模型组比较,加入高、中、低剂量阿魏酸甲酯能稳定线粒体膜电位,降低线粒体膜通透性转换孔的开放程度,说明阿魏酸甲酯对缺氧损伤H9c2心肌细胞的线粒体功能有一定保护作用。
综上所述,阿魏酸甲酯具有保护缺氧损伤H9c2心肌细胞线粒体功能的作用,且这种保护作用呈剂量依赖趋势。其确切的信号通路有待后续实验进一步研究。
参考文献
[ 1 ] GBD Causes of Death Collaborators. Global,regional,and national age-sex specific mortality for 264 causes of death,1980-2016:a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet,2017,390(10100):1151-1210.
[ 2 ] VAN BILSEN M. “Energenetics” of heart failure[J]. Ann N Y Acad Sci,2004,1015:238-249.
[ 3 ] KATZ A M. The myocardium in congestive heart failure[J]. Am J Cardiol,1989,63(2):12A-16A.
[ 4 ] VAN BILSEN M,SMEETS P J,GILDE A J,et al. Metabolic remodelling of the failing heart:the cardiac burn-out syndrome? [J]. Cardiovasc Res,2004,61(2):218-226.
[ 5 ] MURPHY E,ARDEHALI H,BALABAN R S,et al. Mitochondrial function,biology,and role in disease:a scientific statement from the American Heart Association[J]. Circ Res,2016,118(12):1960-1991.
[ 6 ] MURPHY E,STEENBERGEN C. Preconditioning:the mitochondrial connection[J]. Annu Rev Physiol,2007,69:51-67.
[ 7 ] SUGA H. Ventricular energetics[J]. Physiol Rev,1990,70(2):247-277.
[ 8 ] ARMSTRONG J S. The role of the mitochondrial permeability transition in cell death[J]. Mitochondrion,2006,6(5):225-234.
[ 9 ] RESHMA P L,SAINU N S,MATHEW A K,et al. Mitochondrial dysfunction in H9c2 cells during ischemia and amelioration with Tribulus terrestris L.[J]. Life Sci,2016,152:220-230.
[10] LOOS B,GENADE S,ELLIS B,et al. At the core of survival:autophagy delays the onset of both apoptotic and necrotic cell death in a model of ischemic cell injury[J]. Exp Cell Res,2011,317(10):1437-1453.
[11] ESUMI K,NISHIDA M,SHAW D,et al. NADH measurements in adult rat myocytes during simulated ischemia[J]. Am J Physiol,1991,260(6 Pt 2):H1743-H1752.
[12] RESHMA P L,LEKSHMI V S,SANKAR V,et al. Tribulus terrestris (linn.) attenuates cellular alterations induced by ischemia in H9c2 cells via antioxidant potential[J]. Phytother Res,2015,29(6):933-943.
[13] RESHMA P L,BINU P,ANUPAMA N,et al. Pretreatment of Tribulus terrestris L. causes anti-ischemic cardioprotection through MAPK mediated anti-apoptotic pathway in rat[J]. Biomed Pharmacother,2019,111:1342- 1352.
[14] KIKUZAKI H,HISAMOTO M,HIROSE K,et al. Antioxi- dant properties of ferulic acid and its related compounds[J]. J Agric Food Chem,2002,50(7):2161-2168.
[15] OU S Y,KWOK K C. Ferulic acid:pharmaceutical functions,preparation and applications in foods[J]. J Sci Food Agric,2004,84(11):1261-1269.
[16] WANG F,PENG Q Q,LIU J F,et al. A novel ferulic acid derivative attenuates myocardial cell hypoxia reoxygena- tion injury through a succinate dehydrogenase dependent antioxidant mechanism[J]. Eur J Pharmacol,2019,856:172417.
[17] 王献钊,刘明娣.阿魏酸及阿魏酸乙酯的合成[J].湖南城市学院学报(自然科学版),2007,16(4):63-65.
[18] CHANG S S,LEE V S,TSENG Y L,et al. Gallic acid attenuates platelet activation and platelet-leukocyte aggregation:involving pathways of Akt and GSK3β[J]. Evid Based Complement Alternat Med,2012,2012:683872.
[19] VALKO M,RHODES C J,MONCOL J,et al. Free radicals,metals and antioxidants in oxidative stress-induced cancer[J]. Chem Biol Interact,2006,160(1):1-40.
[20] SIES H. Oxidative stress:oxidants and antioxidants[J]. Exp Physiol,1997,82(2):291-295.
[21] 阿瓦古麗·达吾提,方莲花,杜冠华.丹酚酸对缺血性心脏病的作用及作用机制研究进展[J].药学学报,2021,56(2):368-373.
[22] JI C C,SONG F,HUANG G Y,et al. The protective effects of acupoint gel embedding on rats with myocardial ischemia-reperfusion injury[J]. Life Sci,2018,211:51-62.
[23] MASUDA T,YAMADA K,MAEKAWA T,et al. Antioxidant mechanism studies on ferulic acid:isolation and structure identification of the main antioxidation product from methyl ferulate[J]. Food Sci Technol Res,2006,12(3):173-177.
[24] MCCULLY J D,ROUSOU A J,PARKER R A,et al. Age- and gender-related differences in mitochondrial oxygen consumption and calcium with cardioplegia and diazoxide[J]. Ann Thorac Surg,2007,83(3):1102-1109.
[25] JIA P Y,LIU C T,WU N,et al. Agomelatine protects against myocardial ischemia reperfusion injury by inhibi- ting mitochondrial permeability transition pore opening[J]. Am J Transl Res,2018,10(5):1310-1323.
[26] ZHANG C,YUAN X R,HU Z L,et al. Valproic acid protects primary dopamine neurons from MPP+-induced neurotoxicity:involvement of GSK3β phosphorylation by Akt and ERK through the mitochondrial intrinsic apoptotic pathway[J]. Biomed Res Int,2017,2017:8124501.
(收稿日期:2021-08-17 修回日期:2021-12-02)
(编辑:舒安琴)

