Met+H2O复合体系手性转变反应中间体电子激发表征
鲍 捷, 韩志文, 李 莹, 陈洪斌, 祝 颖
(1. 吉林医药学院 生物医学工程学院, 吉林 吉林 132013;2. 吉林大学附属中学 物理教研室, 长春 130021)
甲硫氨酸(Met)是组成生物体蛋白质重要的氨基酸之一, Met分子体系的分子特性研究已引起人们广泛关注: 文献[1]研究表明, 在噪声暴露前口服Met片可有效减轻暴露后噪声性听功能损害程度; 文献[2]给出了非限域条件下单体Met分子手性转变过程的第三反应通道机制; 文献[3]研究表明, 具有正向调节酪蛋白合成与分泌作用的Met分子可通过激活mTOR信号通路调节奶牛乳腺中酪蛋白的生物合成; 文献[4]计算了隐式溶剂下左旋体S-Met分子手性对映体激发态的波函数, 并基于原子电荷计算片段间的电荷转移百分数. 隐式溶剂氯仿下, 关于Met分子与显式水溶剂共同作用手性转变中基元反应中间体分子体系电子激发特性的对比研究目前尚未见文献报道. 基于此, 本文给出隐式溶剂氯仿下Met分子与显式水溶剂共同作用手性转变中第一基元反应中间体等分子体系的空穴-电子、 自然跃迁轨道(NTO)和电荷密度差(CDD)等值面图, 并分析中间体激发态的性质及其电子结构, 从而为隐式溶剂氯仿下外界条件诱导引发Met分子手性转变机制的研究提供参考依据.
1 理论和计算方法
空穴-电子分析可将电子和空穴的分布同时转化成统计数据, 从而方便地判断电子激发类型. 为便于通过一些定量数值衡量和讨论电子的激发特征, 文献[5]对空穴-电子在全空间中的分布特征进行了定量描述. 等值面图在等值面上每个点的数值均等于人为指定的数值, 通过它可直观了解密度差在三维空间中的分布. 激发态与基态的电荷密度差Δρ=ρele-ρhole, 用空穴-电子分析CDD是将电子和空穴的密度求差, 展现的是二者在交叠区域已发生过抵消的图.
采用密度泛函(DFT)理论中的B3LYP[6]方法, 在6-311+G(2df)基组水平优化气相条件下Met分子的几何构型, 并寻找Met+H2O复合体系手性转变过程中各基元反应中间体和过渡态特征, 在此基础上, 基于M06-2X理论方法, 在加有弥散函数的aug-cc-pVTZ[7]基组水平上, 用含时密度泛函理论(TDDFT)方法进行电子激发计算, 并分析该分子体系Rydberg激发特性. 所有计算均在Gaussian 16[8]软件包内完成, 用Multiwfn_3.7(dev)程序[5,9-11]进行波函数分析, 用GaussView5.0软件绘制图形.
2 结果与讨论
2.1 气相Met+H2O复合体系手性转变过程中各基元反应
2.1.1 气相Met分子体系基态构型
气相条件下左旋体S-Met分子的几何构型[4]如图1所示. 用空穴-电子分析理论对气相环境下Met+H2O复合体系手性转变过程中各基元反应的过渡态电子激发类型进行研究.

图1 气相S-Met分子的几何构型Fig.1 Geometry of S-Met molecule in gas phase
2.1.2 气相Met+H2O复合体系手性转变过程中各基元反应过程
在B3LYP/6-311+g(2df)基组水平上优化气相条件下Met分子的几何构型, 并寻找Met+H2O复合体系手性转变过程中各基元反应中间体和过渡态特征. 主要反应路径为:S-Met+H2O→TS1-S-Met+H2O→INT1-S-Met+H2O→TS*-Met+H2O→INT1-R-Met+H2O→TS1-R-Met+H2O→R-Met+H2O.
2.1.3 气相Met+H2O复合体系手性转变过程中基元反应物的状态
S-Met+H2O→TS1-S-Met+H2O→INT1-S-Met+H2O过程形成第一基元反应, 其反应物、 过渡态和产物的几何结构以及过渡态的虚频振动模式如图2所示. INT1-S-Met+H2O→TS2-S-Met+H2O→INT2-S-Met+H2O过程形成第二基元反应. 由于中间体经第二基元反应后呈近似平面构型, 因此可通过同分异构过程, 并经H原子回迁过程形成产物R-Met+H2O, 最后完成S-Met+H2O→R-Met+H2O的手性转变过程.
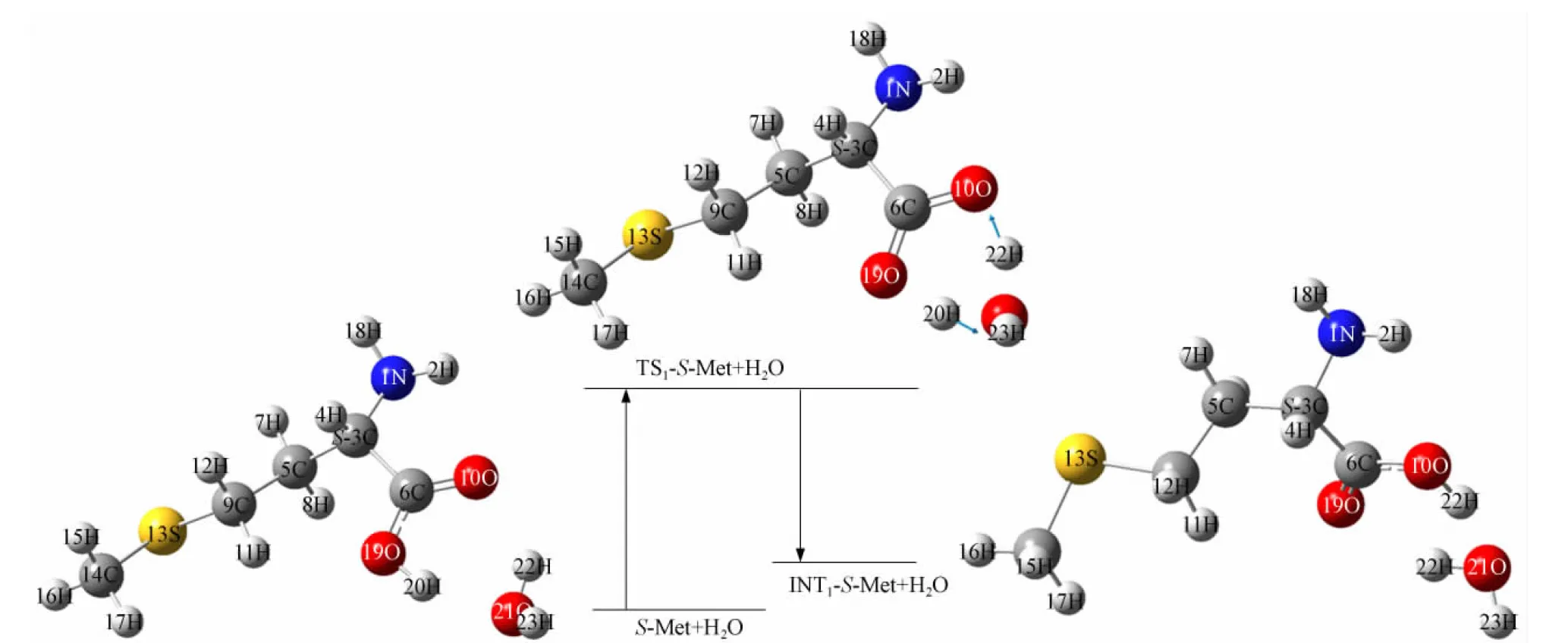
图2 S-Met+H2O→TS1-S-Met+H2O→INT1-S-Met+H2O的反应过程Fig.2 Reaction process of S-Met+H2O→TS1-S-Met+H2O→INT1-S-Met+H2O
2.2 S-Met-CHCl3+H2O复合体系手性转变第一基元反应中间体的电子激发特征
在M06-2X/aug-cc-pVTZ下, 用TDDFT方法进行电子激发计算, 给出隐式溶剂氯仿下S-Met+H2O(S-Met-CHCl3+H2O)复合体系手性转变第一基元反应中间体INT1-S-Met-CHCl3+H2O分子体系在电子激发过程中的激发态特性.
2.2.1 INT1-S-Met-CHCl3+H2O分子体系电子激发特征的空穴-电子分析
在M06-2X/aug-cc-pVTZ水平下,S-Met-CHCl3+H2O复合体系手性转变第一基元反应中间体INT1-S-Met-CHCl3+H2O分子体系由基态S0到激发态S1~S10的衡量空穴与电子质心间距离的指数D、 描述空穴与电子分布间重叠函数的指数Sr、 体现空穴与电子总体平均分布广度的指数H、 衡量空穴与电子分离程度的指数t及另一种衡量电子和空穴质心间距离的指数Δr列于表1.

表1 INT1-S-Met-CHCl3+H2O分子体系由基态S0到激发态S1~S10的数据
由表1可见: S0→S8的D指数值高达0.304 nm, 具有明显电荷转移激发(CT)特征, 即激发态电子激发类型具有单方向电荷转移激发特征; S0→S1~S10的Sr指数值均较小, 最大值为0.47 a.u., 其离域程度较高, 该激发态电子激发类型具有Rydberg激发特征; S0→S6和S7的t指数值远小于0, 分别为-0.134,-0.147 nm, 表明在CT方向上空穴和电子没有显著分离, 该激发态电子激发类型具有局域激发(LE)特征; S0→S2,S5,S6,S9,S10的Δr指数值分别为0.372,0.293,0.274,0.307,0.295 nm, 该激发态电子激发类型具有CT激发或Rydberg激发特征; S1,S3,S4的激发态类型表征不明显, S6激发态无法直接区分, 需借助其他图形分析方法进行解释和判断.
2.2.2 INT1-S-Met-CHCl3+H2O分子体系电子激发类型的NTO图解表征
INT1-S-Met-CHCl3+H2O分子体系的S1,S3,S4,S6等激发态类型表征不明显, 通过NTO特征判断其电子激发类型, 其中该分子体系激发态S1,S3,S4,S6的NTO45和NTO46特征如图3所示(等值面数值为ρ). 由图3可见: S1-NTO45可指认13S原子的孤对电子轨道, 对9C—11H,9C—12H,14C—15H,14C—17H的σ键略有贡献, 可忽略该次要特征; S1-NTO46是9C—13S和13S—14C键的反σ(σ*)轨道, 判断指认结果为激发态S1的激发模式为n→σ*局域激发; S3-NTO45可指认19O原子的孤对电子轨道, 对1N和10O原子的孤对电子及3C—6C的σ键略有贡献, 可忽略该次要特征, S3-NTO46是6C—10O和6C—19O键的反π(π*)轨道, 判断指认结果为激发态S3的激发模式为n→π*的局域激发; S4-NTO45指认与S1-NTO45分析一致, S4-NTO46具有p型Rydberg激发特征, 判断指认结果为激发态S4的激发模式为n→p型Rydberg激发; S6-NTO45可指认13S原子的孤对电子轨道, 1N原子孤对电子轨道贡献也较大, S6-NTO46是6C—19O键的反π(π*)轨道, 对1N和15O略有贡献, 可忽略该次要特征, 判断指认结果为激发态S6的激发模式为n→π*的电荷转移激发.
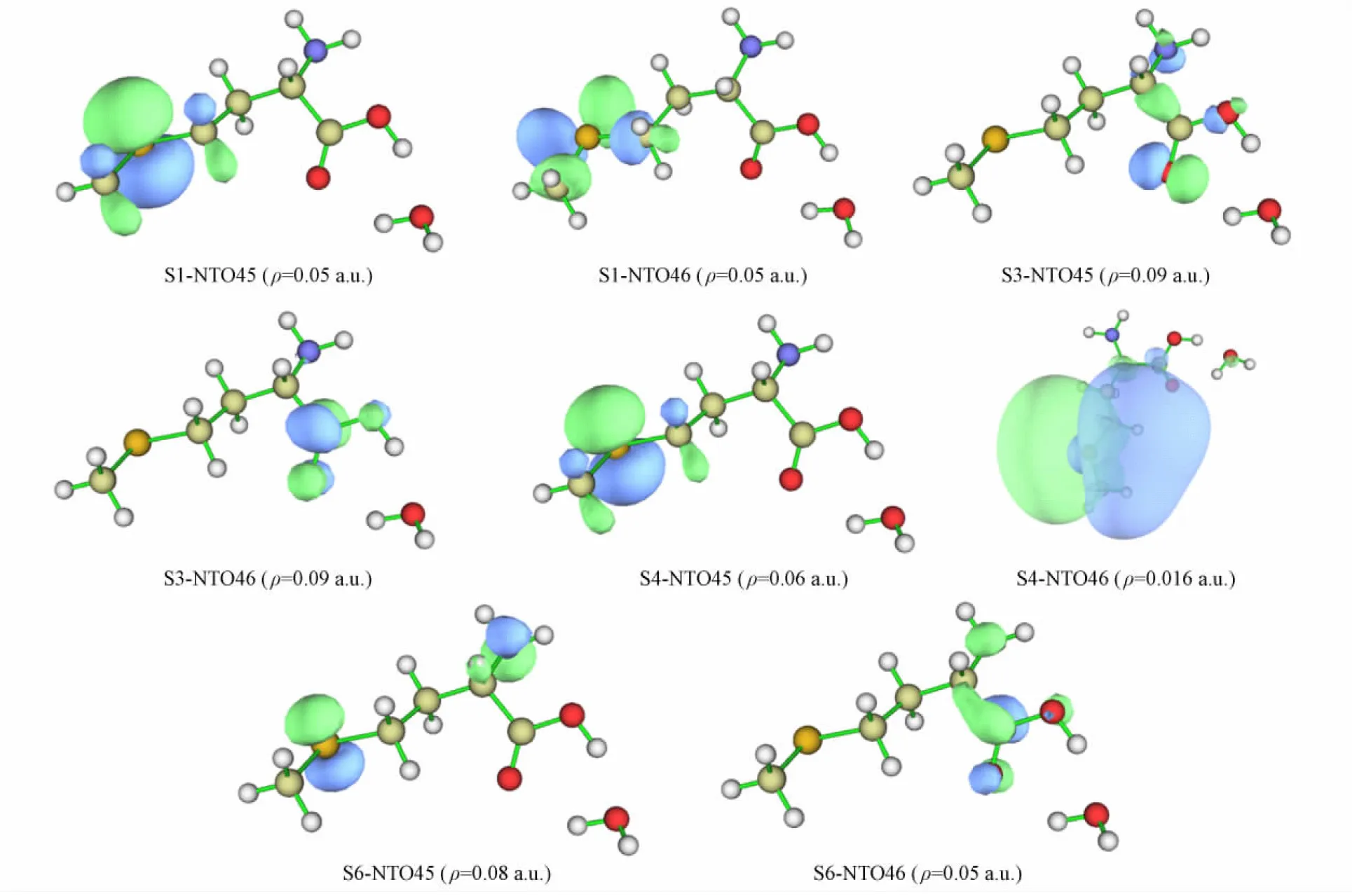
图3 INT1-S-Met-CHCl3+H2O分子体系激发态S1,S3,S4,S6的NTO特征Fig.3 NTO characteristics of excitated states S1,S3,S4,S6 of INT1-S-Met-CHCl3+H2O molecular system
2.2.3 INT1-S-Met-CHCl3+H2O分子体系的CDD等值面
利用空穴和电子分布计算INT1-S-Met-CHCl3+H2O分子体系激发态S1~S6的CDD并做等值面图形, 结果如图4所示, 其中绿色和蓝色分别对应激发态密度相对于基态密度增加和减少的部分. 由图4可见: 激发态S1和S3的激发类型可指认为局域激发; 激发态S2的激发类型可指认为s型Rydberg激发; 激发态S4和S5的激发类型可指认为p型Rydberg激发; 激发态S6的激发类型可指认为电荷转移激发. 基于空穴-电子分布计算得到的CDD等值面与空穴-电子数据分析对INT1-S-Met-CHCl3+H2O分子体系激发态的激发类型互认具有一致性.
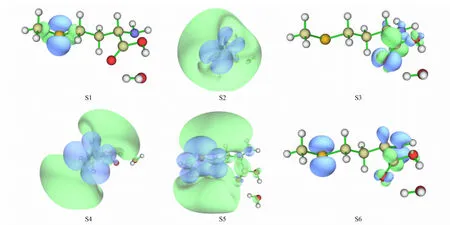
图4 INT1-S-Met-CHCl3+H2O分子体系激发态S1~S6的CDD等值面Fig.4 CDD isosurfaces of excited states S1—S6 of INT1-S-Met-CHCl3+H2O molecular system
综上, 本文对隐式溶剂氯仿下Met+H2O复合体系手性转变第一基元反应中间体电子激发态特性进行了理论计算研究, 并分析了中间体基态与激发态的性质及其电子结构. 结果表明, 通过单水分子协助和H原子迁移形成中间体, 导致Met分子体系结构发生显著变化, 为隐式溶剂氯仿下Met分子手性转变机制研究提供了参考依据.

