肺栓塞患者中差异表达的长链非编码RNA的筛选及分析研究①
曹嘉芮,曹国磊,李 伟,何丽丽,牛海文,李晓晗,吐尔逊江·艾力,罗 琴
(新疆医科大学附属肿瘤医院呼吸神经内科,乌鲁木齐 830011)
肺栓塞(pulmonary embolism,PE)是以各种栓子阻塞肺动脉或其分支为发病原因的一组疾病或临床综合征的总称,最常见的是下肢静脉血栓[1-2]。据全球范围内统计,PE的年发病率为0.1%,随着人口年龄的增长而增加,从40~49岁的0.14%上升到80岁以上的1.13%,在30%的患者中可发生复发性静脉血栓栓塞,发病率(包括事件和复发静脉血栓栓塞)可达3%[3]。高通量测序技术是通过剪切、读取DNA片段,经过延伸、扩增、拼接等技术,获取完整的生物信息序列,从而解锁更多生物物种的基因组遗传密码[4]。许多lncRNA基因在正常和疾病状态下通过表观遗传、细胞分化调控等使得部分基因呈现沉默或激活来表现出特异性细胞类型表达模式,甚至比蛋白质编码基因更具特异性[5]。有研究表明被选定的lncRNA可通过在序列、空间结构、表达水平的异常等,在功能的获得和丧失方面可以影响细胞过程、发育和疾病[6]。已经发现lncRNA在基因调控中发挥重要作用[7]。本研究采用Illumina高通量测序筛选并比较PE与健康对照者外周静脉血中IncRNA的差异表达,现报道如下。
1 材料与方法
1.1 一般资料以2019年1月—2019年12月新疆医科大学附属肿瘤医院呼吸神经内科收治的既往无心脑血管、内分泌及恶性肿瘤病史的4例PE患者为实验组,另选取同期入院4例健康体检者为对照组,两组一般资料差异无统计学意义(P<0.05)。本研究通过新疆医科大学附属肿瘤医院伦理委员会审批(批准号:2019BC007),受试者均知情同意且签署知情同意书。
1.2 纳入与排除标准实验组纳入标准根据《中华医学会呼吸病学分会肺血栓栓塞症的诊治与预防指南》[8]符合以下任意一项即可确诊:(1)CTPA提示肺动脉内的低密度充盈缺损,部分或完全包围在不透光的血流之间轨道征,或者呈完全充盈缺损,远端血管不显影;(2)V/Q扫描高度可能性:2个或2个以上肺段灌注缺损,通气正常,通气-灌注不匹配;(3)选择性肺动脉造影提示肺血管内造影剂充盈缺损,伴或不伴轨道征的血流阻断。对照组纳入标准:既往无恶性肿瘤、心脑血管、血液、内分泌、肝肾疾病,且无慢性阻塞性肺疾病、哮喘等相关病史且与PE组性别、年龄相当的相同地区健康者。排除标准:患有除PE以外其他系统疾病(或合并PE)患者。
1.3 方法
1.3.1 RNA的提取及基因组测序抽取两组外周静脉血5 mL,使用TRIzol试剂从外周静脉血中提取基因组RNA。质检合格后,使用QUBITRNABR试剂盒、Ribo-ZeroTMMagnetic试剂盒,RNA6000芯片对总RNA进行rRNA的剔除及质控,将构建好的测序文库上机进行RNA测序。
1.3.2 RNA测序结果的处理和分析采用bcl2fastq软件、FastQC软件和Fastp软件对两组的原始序列数据结果进行筛选。使用HISAT2/tophat2软件和RSe-QC软件对基因组位置进行分类和均一性分析。StringTie软件及R包对结果进行基因和转录本重构并对转录本长度统计分析。差异RNA的筛选条件为|log2FC|≥1且P<0.05(FC为差异表达倍数,即实验组与对照组差异表达倍数在2倍以上且P<0.05),来确定差异表达基因。在分组样本中,选择组间共同差异表达的上调和下调的lncRNA,以显著性P值和差异表达倍数作为判断标准进行差异性分析。并对差异分组的P值、上下调情况和差异倍数等进行资料汇总。对差异表达lncRNA运用R语言进行聚类分析,分别绘制热图和火山图。
1.3.3 差异表达lncRNA的GO及KEGG信号通路富集分析提取实验组和对照组差异性表达基因,通过综 合 多 个 数 据 库(ENSEMBL、NCBI、Uniprot、GO、KEGG)及KOBAS软件对差异表达基因进行基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)信号通路富集分析,以校正后P<0.05寻找差异基因的主要富集功能和通路。
1.4 统计学处理采用limma和DESeq软件以筛选条件为|log2FC|≥1且P≤0.05,对lncRNA进行差异性分析。当比较组中含有多个样本,则实验组和对照组至少其中一组中有表达的样本数占该组(实验组或对照组)样本的2/3或实验组与对照组中至少一组中有2/3以上的样本有表达,要求该组的平均表达量≥1。根据每个样品中基因/转录本的表达量计算Pearson相关系数,样品间的Pearson相关系数r的范围是|r|≤1。
2 结果
2.1 PE组与对照组差异性lncRNA的筛选对照组与实验组可见430个lncRNA的表达具有差异,见图1、2。

图1 实验组对比对照组差异lncRNA火山图
2.2 实验组与对照组差异性lncRNA的分析单纯实验组与对照组比较,差异表达倍数较大的前10位上调和下调IncRNA分别为:MERGE.25018.15,ERGE.30895.15,MERGE.32169.24,MERGE.30939.2,MERGE.22370.6,MERGE.32217.13,ERGE.9106.11,MERGE.7438.3,MERGE.30701.47,MERGE.6007.5;MERGE.27071.1,MERGE.14825.18,ERGE.30701.1,MERGE.20578.5,MERGE.32241.2,MERGE.15426.3,MERGE.10320.15,MERGE.2905.16,ERGE.22859.26,MERGE.28441.11;其中差异倍数最大的上调和下调IncRNA分别为MERGE.25018.15;MERGE.27071.1,见表2。

表2 差异表达显著的lncRNA

图2 实验组与对照组差异lncRNA聚类分析图
2.3 PE相关的差异表达lncRNA靶基因的GO富集分析在生物学途径方面的结果在差异基因及全部基因背景下通过GO数据库功能基因分布情况,表达的基因在生物学途径方面进行注释,主要涉及到参与染色质修饰、呼吸系统的发育、大分子复亚基组织、轴突生成调控、含核酸酶的小分子代谢过程、神经管发育、血管内皮细胞迁移的正调节作用、蛋白激酶D信号的正调控、STAT4蛋白酪氨酸磷酸化的负调控、嗜碱性细胞趋化性、JAK1激酶活性的激活、蛋白激酶D信号调节等,见表3。

表3 GO生物学途径富集分析结果(差异表达显著排名前10)
2.4 PE相关的差异表达lncRNA靶基因的GO富集分析在细胞学组件方面的结果主要分布在细胞器、细胞外小体、胞外囊泡、膜结合泡、细胞器包络、囊泡、线粒体膜、ATF 1-ATF 4转录因子复合物、DBIRD复合体、内质网、高尔基体膜的外成分、线粒体质子转运ATP合成酶复合物,催化核心F(1)、环片状、CuI 7-环泛素连接酶复合物,见表4。

表4 GO细胞学组件富集分析结果(差异表达显著排名前10)
2.5 PE相关的差异表达lncRNA靶基因的GO富集分析在分子功能方面的结果主要表现在磷脂酰乙醇胺结合、腺苷转移酶活性、磷脂酰-N-二甲基乙醇胺N-甲基转移酶活性、磷脂酰乙醇胺N-甲基转移酶活性、磷脂酰-N-甲基乙醇胺N-甲基转移酶活性、葡萄糖磷酸化酶活性、前胶原葡萄糖基转移酶活性、蛋白丝氨酸/苏氨酸激酶活性、转移酶活性转移含磷基团、血管内皮生长因子受体1结合、组蛋白激酶活性、白细胞介素-4受体结合、磷酸腺苷酸酶活性、绑定、阴离子结合、核苷酸转移酶活性、蛋白质脱乙酰酶活性、组蛋白脱乙酰酶活性、2’-5’-寡腺苷酸合成酶活性、Rho gdp-解离抑制剂活性、JUN激酶活性、烟酰胺核苷酸腺苷转移酶活性、前胶原-赖氨酸5-双加氧酶活性、前胶原半乳糖基转移酶活性、ATP结合、腺苷基核苷酸结合、细胞外基质结合、肽酰赖氨酸5-双加氧酶活性、烟酸核苷酸腺苷酸转移酶活性、钙依赖性蛋白激酶C活性,见表5。
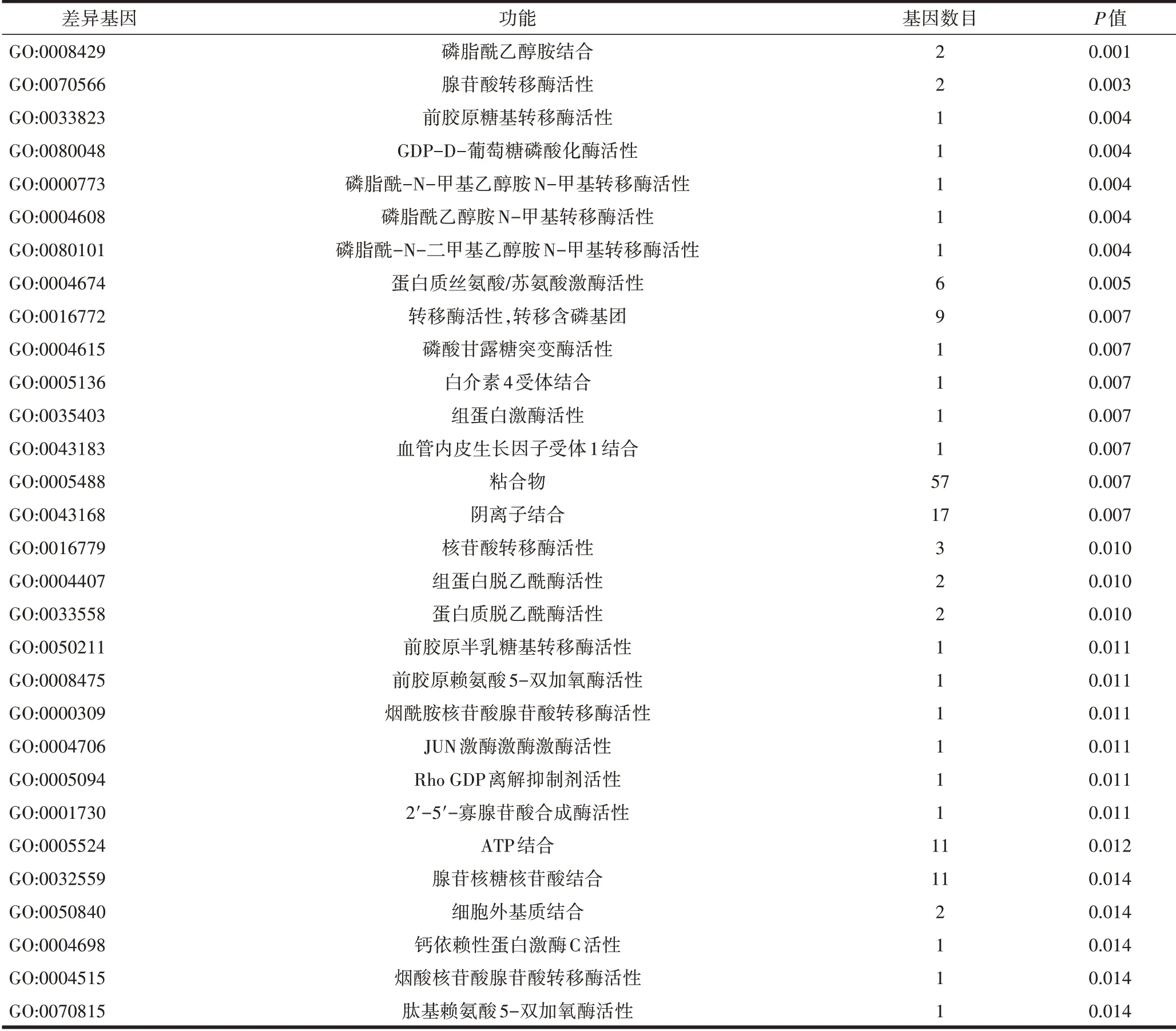
表5 GO分子功能富集分析结果(差异表达显著排名前30)
2.6 KEGG信号通路富集分析结果主要涉及VEGF信号通路、癌症中的胆碱代谢、HIF-1信号通路、MAPK信号通路、Wnt信号通路、mTOR信号通路、非小细胞肺癌等方面,见表6。

表6 KEGG信号通路富集分析结果(差异表达显著排名前30)
3 讨论
在全球范围内,对PE死亡原因的认识仍然很低[9]。关于PE患者的lncRNA表达谱以及lncRNA表达与PE患者的临床特征和预后的关系,目前均未见报道。数以千计的基因组序列的描述,以及技术使大规模识别基因表达谱成为可能的发展,提高了对许多疾病的发病机制的理解。为了更好地了解目前的情况,本研究对IncRNA在PE患者的表达谱进行初步分析,为IncRNA表达谱提供了新的思路和理论依据。这些进展也可促进新的治疗靶点的开发,以及诊断和预后标志物的开发[10]。因此,共同努力确定PE的遗传学特征有助于理解该病的发病机制,确定新的个性化治疗方法[11]。研究表明,lncRNA的表达水平在许多人类疾病中都是异常调节的[12],包括慢性血栓栓塞性肺动脉高压患者的肺动脉组织中存在lncRNAs CTEPHA1的异常表达[13]。因此研究PE患者与正常人群中基因的差异表达与调控,对PE的发生发展有重要的意义。
通过分析GO、KEGG等数据库中生物学数据来鉴定差异表达的lncRNA。为了确定影响PE生物学特征的独立预后因素,本研究关注差异基因相关的功能和信号通路,通过对差异表达的mRNA及其共表达的lncRNA伴侣进行GO功能富集分析,发现这些基因与呼吸系统的发育、血管内皮细胞迁移的正调控等有关,而PE的发生通过诱导高凝状态、淤血、血管壁损伤及功能障碍等因素有关。GO分析表明,差异基因与许多“生物学过程”,“分子功能”和“细胞成分”相关,而KEGG分析表明,信号传导途径为“VEGF信号通路”,“HIF-1信号通路”,“MAPK信号通路”,“Wnt信号通路”和“mTOR信号通路”等相关。血管内皮生长因子(VEGF)通过促进内皮细胞的生长和迁移发挥重要作用[14]。Huoqi Liang等学者研究表明抑制VEGF信号通路可抑制内皮祖细胞增殖和迁移在静脉血栓形成[15]。缺氧诱导因子1(HIF-1)在缺氧应答中起重要作用[16],Neha Gupta等学者研究发现炎性小体复合体(NLRP3)的表达是由HIF-1α介导的,在缺氧条件下,由HIF-1α诱导NLRP3协调的静脉环境中的早期促炎状态是急性血栓事件的关键决定因素[17]。Gan等研究证实氧化应激可激活MAPK/NFκB,促进组织因子表达和血小板分泌来调节静脉血栓形成[18]。众所周知,肿瘤可导致血液高凝状态,从而引起血栓的发生,Wnt信号通路参与肿瘤形成相关,有研究表明血小板、免疫系统和癌症之间存在多方关系,都可分泌相互激活的分子,形成一个良好的EMT环境来促进肿瘤或血栓的发生[19]。雷帕霉素靶点蛋白(mTOR)与自噬相关,是导致肿瘤变化的重要蛋白[20],其抑制剂会增加肺、心脏和肝脏移植后发生静脉血栓栓塞的风险[21]。因此,本研究推测这些与血管内皮的生成、低氧状态、恶性肿瘤等相关的信号通路可能参与了PE的发生。
综上所述,lncRNA-MERGE.25018.15、IncRNA-MERGE.27071.1可能参与肺栓塞的发生,这些非调控的lncRNA可能作为参与疾病发展和进展的基因的激活或抑制因子发挥作用。GO功能富集分析表明这些基因与呼吸系统的发育、血管内皮细胞迁移的正调控等有关。而KEGG结果分析,本研究推测这些与血管内皮的生成、低氧状态、恶性肿瘤等相关的信号通路可能参与了PE的发生。课题组拟进一步扩大样本量,并针对差异明显lncRNA进行深入研究。

