昼夜节律和代谢健康
康 杰(美),刘 畅(译校)
1 人类昼夜节律系统概述
昼夜节律一词来源于拉丁文,即“circa”(近似)和“dies”(天),表示大约“一天”。昼夜节律是指在大约24 h 的生物周期中,几乎所有的生物,从单细胞细菌到动植物都表现出的行为、生理和生化方面的节律,以帮助生物体为日常环境变化做好准备。这些节律是由一个昼夜节律计时系统产生的,该系统由一个位于下丘脑前部视交叉上核(Suprachiasmatic Nuclei,SCN)中的“中央时钟”和多个位于大脑和全身各处的“外周时钟”组成。生物钟从广义上是指由转录调节因子和酶组成的转录-翻译反馈循环构成的细胞自主计时系统。有研究发现,SCN 具有光响应性,该区域的损伤会消除运动和食物摄入的节律性行为。SCN 位于下丘脑前部,由近20 000 个神经元组成,这些神经元可以通过视网膜-下丘脑束接收来自环境光的信息,协调整个身体的外周时钟。
在过去二十余年里,维持人体昼夜节律功能的分子机制已被广泛研究。SCN 神经元以及其他振荡细胞昼夜节律性分子机制核心是主要生物钟基因的转录-翻译反馈循环,涉及主要的节律基因,如BMAL1、CLOCK、Per、Cry,它们会自己进行负调节表达。如图1 所示,转录激活因子BMAL1 和CLOCK 可激活Per 和Cry 基因的转录,从而在细胞质中产生PER 和CRY 蛋白。PER 和CRY 蛋白形成蛋白复合物,进入细胞核并通过与BMAL1 和CLOCK的相互作用抑制自己的转录。因此,Per 和Cry 在24 h 内有节律地表达。这种转录调控使每个外周细胞中大约10%的基因可以有节奏地表达。这个转录反馈循环是由高度复杂的机制来调节的,允许对时钟进行微调,同时具有可塑性,使其可以适应环境变化。

图1 以24 h 为周期的转录反馈循环Figure 1 The transcriptional feedback loop with 24 h cycle
人类的昼夜节律系统有一个既定的层次结构,以区分下丘脑SCN 内的中央时钟和包括肝脏、肺脏、肾脏、骨骼肌、脂肪组织和SCN 以外的大脑区域组织的外周时钟。从视网膜传输到SCN 的光信号诱导中央时钟或为全身外周时钟提供时间线索的主体时间起搏器。中央时钟的时间信息通过神经和内分泌途径(如交感神经系统和糖皮质激素信号传导)传输到外周时钟。外周时钟也会以一种与SCN 无关的方式,受到如进食、运动和压力这些非光因素的影响。例如,通过胰岛素信号通路,胰腺细胞中生物钟基因Per2 的转录和翻译被激活后,碳水化合物的摄入增加了胰岛素的分泌。同样地,运动通过交感神经系统和糖皮质激素信号调节周围组织(如肌肉、肝脏和肺)中的生物钟。根据环境的提示来设置或重置生物钟的能力是昼夜节律系统能够适应环境变化的一项重要功能。
2 能量摄入的昼夜节律调节
饥饿和食欲是由瘦素和胃饥饿素等神经肽调控的。这些神经肽的产生遵循昼夜节律,这可能解释了人类持续的、基本的一日三餐模式。这种饮食模式甚至在那些不受外界时间(如昼夜转换和白昼长度)影响的个体身上也能观察到。保持有规律的用餐时间有助于维持生物钟系统内部稳定的时间秩序。因此,由于现代社会24 h 工作或社会活动模式而放弃正常的饮食模式可能会破坏营养吸收与物质代谢,且对健康产生长期的影响。
有抑制食欲功能的瘦素主要由脂肪细胞产生。这种激素的产生被发现是在SCN 时钟的控制下,通过交感神经输入给脂肪细胞的。人体在白天饥饿感增强时血浆瘦素水平较低,但在晚上食欲下降时血浆瘦素水平较高,这有利于禁食和夜间休息。然而,在肥胖个体中,无论白天还是晚上,瘦素水平都要比较瘦的健康个体高得多,这表明他们处于瘦素抵抗的状态。非脂肪组织,如胃也产生瘦素。胃瘦素水平以类似的方式变化,白天低,晚上高。
胃饥饿素,是一种与瘦素相拮抗的激素,在胃以及包括胰腺和下丘脑在内的其他组织中产生。胃饥饿素通过下丘脑的作用来刺激食欲和增加食物摄入量。胃饥饿素会随进食量产生变化,在由进食诱导时间信号的过程中扮演着重要角色。此外,受试者的胃饥饿素水平在夜晚早期升高,然后在早晨醒来前下降。研究发现,睡眠不足会增加循环血中的胃饥饿素水平和饥饿感。胃饥饿素水平在肥胖人群中较低,但在厌食症患者中较高。如图2 所示,实际上血液中胃饥饿素(实线)与瘦素(虚线)水平的昼夜节律是同步的。因此,夜间胃饥饿素水平的增加可能会抵消瘦素增加所产生的抑制食欲的作用。
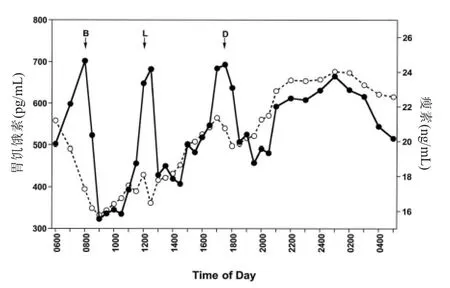
图2 血液中瘦素和胃饥饿素水平的日变化Figure 2 Diurnal fluctuations of blood leptin and ghrelin levels
3 能量消耗的昼夜调节
由于静息代谢率(Resting Metabolic Rate,RMR)占日总能量消耗的60%~75%,在测定能量消耗的日变化节律时,考虑时差非常重要(图3)。然而,具体研究RMR 的昼夜节律需要更复杂的实验方案。到目前为止,有2 种实验方案被认为是可以接受的:(1)常规方案(2)强制去同步方案。在常规方案中,影响昼夜节律的外部因素保持不变,如持续清醒、相同的半卧姿、有限的行为活动、昏暗的光线照射和食用热量相同的零食。因此,任何被测到的节律都被假定为内源性生物钟产生的纯昼夜节律的反映。使用该方案,Krauchi 等观察了男性参与者RMR 的内源性昼夜节律,最低点在凌晨(00:00—06:00),高峰在上午(09:00—12:00)。这些发现得到了Spengler等的支持,他们采用了类似的研究设计。

图3 构成每日总能量消耗的3 个组成部分Figure 3 The three energy components that contribute to the total daily energy expenditure
尽管常规方案是推断昼夜节律的最佳方法,但必须注意的是,RMR 测量的标准程序要求受试者在测量前至少禁食6 h。这在常规方案中是无法实现的。因此,上述研究中观察到的模式只能说明RMR和食物热效应(Thermal Effect of Feeding,TEF)结合的昼夜节律性。在这种情况下,强制去同步法可能是研究RMR 昼夜节律更好的方法。采用强制去同步法的研究改变了一天的长度,使其比典型的24 h 或短或长,从而导致行为节律(如睡眠/ 唤醒和进食/ 禁食)和内源性昼夜节律之间的去同步。通过这种方式,可以在所有昼夜节律阶段评估外源因素(例如睡眠和活动)对一些变量的影响。该方案不仅将内部节律与行为节律分离开来,同时也允许参与者保持某种程度上典型的行为周期(如睡眠/ 唤醒和进食/ 禁食)。使用该方案,Zitting 等报告了生物夜间(01∶00—05∶00)RMR 出现的一个波谷,这与采用常规方案研究的结果一致。Krauchi 等和Zitting等的研究表明,核心体温在大约05∶00 时出现最低点,进一步支持了生物夜间低水平的能量消耗。
一些研究试图通过测量24 h 内特定时间点的RMR 来检验其日变化。例如,对进餐时间影响TEF的研究发现07∶30—19∶30 之间,进餐前的RMR 没有差异。需要注意的是,简单地表述白天和夜晚不足以描述RMR 的昼夜节律。这是因为夜间时段前的禁食和睡眠与早晨时段不同。
有不少研究也试图检验TEF 的昼夜变化,尽管TEF 只占总能量消耗的10%(图3)。然而,TEF 是否会受到昼夜节律的影响,以及如何受到昼夜节律的影响尚不清楚,部分原因是TEF 在日总能量消耗中所占比例较小。Morris 等的研究发现,摄入相同的食物在20∶00 时比在08∶00 时的TEF 低44%,这得到了Bo 等的支持,他们采用了类似的研究设计,发现夜间和白天的TEF 有380 kJ(约90 kcal)的差异。虽然能量差异不大,但如果持续一段时间的夜间进食模式,就可能会导致体重增加。值得注意的是,这些研究使用的实验方案很难控制行为周期的影响。例如,在Morris 等的研究中,在早上的测试前禁食12 h,而在晚上的测试前禁食8.5 h。此外,参与者在早上测试前有一夜的睡眠,而晚上测试前则没有。
相 反,Weststrate 等观察到TEF 在上午(08∶00—09∶00)和下午(14∶00—15∶00)没有差异。这项研究分别在不同的日子,测量上午和下午的RMR和TEF,以排除行为周期的影响,并采用重复测量方法(3 个上午和3 个下午),以排除日变化的干扰。一项对11 名肥胖男孩的类似研究也显示,在07∶30 和12∶00 食用相同的一餐时,TEF 没有显著差异。在这2 项研究中,从早上到下午的测量时间相对较短(如间隔5 h)。很可能在2 次测量之间,检测TEF 的差异需要更长时间(如间隔10~12 h)。
体力活动所消耗的能量约占每日总能量消耗的15%~30%(图3)。由于参与体育活动的强度不同,这部分能量消耗变化幅度较大。大多数关于身体活动的昼夜节律研究都与肌肉功能和表现有关。以往的研究表明,许多与运动表现相关的生理过程会遵循一个特定的昼夜节律。一般来说,强度和能量的峰值出现在下午晚些时候,而早上的表现则相对较差。运动表现的日变化与核心体温的变化密切相关。鉴于体温和肌肉功能之间的密切关系,有研究发现,早晨的体温通常较低,在这时进行时间稍长的热身活动可以提高运动表现。然而,高温环境可以减轻肌肉功能,如肌肉力量、功率和收缩能力,所表现出的昼夜变化。有趣的是,当一项基于心率和次最大耐力的体能测试在高温条件下进行时,最佳表现出现在早上。
最近的证据对体温和运动表现之间关系的传统观点提出了挑战,并表明除了体温以外的其他因素也可能参与生理表现的昼夜节律控制。Martin 等检测了昼夜节律对神经适应与拇收肌收缩特性的影响,发现在最大自主收缩时所产生的力在晚上大于早上。由于神经刺激在2 个时间点上是相同的,研究者认为外周收缩功能的变化是产生波动的原因。这些研究进一步提出,机体会在下午产生较大力量的原因,可能是肌浆网释放钙的增加,肌动蛋白和肌球蛋白中的钙离子敏感性增强,以及肌球蛋白ATP 酶活性的改变。收缩功能的变化对肌肉力量的日变化有介导作用,这一观点得到了Guette 等的支持,他们发现肌动蛋白-肌球蛋白横桥循环与无机磷酸盐浓度的昼夜变化有关。
4 宏量营养素代谢的昼夜节律调节
近年来的研究在昼夜节律和新陈代谢关系方面取得了很大进展,发现糖脂代谢受损在许多代谢性疾病的发病机制中起着重要的作用。24 h 内,中枢神经和外周神经相互作用,调节食物摄入和关键器官的特定代谢途径(图4)。有研究以健康的、非糖尿病患者为研究对象,探索通过口服葡萄糖对血糖的反应来测量葡萄糖耐量的日变化,发现通常会在早上表现出最佳的葡萄糖耐量,而在下午和晚上时葡萄糖耐量会有所下降。通过评估餐后葡萄糖和胰岛素反应来确定胰岛素敏感性时,也观察到了这种日变化。Saad 等让 健康 受试 者在07∶00、13∶00 和19∶00时摄入相同的混合膳食的同时,进行相同的运动,发现07∶00 餐后的葡萄糖反应低于13∶00 和19∶00,而β 细胞的反应则更明显。通过食用含有同位素标记葡萄糖的食物,观察到2 餐之间血糖的变化是相似的。因此,他们将这种餐后葡萄糖反应的日变化模式归因于与早餐相比,午餐和晚餐后β 细胞反应和胰岛素敏感性更低。最近,Leung 等研究表明,与早餐相比,即使是在晚间摄入等量的低GI 膳食,也会导致餐后更高的血糖和胰岛素水平。

图4 中央时钟和外周时钟相互作用调节食物摄入和关键器官的特定代谢途径Figure 4 Central and peripheral clocks interact with each other to regulate food intake and specific metabolic pathways in key organs
糖尿病患者具有与胰岛素敏感性相反的昼夜节律。2 型糖尿病患者的血糖水平在夜间相对正常,但在凌晨和清晨期间会上升,导致清晨高血糖和高脂血症,这种情况被称为“黎明现象”。Boden 等采用24 h 控制血糖的方法测量2 型糖尿病患者的胰岛素敏感性,观察到一种倒置的昼夜节律:胰岛素敏感性在晚上最高(19∶00),然后在夜间逐渐下降,在早晨最低(08∶00)。昼夜节律的改变被认为是导致2 型糖尿病患者发生高血糖和高甘油三酯血症的主要因素。在动物模型中发现,胰岛生物钟基因CLOCK和BMAL1 的破坏会导致糖尿病的发生。有研究对健康人群,使用提前9 h 的睡眠周期方式来扰乱睡眠-觉醒周期,并模拟夜班工作模式,结果显示血糖和血脂水平升高。在肥胖个体和2 型糖尿病患者中,日变化的减弱、相位延迟或缺失常有报道。这些都显示了昼夜节律紊乱对糖代谢的影响。
关于昼夜节律影响脂质代谢的研究较少,其中大部分证据来自对啮齿类动物餐后营养物质代谢反应的研究。Moran-Ramos 等在对夜间活动的老鼠进行观察后,发现餐后甘油三酯(Triacylglycerol,TG)在休息(光照期)阶段的反应大于活跃(黑暗期)阶段,并认为在休息阶段的高餐后TG 反应是由骨骼肌和棕色脂肪组织对脂肪酸摄取降低而引起的。该研究在SCN 受损的大鼠中没有观察到餐后的昼夜变化。此外,Wada 等对无BMAL1 基因的小鼠进行研究后发现生物钟基因BMAL1 参与了脂肪酸氧化的调节过程,可见脂质代谢是由内源性昼夜节律系统介导的。最近有研究发现鱼油对小鼠肝脂肪变性和高脂血症的预防作用受喂食时间的影响。Oishi 等通过每天2 餐的喂养模式,发现在活动期喂食鱼油的小鼠血液中的TG 含量低于休息期,但二十二碳六烯酸(Docosahexaenoic Acid,DHA)和二十碳五 烯酸(Eicosapentaenoic Acid,EPA)含量高于休息期。以上研究表明,早餐时食用鱼油的降血脂作用可能比晚餐时效果更佳,原因可能是早餐时肠道对DHA 和EPA 的吸收更有效。
在以人为对象的研究也显示了脂代谢的昼夜变化,有研究表明,餐后TG 的变化与进食时间有关。Sopowski 等以健康男性和女性为对象进行研究发现,在日间(13∶30)和夜间(01∶30)摄入相同的高脂肪食物时血液中的TG 水平,与日间相比,夜间TG 在餐后升高幅度更大,维持时间更长。Burdge 等发现,男性午餐后TG 水平的提升幅度是早餐后的一半。该研究在实验餐中加入稳定同位素标记的软脂酸,以区分餐后TG 反应是受进食的影响还是受内源性代谢过程的影响,未观察到早餐和午餐餐后同位素标记软脂酸水平的差异,提示午餐后血液中低TG水平可能是由于内源性脂肪酸代谢的增加所致。由此可见,在日间,尤其是午餐后,身体代谢脂肪酸的能力更强。因此,应避免在晚上摄入油脂较高的食物,因TG 可促进脂肪合成和存储。
5 饮食摄入对昼夜节律的影响
昼夜节律对能量平衡和基础代谢的影响已在前文中进行论述。很明显,昼夜节律计时系统通过时间影响代谢过程。同时必须强调,昼夜节律也会受到饮食和运动等外部刺激的影响(图5)。最近研究表明,行为或环境因素可以作为非光信号对存在于肌肉、肝脏、胰腺和脂肪组织中的外周时钟产生调节,从而影响代谢过程,而用餐的时间和频率就是因素之一。研究发现,在休息期(光照期)喂食高脂肪食物的小鼠,在短短一周内就比在活动期(黑暗期)喂食的同伴增重更多。Fonken 等也发现,与明暗交错环境下的小鼠相比,被置于持续明亮光线下的小鼠在摄入相同食物时,体重增加更多。对啮齿动物的研究表明,休息期的食物摄入会导致体重增加和腹部脂肪积累,但将食物摄入转移到正常活动期即可阻止这些不良反应。小鼠是一种夜行性动物,在活动期通常要消耗其每日摄入量的70%~80%。如果对其食物供应限制在休息期,外周时钟可能与SCN 的中央时钟分离,这将导致代谢过程的不同步,进而增加发生代谢性疾病的风险。

图5 饮食、运动和生物钟之间的相互作用Figure 5 An interplay between diet,exercise,and circadian clocks
对人类来说,一天中主餐的进食时间被证明会影响肥胖的发生风险和减肥的效果。对于超重人群来说,与在15∶00 后吃主餐(低热量饮食)相比,在15∶00 前吃主餐减去的体重更多。另外,早餐时摄入高热量的受试者比晚餐时摄入同样高热量的受试者体重下降得更多,葡萄糖、胰岛素、胃饥饿素浓度和饥饿评分也更低。吃得较晚与体重增加,肥胖,以及食欲、压力和睡眠激素的昼夜节律改变有关。有研究对饮食时间进行了控制,结果表明,延迟进食会导致代谢紊乱,如体重的增加和胰岛素抵抗,而日间进食会改善这些情况。值得注意的是,最近的研究结果表明,生物钟的个体差异是制定最佳饮食时间的一个重要因素,但目前对这方面的研究很少。
最近的研究表明,特定的时间范围摄入富含碳水化合物或脂肪的食物可以保持健康的新陈代谢。Kessler 等使用交叉实验,分别在上午和下午摄入高碳水化合物食物,比较糖耐量受损的2 组4 周等热量饮食的代谢反应,发现晚间摄入高碳水化合物的食物对血糖控制有不利影响。这一发现与流行病学研究结果一致,流行病学研究表明,在一天开始时摄入富含碳水化合物的饮食可以预防糖尿病和代谢综合征的发生发展。应该避免将量大的、富含碳水化合物的食物安排在晚餐,尤其是那些患糖尿病风险较高的人群。
更好的葡萄糖耐量和β 细胞反应能力似乎与上午进食有关,且比在下午或晚上进食有更高的生热作用。这些特定时间的效应不仅证实了饮食、新陈代谢和生物节律之间潜在的相互作用,而且还说明人们通过配合昼夜节律可以更好地安排他们的饮食计划。研究表明,与晚上相比,上午吃同样的食物后血糖浓度会更低,且胰岛素、c 肽和促胰岛素分泌增多。已经有研究发现,餐后激素和能量物质(如胰岛素、c 肽、葡萄糖和脂类)的增加可以激活不同的信号通路,改变基因表达,从而影响大脑和外周时钟的生物节律。不管确切的潜在机制是什么,在日间早些时候按比例摄入更多的能量是符合昼夜节律的,这可以被视为一种健康的饮食策略。
虽然通常认为大多数人每天都吃早餐、午餐、晚餐和一些零食,但事实却非如此。通过使用智能手机应用,Gill 等发现健康成年人每天频繁且不稳定的饮食模式,可能会有多达11 次的饮食活动,其中35%的摄入发生在18∶00 之后。超过一半的成年人每天进食时间为15 h 甚至更长,而且这一进食时间在周末往往还会被延长,这表明“社交时差”是存在的。在16 周的干预后,干预前每日进食14 h 的超重人群将进食时间缩短到10~12 h 后,体重持续下降,主观感觉更有活力,睡眠满意度也有所提高。这些数据表明,缩短进食时间可能对人类的代谢指标产生有益影响。这种影响的一种解释是禁食时间的延长(通常超过12 h),会导致肝糖原储存的消耗和从脂肪储存到脂肪利用的代谢转换。
“限时摄食”(Time-Restricted Feeding,TRF)是一个经常在时间生物学中使用的术语,指在日间或夜间将进食的时间限制在2~12 h 内。这个术语承认了进食时长可能导致体重增加和肥胖的潜在作用。TRF 可以降低能量的摄入,并成为一种有吸引力的、容易接受的、可改变的生活方式。有研究表明,如果进食时长小于6 h,TRF 组则不能与随意进食组吃相同量的食物;而如果进食时长超过8 h,TRF 组的食物消耗量几乎与随意摄食组相等。因此,限制进食时间不超过8 h 经常被用于TRF 实验。事实上,每天8 h 的“16∶8 饮食方法”是一种越来越受欢迎的用于减肥和整体健康的饮食方法。对小鼠和啮齿类动物的研究表明,将进食时长限制在“正确的”昼夜节律期,能对饮食引起的肥胖、葡萄糖耐受不良、瘦素抵抗、肝脂肪变性和组织炎症具有保护作用,而且禁食持续的时间越长,对代谢的好处就越大。此外,即使在拟定每周有2 天周末生活方式的情况下,TRF 会因随意进食而暂时中断,这种保护作用仍能维持。TRF 似乎也能有效减少基因变异而导致的昼夜节律减弱和代谢紊乱的Zucker 肥胖大鼠的体重增加。表明TRF 不仅可以预防而且可以治疗代谢性疾病。
已有几个研究报道了关于进食时间为6~8 h 的人的TRF 临床实验,但结果有些不一致。Sutton等的研究将糖尿病前期男性随机分为早期TRF组(下午15∶00 前6 h 进食)和对照组(12 h 进食),持续5 周,2 组在减重方面无显著差异。将食物限制在早上摄入可以改善胰岛素敏感性、β 细胞反应、血压、炎症反应、氧化应激和食欲。Moro 等的研究将接受过抗阻训练的健康男性分为8 周等热量TRF组(8 h 内进食三餐)和正常饮食组(16 h 内进食三餐)。虽然TRF 组显示体脂率、瘦素和TG 的降低和脂联素的增加,但在肌肉质量和血糖、血液胰岛素和胆固醇水平上,未见差异。虽然这些研究揭示了TRF在体成分和代谢方面的好处,但缺乏对热量摄入的控制可能导致这些研究在某些结果上的不一致。
有研究通过使用不同进餐频率的饮食干预(如控制每日进食次数)证实了TRF 的代谢益处。Carlson 等和Kelly 等的研究比较了每日进食3 次和每日进食1 次(17:00—21:00 之间),且摄入热量相同的食物的代谢效果。连续8 周每日进食1 次,受试者的体脂降低,但血压和胆固醇水平有所增加。每日进食1 次可能还会导致空腹血糖水平升高、糖耐量受损、胰岛素反应延迟和餐后胃饥饿素水平升高。Tinsley 等使用类似的实验设计,要求TRF 组受试者在16:00—24:00 间选择4 h 进食,每周4 d,持续8 周。尽管TRF 组的每日热量摄入降低了约650 kcal,但干预后身体成分无显著变化。这些研究均存在一个问题:TRF 是在下午晚些时候或晚上进行的,这可能不是一天中理想的新陈代谢时间,即使TRF 要求每日进食1 次,人们仍然应该考虑把这一餐放在一天的早些时候,以便通过TRF 获益。
6 运动对昼夜节律的影响
运动是生物钟的另一个非光信号。20 世纪80 年代末到90 年代初的研究表明,在一天的不同时间内,使用滚轮运动足以改变小鼠和仓鼠的昼夜节律。进一步研究表明,运动是足以影响SCN 生物钟基因表达的环境诱发因素。在休息期(光照期)以滚轮形式进行的体力活动降低了SCN 生物钟基因Per1和Per2 的峰值表达。Schroeder 等进一步证实了这一观点,并利用中央时钟机制减弱的突变小鼠检测了运动时间对中央时钟的影响。为了检验定期运动是否会影响昼夜节律,在活动期(黑暗期)开始或结束时,允许小鼠自由地使用滚轮、不使用滚轮或被限制在6 h 内使用滚轮。结果发现,在连续16 d 在活动期开始使用滚轮可改善这些昼夜节律缺陷小鼠的行为、生理等多个方面问题。运动时间也被证明会影响外周时钟,如骨骼肌和肺部内的时钟基因。这些证据表明,有计划的锻炼可以作为一种调节日常节律工具,从而抵消衰老和疾病对昼夜节律系统的一些负面影响。
运动引起的昼夜节律变化也在以人为研究对象的实验中被发现。这些研究大多集中在运动如何有助于适应已改变的睡眠-觉醒周期。事实上,昼夜节律不同步是轮班工作和睡眠中断的典型特征,与超重、肥胖和胰岛素抵抗有关。Barger 等的研究显示,运动可能促进需要延迟睡眠-觉醒周期的生理适应。此研究用血液中的褪黑素水平来评估昼夜节律的适应,并发现在昏暗的光线条件下(如夜间),功率自行车运动能够推迟约9 h 的褪黑激素分泌周期。通过运动更好地适应已改变的睡眠-觉醒周期,可以提高睡眠质量。Montaruli 等评估了一组马拉松运动员在不同时区飞行后身体活动对睡眠的影响,发现在前往美国纽约之前,在意大利米兰进行每周3次、为期1 个月的夜间跑步,参与者到达纽约市后的睡眠质量优于1 个月进行晨间运动的对照组运动员。尽管身体活动对睡眠-觉醒周期的影响机制仍有待进一步探索,但这些发现的实际意义是明确的,即有规律的运动可能有助于重新调整昼夜节律并改善轮班工作人员、跨时区航空旅行者,以及具有昼夜节律障碍的个体的睡眠质量。
最近有研究还评估了运动时间对训练引起的肌肉适应的急性影响。但是,结果并不一致。Küüsmaa等采用横断面设计,对42 位年轻的健康男性进行配对并分配到早晚训练小组中。尽管睾酮和皮质醇分泌的昼夜节律并未因运动时间而改变,但在夜间进行了24 周的耐力和抗阻训练后,肌肉质量比在晨间运动有所增加。Sedliak 等采用类似的设计,将25 名年轻未经训练的男性随机分为早晨运动组、下午运动组和久坐对照组。在耐力训练11 周后,尽管下午运动组的肌肉力量始终较高,但在肌肉力量、肌肉横截面积和激素反应方面没有发现组间统计学差异。值得注意的是,与Sedliak 等相比,Küüsmaa等使用更大的样本量和更长的训练时间,可提升研究者检测昼夜效应的有效性。如Küüsmaa 等所述,在夜间训练组的肌肉增加量更大,且在24 周训练计划中的第12 周后才开始显现。
运动如何在昼夜节律中发挥作用有各种解释。中央生物钟基因CLOCK 和BMAL1 被认为可能在介导运动的这一独特效应中发挥了关键作用。生物钟基因突变小鼠的峰值肌力会出现约30%的降低,这些小鼠也表现出肌纤维结构的改变和线粒体数量的减少。Pastore 等最近的研究支持了这一结果,并证明了CLOCK 和BMAL1 基因对维持骨骼肌线粒体至关重要。研究者检查了生物钟基因突变小鼠适应长期运动的能力,发现这些小鼠通过耐力训练,能够使由于CLOCK 和BMAL1 基因部分缺失而减少的线粒体生物合成恢复正常。Zambon 等也观察到连续60 次伸膝动作与人体肌肉中分子生物钟基因表达变化之间的关联。通过分析股四头肌活检样本DNA 微阵列,研究者发现,肌肉的收缩运动可能通过生物钟基因Cry1、Per2 和BMAL1 的上调来调节昼夜节律。
最新的研究也表明,对运动有反应的分子,如AMP 活化蛋白激酶(AMPK)、低氧诱导因子1α(HIF-1α)和过氧化物酶体增殖活化受体1α-活化因子(PGC-1α),会影响生物钟基因的表达。例如,AMPK活性会因运动而增加,这改变了PER 和CRY 蛋白的稳定性,从而影响了生物钟基因的表达。运动也会诱导介导有氧和无氧代谢的关键分子HIF-1α的表达。已有研究表明,HIF-1α 通过增加生物钟基因的表达来产生代谢效应。骨骼肌分子生物钟也与哺乳动物雷帕霉素靶标(mTOR)和下游信号的传导有关,这可能解释了Küüsmaa 等研究所显示的肌肉适应性。在以大鼠为受试的研究中,骨骼肌蛋白合成率、mTOR,以及p70S6 激酶活性在这些夜间动物的休息期(光照期)达到峰值。假设人类的情况正好相反,这意味着蛋白质合成率可能在晚上达到峰值。
Küüsmaa 等的研究发现,与早上锻炼相比,为期24 周晚间进行的力量和耐力训练可带来更高的肌肉增长,考虑到骨骼肌细胞是葡萄糖储存的仓库,可以推断晚间运动可更好地控制血糖。探索运动时间如何影响2 型糖尿病患者或非2 型糖尿病患者的血糖,是研究者日渐关注的另一个领域。如前所述,2 型糖尿病患者的夜间胰岛素敏感性会降低,导致清晨空腹高血糖现象(黎明现象)。因此,胰岛素敏感性开始恶化的晚间进行运动,可能最有利于改善晚餐后的餐后血糖,也可以增强夜间的胰岛素敏感性,降低第二天早上的空腹血糖水平。有几项关于2 型糖尿病的研究支持这一观点。有研究发现午餐后运动对接下来24 h 内的血糖水平影响甚小,而晚上锻炼可以降低运动中和夜间的血糖水平。Reynolds 等人发现,与建议运动而不指定时间相比,餐后进行10 min 步行对降血糖更有效,尤其是在晚餐后步行。虽然这些研究没有直接比较一天中不同时间的运动对血糖的影响,但综合以上研究结果可发现,晚餐后可能是运动改善2 型糖尿病患者血糖和血脂的最佳时间。
晚间锻炼比一天中其他时间锻炼更可有效控制血糖的机制被归因于褪黑素信号的改变。已有研究表明2 型糖尿病风险的人体内胰腺褪黑激素受体的表达增加,而褪黑素可以抑制由于血糖升高导致的胰腺β 细胞的胰岛素分泌。Buxton 等的研究发现,在健康个体中,与早上、下午运动相比,晚上运动可以将褪黑素峰值出现的时间提前,而午夜后运动则会显著增加褪黑素的浓度。褪黑素峰值时间提前有助于随后的睡眠和相关的恢复。目前尚不清楚夜间运动如何影响2 型糖尿病患者的褪黑素水平,但有可能晚上而非夜间运动可通过减少胰腺中褪黑素受体的表达,从而减轻褪黑素对胰腺β 细胞的胰岛素分泌的抑制,这将使胰岛素分泌更好地匹配夜间血糖水平,最终防止“黎明现象”的出现。
7 小结
本文综述了昼夜节律及其与代谢的关系,特别讨论了生物钟如何介导代谢过程,以及饮食和运动等行为因素如何影响生物钟的研究。许多生理过程,包括能量平衡和物质代谢,都由昼夜节律控制,以确保它们在一天中最合适的时间发生。昼夜节律的紊乱和不同步会损害葡萄糖和脂肪酸的代谢,从而导致肥胖、胰岛素抵抗和2 型糖尿病的发生。饮食和运动是预防或治疗代谢紊乱的2 种常用方法,部分原因是它们对昼夜节律系统的独特影响。然而,它们的功效可能会受到在日间实施情况的影响。为了减轻体重,可以考虑将进食时间限制在8 h 内,同时尽量在一天的早些时候摄入更多的热量。对于有胰岛素抵抗或2 型糖尿病人群,在晚上增加运动可能对控制血糖更有效。很明显,昼夜节律和新陈代谢是紧密相连的,还需要通过更多的研究,进一步了解这些过程的相互作用,并制定有效的干预策略,从而抑制由昼夜节律紊乱导致的代谢疾病的发生。

