雌激素受体亚型及激活蛋白-1在子宫内膜息肉中的表达及意义
董璐 郝晓莹 王晨
子宫内膜息肉(endometrial polyp,EP)是子宫局部内膜过度生长所致,数量可单个或多个,直径从数毫米到数厘米,由子宫内膜腺体、间质及血管组成的宫腔、宫底部有蒂或无蒂的赘生物。子宫内膜息肉是导致异常子宫出血常见的子宫内膜病变之一,探讨子宫内膜息肉发生发展的作用机制从而控制其发生并预防其复发有重要的现实意义。本文通过对子宫内膜息肉中雌激素受体α (ertrogen receptor-α,ERα)、β(ertrogen receptor-β,ERβ)及激活蛋白-1(activator protein-1,AP-1)组成成分C-jun的表达进行检测,并与正常子宫内膜组织中的表达进行对比,分析子宫内膜息肉与ERα、ERβ及C-jun的相关性,为进一步探讨该病的病因机制提供理论依据。
对象与方法
1. 研究对象:选取2018年6月—2018年11月本院收治的子宫内膜息肉患者,所有患者均经宫腔镜检查,按照病理标准诊断[1]为子宫内膜息肉20例作为实验组;同期选择因异常子宫出血行分段诊刮患者,病理诊断为增殖期子宫内膜[1]20例作为对照组。入组患者其他标准:(1)无高血压、糖尿病等内科合并症;(2)月经周期正常,无妇科生殖器官疾病如子宫肌瘤、子宫腺肌病、子宫内膜癌、多囊卵巢综合征等;(3)术前3个月内均无激素用药史。实验组年龄29~48岁,平均(40.4±5.6)岁,对照组年龄27~50岁,平均(40.4±6.3)岁,两组年龄、孕产次比较差异无统计学意义(P>0.05)。在取标本时均告知患者,经患者同意并签署知情同意书,该实验获得本院医院伦理委员会审核。
2.方法:全部患者标本均于月经干净5~14 d行宫腔镜检查获取,检测并比较两组标本中ERα、ERβ及AP-1组成成分C-jun的含量。
3.标本测定:采用免疫印迹法进行标本测定,步骤如下:标本取出后,按每20 mg组织加入250 uL裂解液于匀浆器上充分裂解后取上清,进行蛋白质定量后储存于-80 ℃冰箱备用,用BCA法进行蛋白定量,采用12%分离胶和5%浓缩胶,样品在浓缩胶中电泳电压80 V,待样品进入分离胶后增加电泳电压至120 V,当染料到达胶底部时终止电泳,90 V转膜10 min,5%脱脂奶粉封闭液封闭,4℃过夜。加入1∶1000比例稀释的一抗,4 ℃过夜,按照1∶10 000稀释HRP标记的二抗,室温孵育1h,ECL化学发光显色仪检测,TANON GIS软件读取相关条带灰度值。实验中所需的兔抗人多克隆抗体ERα、ERβ、C-jun,RIPA(强)组织细胞快速裂解液,PBS 磷酸盐缓冲液,BCA 蛋白浓度测定试剂盒(增强型)均购自武汉Bioswamp生物公司,Tween-20购自Amresco生物公司,PVDF 转移膜、化学发光试剂购millipore公司,TEMED,过硫酸铵购自Sigma公司。
4.统计学分析:采用 SPSS 20.0 统计软件进行数据分析,组间比较采用t检验,相关性分析采用pearson相关,以P<0.05为差异有统计学意义。
结果
1.ERα、C-jun和ERα/ERβ 在两组的表达:ERα、C-jun和ERα/ERβ 在子宫内膜息肉组中相对表达量(分别为0.58±0.06、0.81±0.05、1.36±0.26)高于增殖期子宫内膜组(分别为0.38±0.01、0.50±0.05、0.59±0.02),差异均有统计学意义(P<0.05); ERβ在子宫内膜息肉组的相对表达量(0.42±0.05)低于增殖期子宫内膜组(0.64±0.01),差异有统计学意义(P<0.05),见图1和图2。

图1 两组组织中ERα、ERβ、C-jun蛋白表达
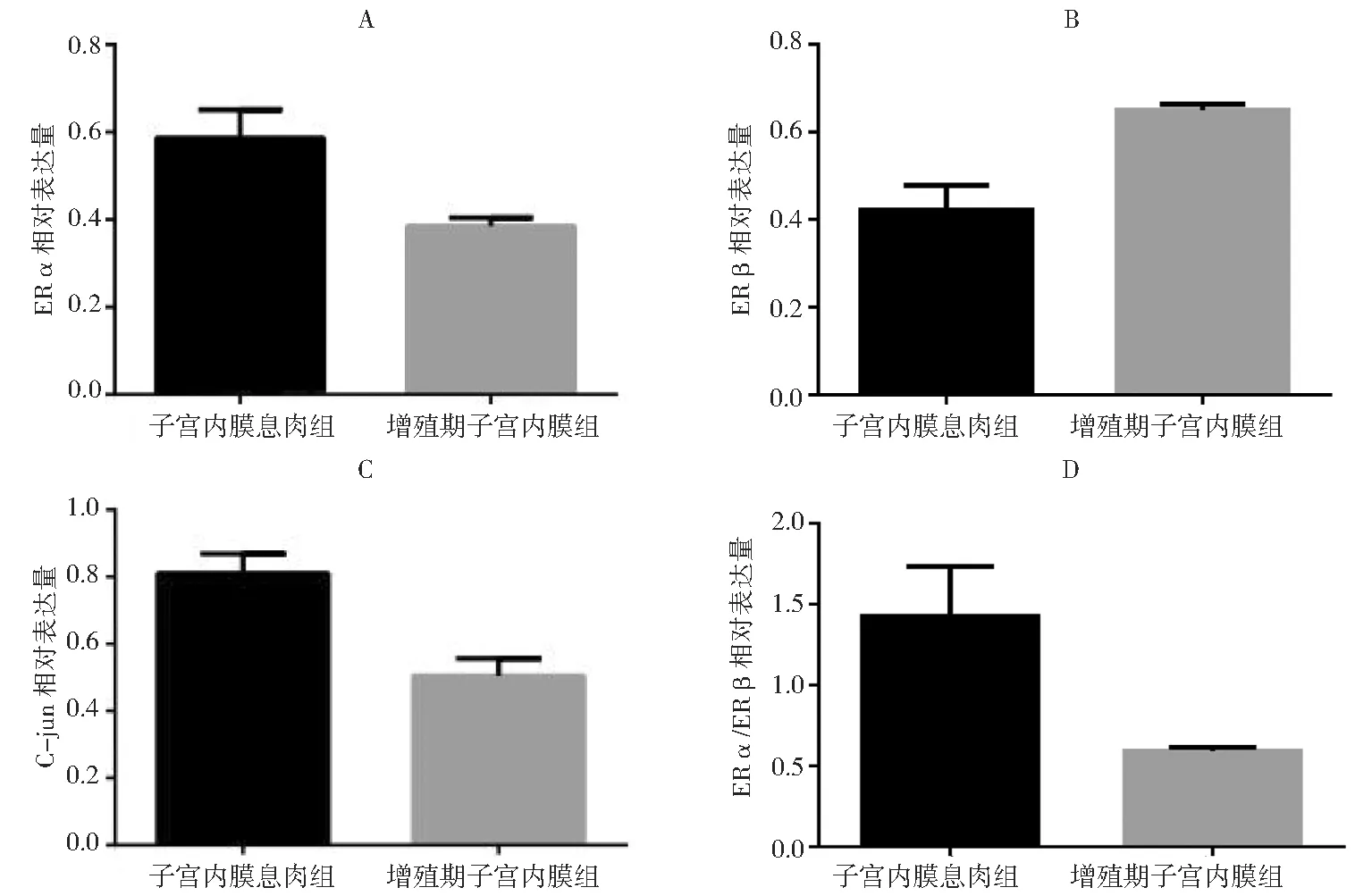
图2 A两组ERα相对表达量比较; B两组ERβ相对表达量比较;C两组C-jun相对表达量比较;D两组ERα/ERβ相对表达量比值比较
2.C-jun与ERα/ERβ相关性分析:子宫内膜息肉组C-jun与ERα/ERβ呈正相关(r=0.524,P=0.018),增殖期子宫内膜组C-jun与ERα/ERβ相关性无统计学意义(r=0.114,P=0.633),见图3。

图3 A 子宫内膜息肉组中C-jun与ERα/ERβ相对表达量相关性分析;B增殖期子宫内膜组中C-jun与ERα/ERβ相对表达量相关性分析
讨论
子宫内膜息肉是妇科常见疾病之一,根据不同研究群体的研究报道子宫内膜息肉患病率为7.8%~34.9%[2]。子宫内膜息肉可以导致患者出现月经量大、经期延长、经间期出血,也有部分患者仅表现为白带增多、不孕等症状[3]。随着宫腔镜技术的应用和水平的提高,EP的检出率和治疗率显著提高,但其病因和发病机制尚未完全明确。目前大多数研究认为主要与局部雌激素的过度刺激有关,但雌激素水平在人体内应该是相对平衡的,因此单纯的用局部雌激素的过度刺激很难解释其发生机制,而局部雌激素受体的高表达似乎更合理[4]。虽然EP大多数被认为是良性病变,但其恶变的问题不容忽视[5],主要与年龄、息肉的大小、抗凋亡基因B细胞淋巴瘤/白血病-2(B-cell lymphocytic leukemias Bcl-2)表达,服用他莫西芬、肥胖、激素替代治疗等有关[6]。
为了更深入阐明子宫内膜息肉的发病机制,本研究通过免疫印迹法分析了子宫内膜息肉与增殖期子宫内膜中ERα、ERβ及AP-1组成成分C-jun的表达。雌激素受体α(ERα)和β(ERβ)两种亚型介导着雌激素的生理作用。有研究显示在细胞的生长和增殖中ERα和ERβ发挥着相反的作用,ERα作用为促进细胞的增殖和抑制其凋亡,而ERβ表现出了抑制细胞增殖并促进细胞凋亡的作用[7]。有学者研究发现,ERβ在子宫内膜息肉中含量与其雌二醇浓度和外周血中雌二醇浓度呈正相关,认为高浓度的雌二醇可能是通过ERβ途径发挥其生理效应,从而导致EP的产生[8]。而沈恒石研究则发现ERβ的表达在子宫内膜息肉与正常子宫内膜中的差异无统计学意义,子宫内膜息肉中ERα的表达升高,可能是其产生的主要原因[9],本研究结果显示实验组中ERα的表达升高,与沈恒石等的研究结果相一致。
雌激素可以通过快速激活细胞膜表面丝裂原活化蛋白激酶(Mitogen-activated protein kinases MAPK)等信号通路对其他转录因子如AP-1进行调控和激活。AP-1是由碱性亮氨酸拉链形成高度的保守的同源或异源二聚体,可激活下游靶基因的转录,在众多的AP-1二聚体中FOS亚型与JUN亚型形成的异源二聚体稳定性最强[10-11],参与到细胞的增殖、炎症、凋亡、分化、生存、迁移和转化等过程[12]。并且在对AP-1的激活作用中,ER的亚型、配体的结构以及细胞的类型都对其产生不同的影响。目前国内外对于AP-1在EP中研究报告甚少,AP-1作为一种重要的核转录因子参与了细胞的增殖、恶性肿瘤的转移、新生血管的形成等过程。在EP的发生中,新生血管的作用不可忽视,而血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前发现的重要的促血管生成因子之一,雌激素受体可以促进其表达,而AP-1也可以通过调节内皮细胞的增殖和迁移介导VEGF诱导的血管生成[13]。另有在纤维肉瘤细胞培养模型中的研究[14]也发现,当上调C-jun和JunB时,可以激活增殖蛋白,从而增加血管的生成。本研究结果显示在EP中ERα、C-jun的表达升高,且C-jun与ERα/ERβ比值呈正相关,提示雌激素可能通过上调ERα和AP-1参与EP中细胞增殖、血管生成等过程,与Zhao[15]等人的研究结果相一致。
综上所述,在子宫内膜息肉中ERα和ERβ表达有明显的差异,ERα可能对其发挥着更重要的作用。同时,在EP中,C-jun的表达升高,提示AP-1的激活参与了EP的发生。但本试验中选取的病例数量较少,有待增加临床病例进一步验证子宫内膜息肉的发病机制,并为治疗、预防复发和控制癌变提供新的方向和依据。

