TACE联合不同剂量阿帕替尼治疗中晚期肝癌的临床疗效及不良反应
孙志强 姜成毅 李佰萍 韩庆贺 陈健
(1吉林省肿瘤医院介入科,吉林 长春 130012;2吉林大学第二医院放射科)
原发性肝细胞癌(HCC)是世界上常见的恶性肿瘤之一,近年来发病率和死亡率有明显上升趋势。全球HCC发病率和死亡率在恶性肿瘤中分别排第5位和第3位,中国占全世界病例的55%〔1〕。大部分患者就诊时已进展到中晚期,仅有不到30%的患者可行手术切除治疗〔2〕。而肝癌细胞通常具有耐药性,传统的化疗药物对HCC均不敏感。肝动脉灌注化疗栓塞(TACE)已成为治疗HCC的主要治疗手段〔3,4〕,TACE通过导管选择性插至肿瘤的供血靶动脉中,注射栓塞剂混合化疗药物将血管栓塞,阻断肿瘤细胞的血供,辅助化疗药物杀死肿瘤细胞,达到治疗HCC的作用〔5,6〕。TACE治疗取得较好的疗效,但临床也有一定的缺点。首先,在进行TACE后,肿瘤区域由于缺血缺氧,致使机体的血管内皮生长因子(VEGF)增多,当VEGF与VEGF受体(VEGFR)相结合后,可诱导血管内皮细胞再生,促进肿瘤血管再生和侧支循环建立,使肿瘤难以达到病理上的完全坏死〔7,8〕;其次反复进行TACE会导致肿瘤细胞产生对化疗药物的耐药性,并严重损伤肝功能〔9〕。
酪氨酸激酶抑制剂作为临床中晚期HCC的一线药应用到临床上,取得较好的疗效〔10,11〕。阿帕替尼作为一种酪氨酸激酶抑制剂(TKI)可抑制VEGF与VEGFR结合,从而阻断血管内皮细胞的迁移及增殖,降低肿瘤内血管密度,抑制肿瘤生长〔12〕。同时,阿帕替尼还可增加肿瘤细胞对化疗药物的敏感性〔13〕。应用阿帕替尼可在一定程度上弥补TACE治疗的不足。目前,国内外对阿帕替尼联合TACE治疗HCC的临床研究虽有报道,但缺乏大样本随机对照试验。阿帕替尼对HCC在临床上的应用也尚在摸索阶段。本研究探讨单一应用TACE及TACE联合阿帕替尼治疗HCC的临床疗效差异及不同剂量阿帕替尼的临床安全性。
1 资料与方法
1.1一般资料 回顾性收集 2018年1月至2020年10月于吉林省肿瘤医院介入科接受治疗的185例中晚期肝癌患者,根据治疗方法分TACE组(60例)和TACE+阿帕替尼组(125例,其中TACE+阿帕替尼组125 mg/d 35例、250 mg/d 69例与500 mg/d 21例3个亚组)。各组年龄、肿瘤数量具有统计学差异(P<0.05),而其他一般资料组间差异无统计学意义(P>0.05)。见表1。本研究获医院伦理委员会批准。纳入标准:①在吉林省肿瘤医院介入科诊断患有HCC并接受治疗的患者;②符合巴塞罗那分期(BCLC)B期或C期。
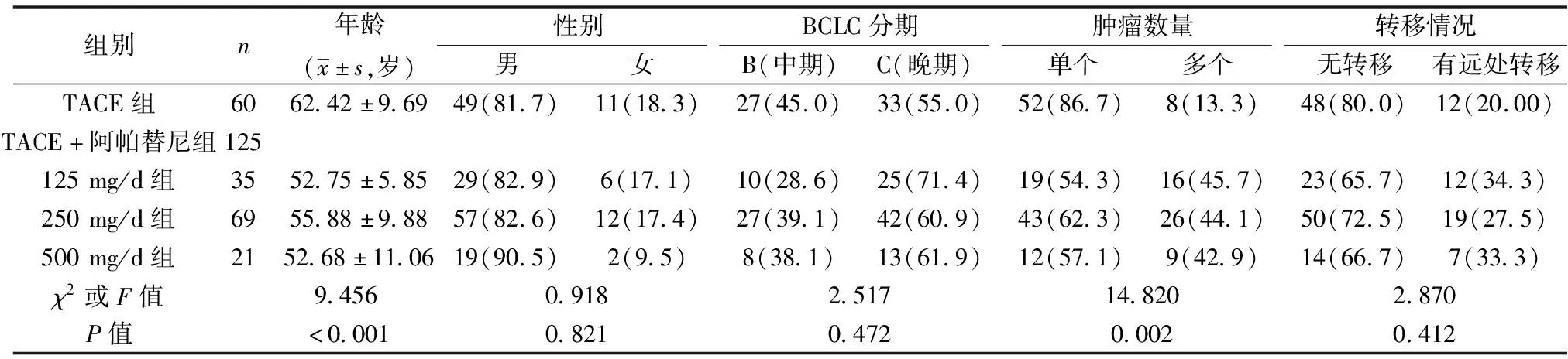
表1 各组一般资料统计表〔n(%)〕
1.2方法 TACE组选取Selding穿刺法,经股动脉穿刺后置入导管,采用数字减影血管造影(DSA)型造影机行肝动脉造影,应用化疗药物联合碘油并微球栓塞剂行 TACE 治疗。TACE+阿帕替尼组治疗方法同TACE组,术后口服阿帕替尼(规格:250 mg/片)1次/d,给药量分别为125 mg/d、250 mg/d和500 mg/d,连续给药至疾病进展或不可耐受。
1.3观察指标 (1)不良反应:血液系统、泌尿系统、皮肤神经、呼吸循环、消化系统等。(2)依据mRECIST疗效评价标准:完全缓解(CR);部分缓解(PR);客观缓解率ORR=(CR+PR)/总例数×100%;无进展生存期(PFS);生存时间(OS)。
1.4统计学分析 采用SPSS23.0软件进行χ2检验或Fisher精确检验、方差分析,使用Kaplan-Meier法对PFS、OS等进行生存分析,Log-rank检验比较不同组别患者的生存差异。
2 结 果
2.1生存分析 TACE组和TACE+阿帕替尼组的死亡人数分别为20例(33.3%)和61例(48.8%),两组间有统计学差异(χ2=0.959,P=0.003);在两组能够评估生存时间的患者中,TACE组〔中位OS(11.2个月)、ORR(52.0%)和中位PFS(13.2个月)〕显著低于TACE+阿帕替尼组(14.5个月、76.2%、18.9个月,χ2=5.898,P=0.042;χ2=7.218,P=0.021;χ2=6.174,P=0.03)。250 mg/d阿帕替尼组ORR(87.5%)、中位PFS(21.4个月)均显著高于125 mg/d(67.2%、15.2个月;χ2=7.137,P=0.024)和500 mg/d阿帕替尼组(70.4%、18.2个月;χ2=8.715,P=0.013)。
2.2不良反应 随着剂量的增加,不同治疗剂量阿帕替尼组不良反应发生的概率逐渐增高,出现最多的并发症为高血压(44.0%)、腹泻(12%)、手足反应(15.2%)。不同剂量组间腹泻、手足反应、出血和红疹的发生率存在统计学差异(均P<0.05)。见表2。
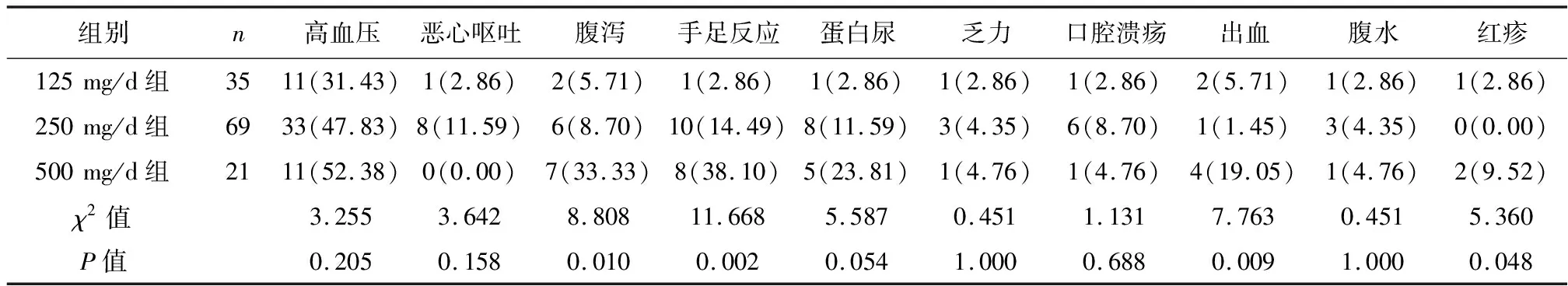
表2 阿帕替尼组不同剂量不良反应发生情况〔n(%)〕
3 讨 论
中晚期肝癌具有手术治疗难度大、病情进展快等特点,为了提高患者的生存质量,需要给予姑息性治疗〔14〕。在过去的30年里,TACE虽然已经广泛应用于中晚期HCC的治疗,但TACE的主要禁忌包括失代偿性肝衰竭、肾衰竭及门静脉癌栓无侧支形成等。此外,单独使用TACE难以完全阻断病灶血供,同时TACE可以激活VEGF的增殖,肝癌TACE术后因肿瘤缺血、缺氧坏死,从而导致VEGF表达升高,已被多项研究证实,术后肿瘤细胞可以通过侧支血管或栓塞血管以再通等方式导致疾病复发。VEGF抑制剂可通过抑制VEGF和VEGFR的组合,诱导肿瘤坏死并减少肿瘤侧支循环的机会。阿帕替尼通过高度竞争性抑制 VEGFR-2 的三磷酸腺苷(ATP)结合位点,抑制肿瘤血管生成。无论在体内还是体外实验阿帕替尼均显示了出色的抑癌作用〔15~18〕。
目前,研究已证实TACE联合阿帕替尼均可延长患者总OS〔19〕。Chen等〔20〕应用TACE联合阿帕替尼治疗晚期肝癌患者,显著延长患者的总生存率(中位OS:13.0 vs 9.9个月)。Lu等〔21〕报道,对于不可切除的晚期肝癌患者,应用TACE联合阿帕替尼可显著延长BCLC 分期B期及C期的肝癌患者的OS。Qiu等〔22〕研究结果显示,对于BCLCC期和B期患者,接受TACE联合阿帕替尼治疗的患者OS和PFS中均有明显延长,虽然mOS基本相符,但中位PFS还是存在差异。
多项临床研究已证实,应用阿帕替尼500 mg/d,出现严重级不良反应可能性较大,本研究显示250 mg/d组PFS及ORR显著优于另外两组,与以往文献〔23~26〕差异不大,但本研究为单中心临床回顾性研究,可能存在一定的选择性偏倚,一般资料当中,病灶个数在两组中差别较大,单纯TACE组单发病灶较多,而TACE联合阿帕替尼组多发病灶比例较高,可能也对结果产生影响。其次,本研究结果可能受到患者回忆偏差的影响,有必要在大样本和多中心进行前瞻性随机对照试验。下一步将扩大联合组样本量或比较TACE联合其他靶向药物或免疫抑制剂对肝癌的疗效。
综上,TACE与阿帕替尼联合治疗中晚期HCC患者,可改善治疗效果和提高OPR,延长中位PFS,且毒性可控,其中250 mg/d可作为临床治疗推荐。TACE与阿帕替尼联合治疗方案应在临床进行更深入的研究。

