咔唑⁃N,S⁃杂冠醚类荧光探针的合成及其检测Ag+性质
别福升 任爱山 徐华琴 王金虎 刘雪静 朱东建*,
(1枣庄学院,鲁南煤化工工程技术研究院,枣庄 277160)
(2贺州学院食品与生物工程学院,贺州 542899)
伴随工业的发展,大量重金属离子被排放到自然环境当中,成为一类重要的污染物。重金属离子能够在动植物体内富集,并沿食物链累积,对人类造成重大危害,引发各种疾病[1]。在诸多重金属离子中,银离子由于毒性较低而容易被忽视。低浓度的银离子是有益的,可消炎杀菌、除臭、促使伤口愈合,对抑制某些细菌、真菌和病毒等有较好的效果,研究表明安全又有效的浓度为10 mg·L−1[2]。但银离子在体内富集到一定浓度后会引起中毒,导致视力下降、癫痫等[3-4]。
因此,对银离子快速定性或定量检测分析具有非常重要的意义。对银离子的经典检测方法包括原子吸收光谱[5]、电感耦合等离子体光谱[6]和电化学[7]等。这些方法在样品制备和测试条件方面要求严格、程序繁琐,且仪器昂贵,而荧光分析法以其较高的灵敏度、方便操作、低成本和易于原位测量等特点发展迅速[8]。
目前科研工作者们设计了多种不同类型的荧光探针分子用于银离子的识别[9-10],如香豆素类[11-12]、萘酰亚胺类[13]、罗丹明类[14-15]、氟硼二吡咯类[16-17]等。咔唑类杂环化合物以其良好的化学稳定性、较高的荧光量子产率和易于修饰等优点,广泛作为化学传感器的荧光团[18]。冠醚是一类高柔韧性的配体,可形成有效的金属离子螯合物。当冠醚中氧原子被替换为硫原子或氮原子时,其对金属离子如银的配位能力会显著提高[19]。我们结合以上优点,设计、合成了一种新型荧光探针分子,以稳定且有优异光物理性质的N-乙基咔唑为荧光团、高配位能力的单氮二硫杂冠醚为识别基团,实现了对银离子的选择性识别。
1 实验部分
1.1 仪器与试剂
所用仪器包括紫外可见分光光度计(UV-2401,日本岛津公司)、荧光分光光度计(F-4600,日本日立公司)、超导核磁共振仪(AVANCE NEO 400,400 MHz,瑞士布鲁克公司)、液相色谱−串联四极杆质谱仪(Agilent 6530,美国安捷伦公司)、电感耦合等离子体发射光谱仪(ICP,OPTIMA 8000DV,PerkinElmer)、实验室台式pH计(PHS-3C,上海精密科学仪器公司)。
实验所用药品和试剂均为市售分析纯,实验用水为超纯水。
1.2 荧光探针分子L的合成与表征
L的合成路线如图1所示。
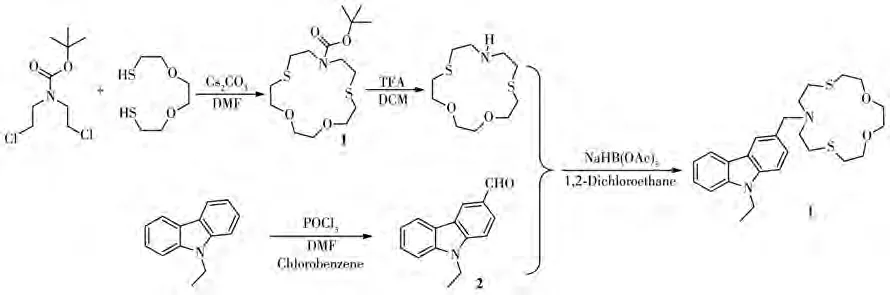
图1 探针L的合成路线Fig.1 Synthetic route of probe L
1.2.1 中间体1的合成
在1 L三口瓶中加入碳酸铯(2.18 g,6.7 mmol)和500 mL N,N-二甲基甲酰胺(DMF)。在2个恒压滴液漏斗中分别加入双(2-氯乙基)氨基甲酸叔丁酯(1.30 g,5.4 mmol)和 2,2-(乙烷-1,2-二丁基(氧基))二乙硫醇(0.98 g,5.4 mmol),分别用 100 mL DMF 溶解。置换氩气后升温至50℃,2个恒压滴液漏斗内的溶液同时缓慢滴加至三口瓶中,滴完后继续搅拌2 h。减压过滤,滤液蒸干溶剂DMF后再加入乙酸乙酯(EA)溶解。水洗(5×20 mL)后再用饱和NaCl溶液洗涤(20 mL),无水Na2SO4干燥,蒸干EA后得粗产物。将其柱层析得无色油状物0.98 g,产率52%。1H NMR(400 MHz,CDCl3):δ 3.73(t,J=5.1 Hz,4H),3.59(s,4H),3.49~3.36(m,4H),2.86~2.79(m,4H),2.68(t,J=5.2 Hz,4H),1.41(s,9H)。13C NMR(100 MHz,CDCl3):δ 155.2,79.7,73.9,73.8,70.6,49.2,48.8,31.7,31.5,31.5,31.1,28.4。
1.2.2 中间体2的合成
在50 mL三口瓶中加入N-乙基咔唑(0.6 g,3.1 mmol)、1.1 mL DMF、8 mL氯苯,冰水浴冷却后加入三氯氧磷(0.95 g,6.2 mmol),反应 30 min。恢复室温,反应30 min。然后升温至70℃,反应过夜。反应完全后,用饱和Na2CO3溶液洗涤。二氯甲烷(DCM)萃取(3×20 mL),无水 Na2SO4干燥,蒸干 DCM后得粗产物。柱层析得0.54 g白色固体,产率78%。1H NMR(400 MHz,CDCl3):δ 10.14(s,1H),8.64(d,J=1.7 Hz,1H),8.38(d,J=7.7 Hz,1H),8.11(d,J=8.6 Hz,1H),8.02(d,J=8.0 Hz,1H),7.62(d,J=8.6 Hz,1H),7.37(t,J=7.8 Hz,1H),4.44(q,J=7.2 Hz,2H),1.45(t,J=7.2 Hz,3H)。13C NMR(100 MHz,CDCl3):δ 191.5,145.5,136.8,132.0,130.3,128.9,127.9,125.7,123.9,123.6,122.6,119.8,110.5,41.4,14.4。
1.2.3 荧光探针L的合成
在50 mL单口瓶中加入中间体1(0.60 g,1.71 mmol),用5 mL DCM溶解后加入1.0 mL三氟乙酸,室温反应过夜。反应完全后,加入饱和Na2CO3溶液至pH=7~8,用DCM萃取(3×20 mL),合并有机相,无水Na2SO4干燥,蒸干溶剂后的固体直接用于下一步反应。
将上述粗产物放入50 mL单口瓶中,称量0.38 g中间体 2(1.7 mmol),加入10 mL 1,2-二氯乙烷,搅拌10 min。分批加入三乙酰氧基硼氢化钠(0.43 g,2.0 mmol),室温反应过夜。反应结束后,用1 mol·L−1盐酸调 pH=4~5。再用1 mol·L−1氢氧化钠溶液中和至pH=7~8。EA 萃取(3×20 mL),合并有机相,无水Na2SO4干燥,蒸干EA,柱层析得白色固体0.33 g,产率 42%。1H NMR(400 MHz,CDCl3):δ 8.09(d,J=8.6 Hz,1H),8.03(s,1H),7.45~7.43(m,2H),7.39(d,J=8.0 Hz,1H),7.34(d,J=8.2 Hz,1H),7.23~7.20(m,1H),4.36(q,J=8.0 Hz,2H),3.83(s,2H),3.78(t,J=7.8 Hz,4H),3.66(s,4H),2.85(s,8H),2.74(t,J=7.8 Hz,4H),1.43(t,J=7.2 Hz,3H)。13C NMR(100 MHz,CDCl3):δ 140.2,139.3,129.5,126.9,125.5,122.8,122.8,120.7,120.5,118.7,108.4,108.2,73.5,70.9,60.2,53.9,37.6,31.3,30.1,13.9。HR-MS(ESI-TOF)[M+H]+C25H35N2O2S2:m/z计算值459.213 5,实验值459.214 0。
1.3 溶液配制与光谱测量
探针L储备溶液用二甲基亚砜溶解配制,浓度为1.0 mmol·L−1。各种金属离子盐储备溶液均用超纯水溶解,浓度 5.0 mmol·L−1。在 5 mL 容量瓶中加入探针L储备液0.025 mL,再加入一定体积的金属离子储备液,用水/乙醇(4∶1,V/V)稀释至刻度,摇匀后测定光谱。荧光光谱所选激发波长为300 nm,激发和发射狭缝均为5 nm。扫描波长范围为320~550 nm。
2 结果与讨论
2.1 探针L对Ag+的识别
首先考察探针L在不同pH值(5.0~9.0)的荧光发射光谱。记录358 nm处荧光光谱的变化,可发现在pH=6~8时,探针L的荧光发射光谱变化较小(图2A),因此选择在中性条件下测试该探针对金属离子的识别。然后利用荧光光谱测试探针L对不同金属离子的选择性识别性能。如图2B所示,5µmol·L−1探针L在358和374 nm处有强的荧光发射峰。向探针溶液中加入7.5 µmol·L−1的Ag+后,探针分子的荧光发生显著猝灭。而在同等测试条件下,向探针溶液中分别加入 7.5 µmol·L−1的其他金属离子(Na+、K+、Ca2+、Ba2+、Cd2+、Ce2+、Co2+、Cr3+、Cu2+、Fe2+、Hg2+、Mg2+、Mn2+、Ni2+、Pb2+、Zn2+、Al3+、Fe3+),并没有使探针 L的荧光强度发生显著的变化。这表明探针L具有选择性识别Ag+的能力。
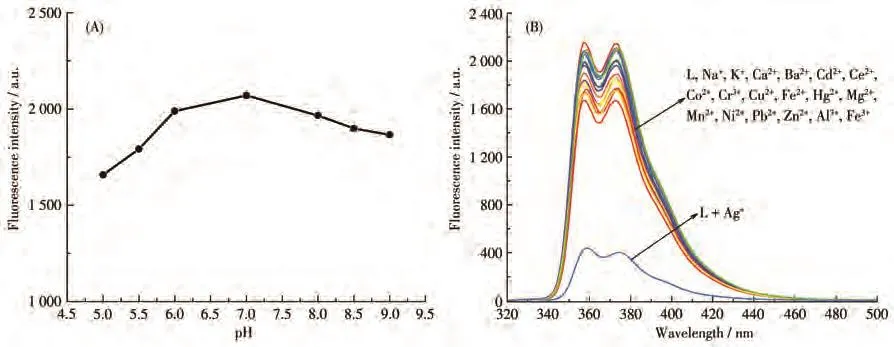
图2 (A)探针L的荧光发射光谱在358 nm处的荧光发射强度随pH变化图;(B)探针L及其加入各种不同金属离子后的荧光光谱图Fig.2 (A)Fluorescence intensity changes of probe L at 358 nm with pH;(B)Fluorescence spectra of L and L with various metal ions
随后考察该探针对Ag+检测的抗干扰能力。首先,配制5 µmol·L−1探针L溶液,再将10 µmol·L−1不同金属离子分别加入探针L溶液中,测量荧光光谱并记录358 nm处荧光发射峰强度。然后将10µmol·L−1的Ag+分别加入上述金属离子的溶液中,再次测量荧光光谱并记录358 nm处荧光发射峰强度,所得结果如图3所示。从结果可以得出,探针L对Ag+的选择性识别,基本不受实验所加入的其他金属离子干扰。
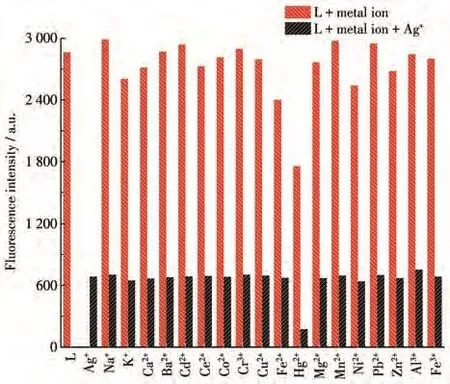
图3 探针L及其加入10µmol·L−1不同金属离子(红色柱)后再加入10 µmol·L−1Ag+(黑色柱)的荧光强度的柱状图Fig.3 Fluorescence intensity histograms of probe L and L with various metal ions with concentration of 10 µmol·L−1(red bar)and then added 10 µmol·L−1Ag+(black bar)
2.2 探针L对Ag+滴定实验
首先通过紫外吸收光谱滴定实验测试了探针L与Ag+的相互作用。没有加入Ag+时,探针L在270和300 nm处存在最大吸收峰。随着Ag+浓度增加,270 nm处最大吸收峰减弱,300 nm处最大吸收峰增强(图4A)。然后研究了探针L对Ag+的荧光光谱滴定实验。向探针L(5 µmol·L−1)的溶液中滴加Ag+,随着Ag+浓度增加,358和374 nm处的荧光强度逐渐减弱(图4B),推测Ag+与探针L配位作用时发生了反向光致电子转移过程,导致荧光猝灭。如图4C所示,378 nm处的荧光强度在Ag+浓度为0~4.5 µmol·L−1范围内呈现很好的线性关系(y=−2 055.07x+2 201.69,R2=0.991 2),利用检出限(LOD)计算公式[20]LOD=3σ/k(σ为测定10次空白值的标准偏差,k为校正曲线的斜率),计算探针L对Ag+的检测限是4.13 µmol·L−1。我国污水综合排放标准中第一类污染物最高允许排放浓度对Ag+的限量要求为4.64 µmol·L−1[21],探针L检测Ag+的检出限可满足该要求。
如图 4C 所示,加入约 5.0 µmol·L−1Ag+后 358 nm处光谱基本不再变化,继续加入Ag+(6.0~20µmol·L−1),荧光强度基本维持稳定,这说明探针L和Ag+的配位比可能为1∶1。Job′s plot实验结果也验证了1:1的配位比(图5)。高分辨质谱(ESI-TOF)测得探针L与Ag+配合物的式量为565.110 5(C25H34AgN2O2S2,计算值为 565.110 7),进一步验证了其1∶1的配位比。根据荧光滴定曲线数值,利用Benesi-Hildebrand方程[22]得到探针L与Ag+的配位常数 Ka为 2.01×105L·mol−1(线性拟合方程为 y=4.96×10−6/Ka+4.097×10−6,R2=0.964)。

图4 (A)探针L滴加Ag+(0~20 µmol·L−1)后紫外吸光度的变化图;(B)探针L滴加Ag+(0~20 µmol·L−1)后荧光光谱的变化图;(C)探针L在358 nm处荧光强度随Ag+浓度改变的变化图Fig.4 (A)UV absorbance changes of probe L with addition of Ag+(0-20 µmol·L−1);(B)Fluorescence specta changes of probe L with various addition of Ag+(0-20 µmol·L−1);(C)Fluorescence intensity changes at 358 nm of probe L with various concentrations of Ag+
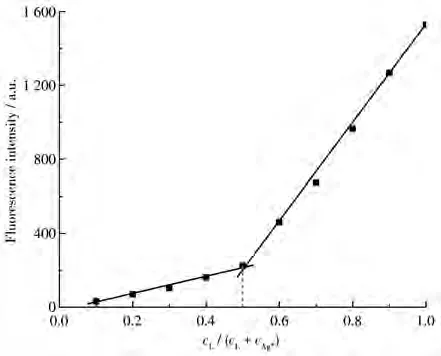
图5 探针L与Ag+配位作用的Job′s plotFig.5 Job′s plot for coordination of L with Ag+
我们推测探针L对Ag+的识别机理是N,S-杂冠醚通过离子−偶极作用对Ag+的整体配位(图6A)[23]。利用密度泛函理论(DFT)进一步研究其配位方式。在B3LYP/6-31G/LANL2DZ(Ag)计算水平下,对配位结构进行构型优化,得到探针L对Ag+的结合能为−565.72 kJ·mol−1,并给出部分结构参数(图 6B)。优化结果表明探针L和Ag+通过1∶1方式配位,这与Job′s plot实验和高分辨质谱结果一致。Ag—O和Ag—N键长在0.248~0.255 nm的正常键长范围内,而Ag—S键长在0.277~0.279 nm,作用较弱。以上所有计算由Turbomole和ChemShell 3.7.0.5进行[24]。
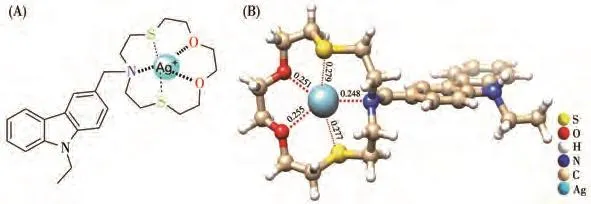
图6 (A)探针L对Ag+的可能识别机理;(B)DFT方法优化的L-Ag配位结构Fig.6 (A)Proposed recognition mechanism of probe L to Ag+;(B)Optimized geometry of L-Ag by DFT method
2.3 探针L对环境水样中Ag+的检测
取河水和自来水用滤膜进行简单过滤杂质后配制 0.5 mmol·L−1的 Ag+待测液。然后依次取 1.6、2.4、4.0µL的待测液加入到2 mL探针L溶液中进行荧光光谱测试。检测结果列于表1中。探针L对Ag+检测的回收率分别为94.0%~102.5%和97.0%~103.3%,检测结果具有较高准确性。同时将待测样品用ICP测定相应Ag+浓度,发现测试结果与荧光检测所得数值基本一致,因此证明探针L可以应用于环境水样中的Ag+检测。
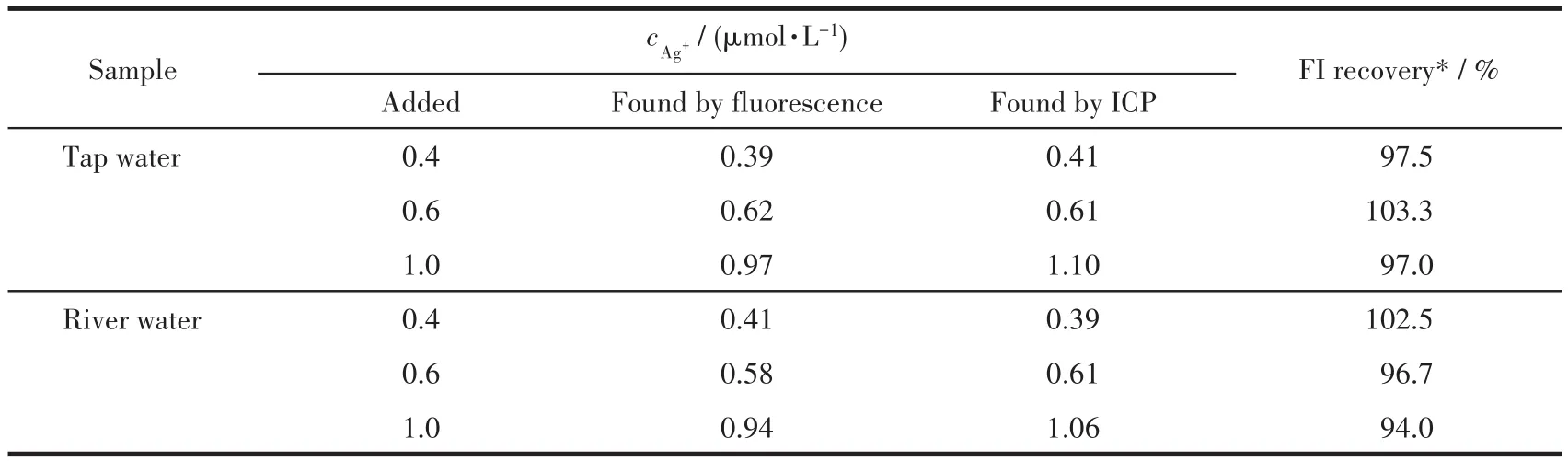
表1 环境水样中探针L对Ag+的检测结果Table 1 Detection results of probe L to Ag+in environmental water
3 结 论
设计、合成了一种以N-乙基咔唑为荧光团和杂冠醚为识别基团的Ag+荧光探针L。该探针随着Ag+的加入,表现出明显的荧光猝灭现象。通过与其他金属离子对比,L对Ag+的检测显示出较高的选择性和抗干扰能力。经计算表明,探针L与Ag+以1∶1的比例配位,其配位常数为 2.01×105L·mol−1,检出限为4.13 µmol·L−1。在水样检测实验中,对Ag+的检测回收率为94.0%~103.3%,表明可以应用于实际水样中Ag+的检测。

