电镀法制备Pt/TiO2纳米管电极及其电催化析氢性能
吴安冉 陈言慧 王心心 周文元 何佳伟 王金淑 李洪义
(北京工业大学材料与制造学部,北京 100124)
0 引言
与传统化石能源相比,氢能是一种可再生的清洁能源,其中电解水产氢是一种无污染、设备简单的工业制氢方法[1-3]。电解水制氢的核心部分为催化剂。铂(Pt)基材料通常被认为是最有效的析氢反应电催化剂[2,4-6],但价格昂贵和资源稀缺限制了其在催化领域的应用与发展。为了提高催化剂的利用率,将Pt基材料以较小的尺寸分散在载体上,从而减少Pt的用量,是解决上述问题的有效途径。因此,制备低铂、高活性、高稳定性的催化剂至关重要。纳米结构的Pt在减少催化剂用量的同时,由于其优异的稳定性及催化性能被广泛应用于各个领域[7-8]。
物理气相沉积(PVD)、化学气相沉积(CVD)以及电镀法等方法都可以实现载体上Pt基材料的纳米尺寸分布。其中,PVD和CVD需要真空环境,设备较为昂贵[9-12]。相比于上述2种方法,电镀法在常温常压下可进行,而且对Pt原料要求不高,实验室使用过的Pt电极或某些工业废弃的Pt等均可使用,这大大降低了制备成本,节约社会资源。电镀时,只需在硫酸溶液中,过电位超过1.1 V(vs RHE)时金属Pt就会发生溶解[13-14],从而在电极上生成Pt,操作方法简单,易于实现。同时,目标材料的形状、尺寸和结构可以通过调整沉积时间、沉积电位和电解质的组成等电镀条件有效地进行控制,因此电镀法更易于进行工业化生产。
在催化剂载体方面,碳基材料是常用的电催化剂载体,但是其存在容易在电化学反应过程中被氧化腐蚀等问题。二氧化钛(TiO2)具有较高的化学稳定性,也可作为催化剂载体,但在现有的Pt/TiO2催化剂中,常用的TiO2多为粉体材料[15-16],在实际应用中具有很大的局限性。TiO2纳米管作为一种一维的纳米材料,特殊的微观结构可以加快电荷转移,使其具有优异的电子传输能力。同时,纳米管规则的几何形貌和较高的表面粗糙度有助于Pt催化剂的分散和固载,因此TiO2纳米管作为一种理想的催化剂载体被广泛应用[17-19],此外,其在染料敏化太阳能电池、锂离子电池、耐摩擦磨损材料等领域有着较好的应用前景[17,20-26]。
因此,我们利用阳极氧化法在钛片表面制备得到了TiO2纳米管,通过热处理得到了锐钛矿型TiO2纳米管阵列后,利用电镀法将Pt沉积在TiO2纳米管上。通过此方法可以显著增加钛基底表面粗糙度和比表面积,提高键合力。Pt进入TiO2纳米管阵列中形成胶囊结构催化剂,该结构对Pt的有效保护可以提高Pt稳定性,从而提高催化效率。同时,一体化的Pt/TiO2复合电极设计思路也便于将其直接组成器件,应用场景更为广泛。
1 实验部分
1.1 Pt/TiO2电极的制备
首先,对钛片(1 cm×1 cm)进行预处理。将钛片在酸洗液(VHF∶VHNO∶3VH2O=1∶3∶6)中进行酸洗,去除钛表面的氧化膜后,分别在无水乙醇、去离子水中超声清洗去除表面残留酸洗液。在阳极氧化过程中,以预处理后的钛片为阳极,石墨片为阴极,含氟离子水溶液作为电解质制备TiO2纳米管阵列。其中,含 氟 离 子 水 溶 液 是 由 0.1 mol·L−1的 NH4HF2、0.5 mol·L−1的NH4H2PO4及1 L的去离子水混合而成,外部电压与阳极氧化反应时间分别设置为20 V和4 h。因上述反应得到的TiO2纳米管是无定形的,我们将阳极氧化后的钛片置于管式炉内,在450℃空气气氛下退火2 h,得到锐钛矿型TiO2纳米管阵列(TiO2-NTs)。同时,作为对照组,将预处理后的钛片直接在450℃空气气氛下退火2 h得到TiO2致密膜(TiO2-F)。
在室温下,采用三电极体系制备Pt/TiO2纳米管电极(Pt/TiO2-NTs)以及Pt/TiO2致密膜电极(Pt/TiO2-F),工作电极为TiO2-NTs或TiO2-F,对电极为铂片,参比电极为饱和KCl甘汞电极(SCE),电解质溶液为0.5 mol·L−1的H2SO4溶液,电化学窗口为−1.5~−0.3 V(vs SCE),扫描速率为100 mV·s−1,循环次数为1 000。
1.2 表征与性能测试
首先利用S-4800扫描电子显微镜(SEM)得到样品的微观形貌信息,加速电压为5~15 kV。采用型号为D8 Advance的X射线衍射仪(XRD)对样品进行物相分析,Cu Kα辐射源波长为0.154 18 nm,管电压为 40 kV,管电流为40 mA,扫描速率为 2(°)·min−1,扫描范围为20°~80°。进一步将TiO2纳米管从钛基底上剥离,并分散在微栅上,采用Talos F200X型透射电子显微镜(TEM,工作电压200 kV)获取高分辨率的材料形貌图像。材料表面的元素组成及化学状态由Axis Ultra X射线光电子能谱仪(XPS)来确定。电感耦合等离子体原子发射光谱(ICP)被用于对样品中元素的定量分析。ICP测试前,称取少量合成的催化剂溶于新配制的王水中,加热至留有少许溶液后定容至25 mL后进行测试。
电化学测试采用美国阿美特克PMC2000型电化学工作站进行,采用三电极体系,其中电镀法制备的复合电极为工作电极,碳棒为对电极,饱和甘汞电极为参比电极,电解液为氢气饱和的0.5 mol·L−1H2SO4溶液。首先通过循环伏安(CV)法对催化剂进行活化,扫描速率为100 mV·s−1,扫描电压范围为0~1.23 V(vs RHE),随后通过线性扫描伏安(LSV)法评估其催化性能,扫描区间为−0.5~0 V(vs RHE),扫描速率为1 mV·s−1。交流阻抗谱(EIS)的测试频率范围为100 mHz~100 kHz,电压振幅为5.0 mV。
在氢气饱和的0.5 mol·L−1的H2SO4电解液中,以100 mV·s−1的扫描速率在−0.15~0.4 V(vs RHE)的电压范围内对样品进行了3 000个CV加速测试,以对样品进行加速耐久性(ADT)测试,并通过极化曲线与ADT测试循环前的极化曲线进行对比评价了催化剂的稳定性。同时,在恒定电流(10 mA·cm−2)条件下催化剂的稳定性采用计时电位法进行测试,电解液为氢气饱和的 0.5 mol·L−1H2SO4,测试时间为 12 h。由于双电层电容与电极的有效电化学活性表面积呈线性关系,为了计算电化学活性表面积,我们测试了不同扫描速率(20、40、60、80、100 mV·s−1)下的CV曲线,通过绘制电容电流与扫描速率的关系曲线得到斜率,即为双电层电容值。
2 结果与讨论
2.1 结构及形貌表征
图1为热处理前后TiO2-NTs以及TiO2-F晶体结构的XRD图。XRD结果表明,热处理前,TiO2-NTs呈无定形态,衍射峰以Ti为主,其中2θ为38.6°、40.3°和 53.1°的衍射峰分别对应 Ti的(002)、(101)和(102)晶面。热处理后,TiO2-NTs与TiO2-F在25.4°和48.1°处出现锐钛矿TiO2特征峰,表明TiO2通过热处理由无定形态转变为锐钛矿型。
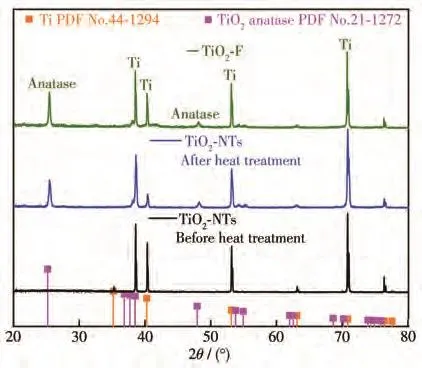
图1 TiO2-NTs热处理前后以及TiO2-F的XRD图Fig.1 XRD patterns of TiO2-NTs before and after heat treatment and TiO2-F
图2为阳极氧化法得到的TiO2-NTs的SEM图。从图中可以看出,钛片表面形成了纳米管结构,纳米管具有内、外表面,排列整齐、紧密,管口的形状规则,管径为80~100 nm,长约为1.72 µm(图2b)。这样的结构增加了载体的粗糙度和比表面积,负载催化剂时可以提供更多的活性位点,有望提高催化效率。同时,管与管之间连接紧密,结合强度较好。相较于纳米管阵列,TiO2-F表面为一层无特定结构的氧化薄膜,如图3所示。

图2 TiO2-NTs的平面SEM图(a)和截面SEM图(b)Fig.2 Top SEM image(a)and cross section SEM image(b)of TiO2-NTs

图3 TiO2-F的截面SEM图(a)和平面SEM图(b)Fig.3 Cross section SEM image(a)and top SEM image(b)of TiO2-F
图4为Pt/TiO2-NTs电极的XPS谱图。由全谱图(图4a)可知,样品中有明显的Pt、C、Ti、O元素的光电子峰。进一步利用XPSPEAK4.1软件对数据进行了拟合分析。通过图4b可以观察到Pt4f7/2和Pt4f5/2位于71.0和74.3 eV处的光电子峰分别对应单质铂,72.0和75.3 eV处出现的光电子峰分别对应二价铂。在Pt/TiO2-NTs的O1s谱图中,530.4 eV处的峰归属于TiO2中的Ti—O键,530.9 eV处的峰对应Pt—O[27],532.5 eV处的峰对应表面羟基(H—O)中的氧[28-29](图4c)。Ti的2p3/2和2p1/2的光电子峰分别位于458.9和464.7 eV,对应Ti4+(图4d)。

图4 Pt/TiO2-NTs的XPS谱图Fig.4 XPS spectra of Pt/TiO2-NTs
图5为Pt/TiO2-NTs的SEM图,从图中可以观察到Pt均匀分布在纳米管口,粒径为33.7~57.6 nm,平均粒径为46.4 nm。图6为Pt/TiO2-F的SEM图,Pt的粒径为99.4~132.0 nm,平均粒径为113.4 nm。该结果表明,在纳米管表面电镀法制备的Pt/TiO2-NTs复合电极的Pt颗粒尺寸更小,分布更均匀。我们认为2种载体表面Pt颗粒形貌产生差异的原因是由于相对于致密膜,TiO2纳米管阵列具有更大的表面粗糙度,在沉积过程中,粗糙的纳米管阵列结构使其具备更多的形核点,从而均匀地形成尺寸较小的Pt纳米颗粒。而在光滑平整的致密膜表面上,Pt纳米颗粒在形成过程中易发生团聚,从而向更大尺寸生长。同时,通过计算复合电极Pt的负载量(质量分数)发现,无论是Pt/TiO2-NTs还是Pt/TiO2-F复合电极,其Pt负载量都很低,Pt/TiO2-NTs中Pt的负载量为2.48%,Pt/TiO2-F中Pt的负载量为3.01%。

图5 (a、b)Pt/TiO2-NTs复合电极的SEM图及(c)对应的Pt粒径分布图Fig.5 (a,b)SEM images of Pt/TiO2-NTs composite electrode and(c)corresponding particle size distribution of Pt

图6 (a、b)Pt/TiO2-F复合电极的SEM图及(c)相应的Pt粒径分布图Fig.6 (a,b)SEM images of Pt/TiO2-F composite electrode and(c)corresponding particle size distribution of Pt
为了进一步研究Pt纳米颗粒在纳米管阵列中的分布情况,我们将钛片上的纳米管阵列进行了机械剥离,并对其进行了TEM测试。图7a为纳米管的TEM图,纳米管直径约为80.0 nm,Pt纳米颗粒分散于纳米管阵列中,其直径约为45.0 nm,纳米管与Pt纳米颗粒形成一种包覆颗粒的胶囊型结构。其中,图7c和7d的高分辨TEM(HRTEM)图分别对应图7b中的1、2区域,Pt的主晶面间距d=0.225 nm,对应Pt(111)晶面;TiO2的主晶面间距d=0.354 nm,对应锐钛矿相TiO2的(101)晶面。进一步通过扫描透射电子显微镜(STEM)对Pt/TiO2-NTs内部元素的分布情况进行了分析(图8b~8d),可以看出Pt分布于TiO2纳米管阵列中,TiO2纳米管阵列结构提供了更大的比表面积。

图7 (a)Pt/TiO2-NTs和(b)Pt纳米颗粒的TEM图;(c)Pt纳米粒子和(d)TiO2的HRTEM图Fig.7 TEM images of(a)Pt/TiO2-NTs and(b)Pt nanoparticles;HRTEM images of(c)Pt nanoparticles and(d)TiO2
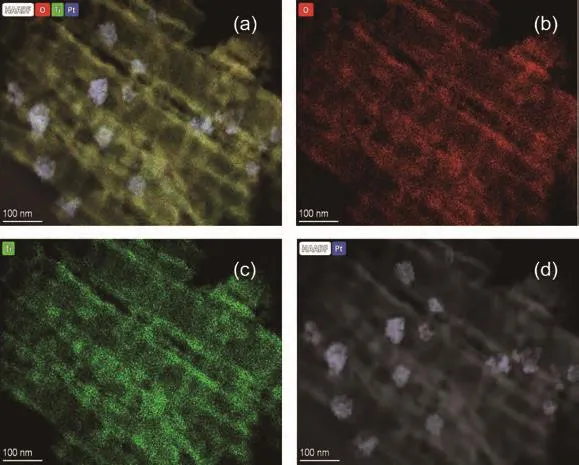
图8 (a)Pt/TiO2-NTs的STEM图;(b~d)Pt/TiO2-NTs中O、Ti和Pt的元素分布图Fig.8 (a)STEM image of Pt/TiO2-NTs;(b-d)Element distribution mappings of O,Ti,and Pt in Pt/TiO2-NTs
2.2 性能测试
为了探究复合电极的电催化性能,在氢气饱和0.5 mol·L−1的 H2SO4溶液中对复合电极进行了析氢性能研究。图9a为Pt/TiO2-F、Pt/TiO2-NTs与商业Pt/C(Pt质量分数20%)的析氢极化曲线。对电流密度为 10 mA·cm−2时的过电位进行对比(图9b),发现 Pt/TiO2-NTs的过电位最低,商业Pt/C次之,Pt/TiO2-F的最高。由于较低的过电位说明电极具有较好的催化性能,在上述3种电极中Pt/TiO2-NTs具有最佳的催化性能。同时,根据极化曲线利用塔菲尔曲线拟合计算得到塔菲尔斜率(图9c)。Pt/TiO2-F的塔菲尔斜率最大,为54.0 mV·dec−1,Pt/TiO2-NTs与商业Pt/C的塔菲尔斜率接近,分别为42.7、44.2 mV·dec−1。塔菲尔斜率越小,到达较大电流密度所需的过电位越小,其催化性能越好,因此塔菲尔斜率的结果同样证明了Pt/TiO2-NTs的催化性能较好。为了定量地分析各种催化剂在电催化析氢过程中的催化活性,将数据进行了归一化处理,计算了不同电位下催化剂的单位质量活性(图9d)。在相同过电位下,Pt/TiO2-NTs的质量电流密度均高于其他2种电极。在过电位为−0.05 V(vs RHE)时,Pt/TiO2-NTs的质量电流密度为 0.37 A·mg−1,高于 Pt/C(0.157 A·mg−1)以及Pt/TiO2-F(0.11 A·mg−1);在过电位为−0.10 V(vs RHE)时,Pt/TiO2-NTs的质量电流密度为 1.97 A·mg−1,高于Pt/C的1.21 A·mg−1,是Pt/TiO2-F的2.98倍;在过电位为−0.15 V(vs RHE)时,Pt/TiO2-NTs的质量电流密度为 4.20 A·mg−1,是 Pt/C 的1.48倍,Pt/TiO2-F的2.57倍。这些研究结果表明,相对于Pt/TiO2-F和商业Pt/C,Pt/TiO2-NTs电极上的Pt利用率最高,结合Pt/TiO2-NTs中Pt的负载量仅为2.48%,我们认为本工作中的复合电极降低了催化剂的成本,更有望在工业生产中得到大规模应用。
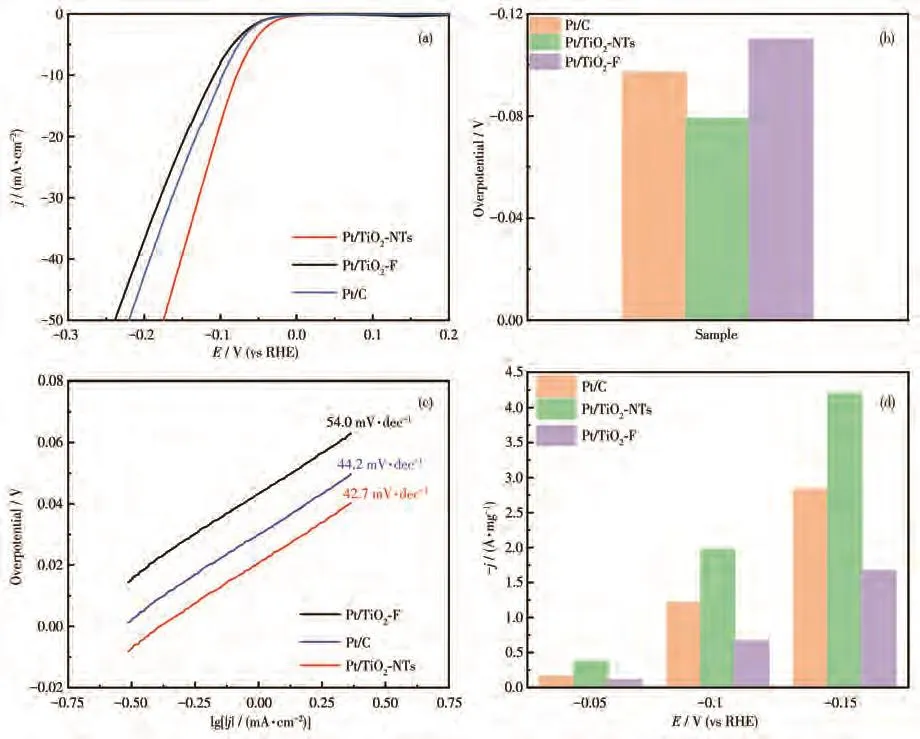
图9 Pt/TiO2-NTs、Pt/TiO2-F及Pt/C的(a)析氢极化曲线、(b)过电位、(c)塔菲尔曲线和(d)在不同电位下质量电流密度图Fig.9 (a)Hydrogen evolution polarization curves,(b)overpotentials,(c)Tafel curves,and(d)mass current density graphs at different potentials of Pt/TiO2-NTs,Pt/TiO2-F,and Pt/C
通过EIS测试对催化剂在析氢过程中的电荷转移性能进行了研究,如图10所示。其中,Rs为溶液电阻,C为双电层电容,R为电荷转移电阻。由图可知,TiO2-NTs的阻抗为11 kΩ,TiO2-F的阻抗为50 kΩ,TiO2-F阻抗值远大于TiO2-NTs,表明TiO2-NTs的一维阵列结构加快了电荷转移。同时,在负载Pt后,相较于Pt/TiO2-F,Pt/TiO2-NTs显示出较小的阻抗值,表明其在催化剂和电解质之间电荷转移速率更快,电催化析氢的效率得到提高。

图10 TiO2-NTs、TiO2-F、Pt/TiO2-NTs和Pt/TiO2-F催化剂的EIS谱图及等效电路图(插图)Fig.10 EIS spectra of TiO2-NTs,TiO2-F,Pt/TiO2-NTs,and Pt/TiO2-F catalysts and equivalent circuit diagram(Inset)
此外,通过CV法测试了不同扫描速率下的双电层电容,进一步计算得到了不同样品的电化学活性面积,如图11所示。Pt/TiO2-NTs、Pt/TiO2-F的双电层电容分别为2.48和0.05 mF·cm−2,进一步证明了Pt/TiO2-NTs具有更大的电化学活性面积,具备更多的催化析氢活性位点。
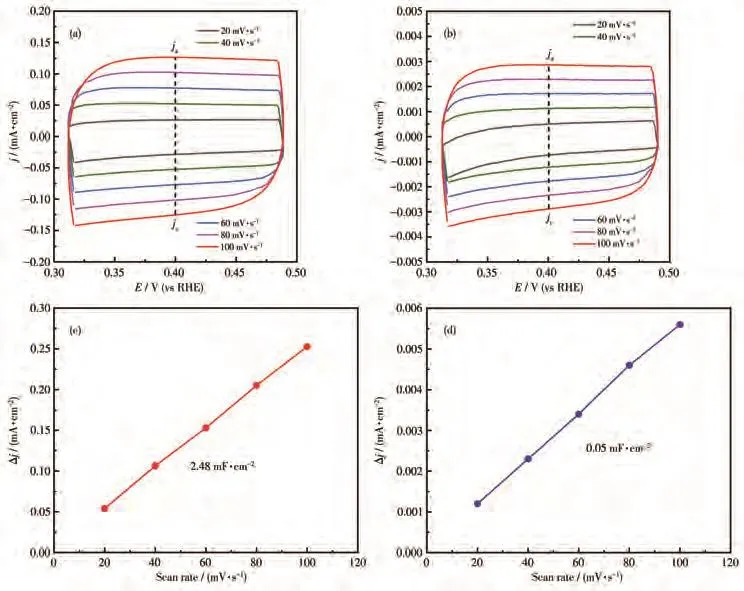
图11 (a)Pt/TiO2-NTs和(b)Pt/TiO2-F的CV曲线;(c)Pt/TiO2-NTs和(d)Pt/TiO2-F的电流密度和扫描速率的关系图Fig.11 CV curves of(a)Pt/TiO2-NTs and(b)Pt/TiO2-F;Relationship between current density and scan rate for(c)Pt/TiO2-NTs and(d)Pt/TiO2-F
稳定性是催化剂性能评定的重要指标之一。我们采用ADT实验检测了催化剂的稳定性,并通过对比反应前后的极化曲线、催化剂的质量活性损失以及催化剂的微观形貌变化评价了催化剂的稳定性。图12a~12c分别为Pt/TiO2-NTs、商业Pt/C以及Pt/TiO2-F在3 000个长循环前后的极化曲线。通过对比发现,Pt/TiO2-NTs的极化曲线与其初始的极化曲线相近,电流密度的衰减相对于其他2种催化剂小,商业Pt/C的衰减介于Pt/TiO2-NTs与Pt/TiO2-F之间,而Pt/TiO2-F电流密度有非常大的衰减。进一步的计算结果表明,在−0.01 V(vs RHE)的过电位下,Pt/TiO2-NTs、商业Pt/C、Pt/TiO2-F的电流密度分别损失了9.97%、18.10%、40.03%(图12d),电流密度损失表明Pt/TiO2-NTs在3种电极中具有最优异的稳定性。结合上述形貌表征我们认为Pt/TiO2-NTs性能的提高是由于Pt纳米颗粒进入TiO2纳米管阵列中形成了胶囊结构,这种特殊的结构相较于平坦致密膜催化剂的稳定性大大提高,同时,Pt—O键的强相互作用也是其具有高稳定性的原因。

图12 (a)Pt/TiO2-NTs、(b)Pt/C、(c)Pt/TiO2-F循环测试前后的极化曲线;(d)ADT测试后,Pt/TiO2-NTs、Pt/TiO2-F及Pt/C催化剂的质量活性损失对比图Fig.12 Polarization curves of(a)Pt/TiO2-NTs,(b)Pt/C,and(c)Pt/TiO2-F before and after cycle stability test;(d)Mass activity loss comparison chart of Pt/TiO2-NTs,Pt/TiO2-F,and Pt/C catalysts after ADT test
图13为ADT测试后Pt/TiO2-NTs的SEM图,通过与图5中Pt/TiO2-NTs的表面形貌对比可知,ADT测试前后的Pt/TiO2-NTs表面并没有发生显著变化,Pt没有脱落,依然较为均匀地分布于TiO2纳米管阵列上。图14为Pt/TiO2-F进行ADT实验后的SEM图,通过与图6对比发现,致密膜上Pt部分脱落。而且在处理Pt/TiO2-F的过程中(如冲洗残余电解质的过程中)沉积在致密膜上的Pt也非常容易脱落,这些现象均说明了致密膜对Pt颗粒的固载作用较弱。

图13 Pt/TiO2-NTs在ADT测试后的SEM图Fig.13 SEM images of Pt/TiO2-NTs after ADT test

图14 Pt/TiO2-F在ADT测试后的SEM图Fig.14 SEM images of Pt/TiO2-F after ADT test
进一步采用计时电位法对Pt/TiO2-NTs、Pt/TiO2-F及商业Pt/C进行了析氢反应长期稳定性测试。图15为在恒定电流密度10 mA·cm−2下的过电位随时间变化的曲线图。其中,Pt/TiO2-NTs显示了最好的稳定性,12 h后过电位没有变化,而商业Pt/C、Pt/TiO2-F的过电位随着时间都有不同程度的衰减。这进一步表明了Pt/TiO2-NTs具有优异的稳定性。

图15 Pt/TiO2-NTs、Pt/TiO2-F及商业Pt/C在电流密度为10 mA·cm−2时的计时电位曲线Fig.15 Chronopotential curves of Pt/TiO2-NTs,Pt/TiO2-F,and commercial Pt/C at current density of 10 mA·cm−2
3 结 论
以阳极氧化制备的二氧化钛纳米管阵列作为载体,通过简单的电镀法在TiO2纳米管阵列上形成具有胶囊结构的复合电极Pt/TiO2-NTs。相比于商业Pt/C电极和钛表面致密膜作为载体制备的对比电极,Pt/TiO2-NTs的电催化活性最高,其质量电流密度分别是Pt/C电极的1.48倍和对比电极的2.57倍。电催化活性提高的主要原因是粗糙度高且比表面积大的纳米管阵列对Pt起到分散作用。此外,Pt与TiO2纳米管形成的胶囊结构,对Pt具有很强的固载作用,使催化剂具有优异的稳定性。由于采用电镀法制备Pt催化剂的过程中,对铂电极没有特殊的要求,因此,该方法为铂资源的重复利用提供了一个行之有效的方法。

