环金属铱配合物的分子设计
聂建航,王 哲,曲珈慧,曾 妮,刘乃青,张建坡*,金 丽*
(1.吉林化工学院 化学与制药工程学院,吉林 吉林 132022;2.吉林石化公司研究院,吉林 吉林 132022)
近几十年来,固态照明[1-2]已成为一种多功能且高性价比的核心技术,该技术可满足高分辨率显示器的耐用性和灵活性需求,特别是拥有电致发光材料[3-4]特点的有机发光二极管(OLED),对于完成这种照明器件的设计具有明显优势[5].过渡金属配合物一直是研究最为广泛的发光材料之一,因为它可以促进从激发单重态到激发三重态的系间窜跃(IsC),并且重金属效应促进了从三重态激发态到基态的自旋禁阻跃迁,因此,理论上发光器件的内部量子效率(IQE)能够接近100%[6].
在众多过渡金属配合物中,环金属化铱(Ⅲ)配合物因其优异的光致发光性能而备受关注,它一方面拥有较高的磷光量子效率,另一方面具备电化学性质和发射波长的可调谐性,成为近年来构建高效发光器件的最佳选择[7-9].为了进一步揭示配体连接与分子发光性能的相关性,采用密度泛函方法对一类同分异构体铱[(btq)2Ir(pic)]配合物进行了分子设计和理论研究,通过探究2-(苯并噻吩-2-基)喹啉中苯环不同位置对配合物的影响,阐明了此类配合物的发光规律,揭示了苯环位置的不同对分子结构和光谱性质的影响.
1 计算方法
采用密度泛函(DFT)方法中的杂化B3LYP[10]泛函和CIs方法,分别优化了3个同分异构体[(btq)2Ir(pic)]配合物的基态和激发态几何结构,在结构优化基础上,使用含时密度泛函(TD-DFT)[11]方法及极化连续介质模型(CPCM)得到了配合物1-3在CH2Cl2溶剂中的吸收和发射光谱.在优化过程中为了节省计算时间和降低计算成本,采用目前过渡金属配合物计算常用的以下基组:Ir原子使用LanL2DZ基组[12],C、H、N、O、S原子使用6-31G*基组.以上所有计算通过使用gauss09程序包在曙光A620-G30服务器中完成.
2 结果与讨论
2.1 基态与激发态分子几何结构
图1为配合物1~3的平面结构图,以配合物1为例的优化几何结构及原子编号展示在图2,其他分子的编号与之相对应.3个配合物互为同分异构体,其区别在于苯并噻吩喹啉配体上,喹啉部分的苯环位置不同.选取的3个配合物代表性S0和T1态结构参数列在了表1.

图1 配合物1~3的平面结构

图2 配合物1的优化几何结构及原子编号
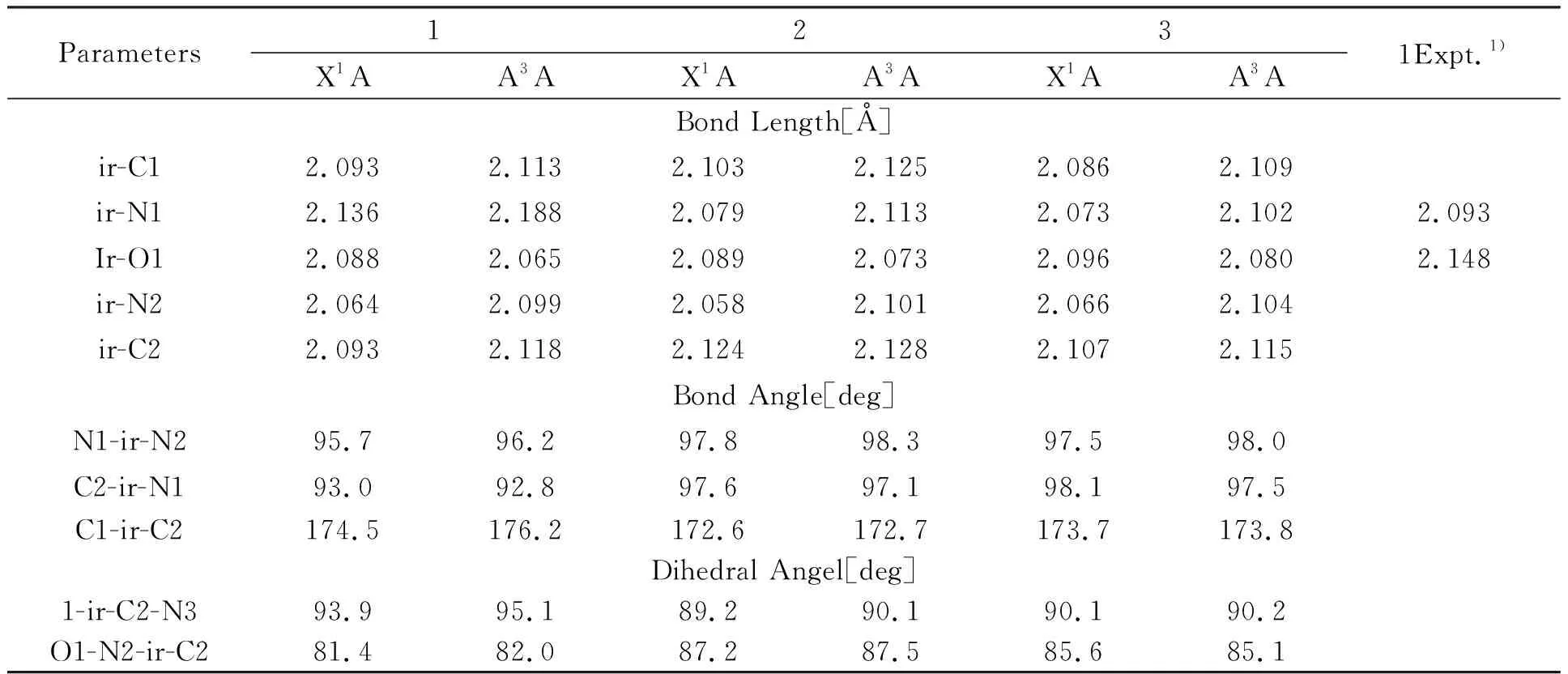
表1 配合物1~3的基态和三重激发态几何结构参数及实验值
由表1可知,基态时分子1的Ir-N1和Ir-O1键长分别为2.136和2.088Å,与其实验值相差了0.043和0.060Å,体现了理论计算与分子实际存在形态的不同所带来的差异,在误差允许范围内结构数据合理.横向比较3个分子的键长值,在其他键长差距都很小的情况下,配合物1的Ir-N1键长与2和3相差0.06Å,表明连接位置的改变,显著影响了金属和喹啉环的相互作用,这种作用可认为是由于空间位阻效应和共轭效应双重作用的结果,该作用也显著影响了分子2和3的C2-Ir-N1键角和O1-N2-Ir-C2二面角,它们与1的差距都在5°左右.3个配合物的键角N1-Ir-N2和C1-Ir-C2分别接近90°和180°,二面角N1-Ir-C2-N3和O1-N2-Ir-C2均接近90°,表明3个双齿配体彼此之间近似垂直,整个分子体系处于正八面体的稳定构型.
激发态时,键长的变化比较规律,配合物1~3的Ir-C(1)、Ir-C(2)、Ir-N(1)、Ir-N(2)键长均增大了0.004~0.05Å,而Ir-O(1)均缩小了0.016~0.023Å.可以断定激发态时,金属与btq配体间的电子云密度减小,相互作用力减弱,对分子聚集现象起到改善作用,而金属与O1原子的电子云密度增加,增强了金属和pic配体O端的相互作用.表明激发时电子跃迁偏向于pic配体一端,在增强金属与pic配体相互作用的同时,削弱了其与btq配体的作用.此外,激发态时键角和二面角有增、有减,但总体变化都不大.
2.2 苯环位置改变对分子吸收光谱的影响
利用Origin软件模拟了3个配合物在CH2Cl2溶剂中的吸收光谱(图3).

Wavelength/nm图3 配合物1~3在CH2Cl2溶液中模拟的Gauss型吸收曲线
表2给出每个配合物包括跃迁涉及的分子轨道、振荡强度及波长等代表性光谱数据,表3~5给出了代表性吸收所涉及的分子轨道成分及能量.

表2 配合物1~3在CH2Cl2溶剂中的代表性吸收光谱及实验值

表3 配合物1在B3LYP泛函水平下的基态分子轨道成分

续表3

表4 配合物2在B3LYP泛函水平下的基态分子轨道成分

表5 配合物3在B3LYP泛函水平下的基态分子轨道成分
从图3可以看到,配合物1~3有4个代表性吸收带,由于其最低能吸收的振荡强度较小,所以在吸收光谱图中表现得并不明显,但该吸收却是光谱数据中最重要的一组跃迁.来自表2和3,3个分子的最低能吸收分别在488(2.55)、455(2.73)和485(2.56 eV) nm.分子1在488 nm吸收来自轨道175→176的激发,分子轨道175是由28.9%的d(Ir)和63.5%的π(btq1)构成的最高占据分子轨道(HOMO),而分子轨道176为最低空轨道(LOMO),它主要由89.9%的π*(btq1)配体占据,因此该跃迁被指认为[d(Ir)+π(btq1)→π*(btq1)]的金属Ir到btq配体(MLCT)以及btq配体内部(IlCT)的电荷转移跃迁.类似于上面的轨道占据分析,配合物2和3的该处吸收与配合物1具有相似的跃迁性质.对比3个配合物的吸收,配合物1和2的吸收波长相差33 nm,配合物1拥有最大的吸收波长和振荡强度,配合物2具有最小的吸收波长和振荡强度,表明苯环的连接位置对该处吸收影响较大,这主要是由于苯环的不同连接位置改变了整个配体的共轭能力和配体间的空间位阻,这可能会进一步导致它们发光颜色的转变.
第2个吸收带与最低能吸收相比,它们的峰强度有了明显的提高,在吸收图中很容易观察到,但分子2仍具有最小的吸收波长和振荡强度.3个配合物在该处的代表性吸收分别位于453、441和458 nm,由表2可知它们均属于HOMO-1→LUMO的跃迁,其中HOMO-1与HOMO轨道的轨道占据基本相同,因此该跃迁也属于MLCT/IlCT混合跃迁.
第3个吸收带的代表性吸收分别位于352、389和373 nm,由表2可知它们均来自完全不同的轨道激发.配合物1在352 nm的吸收来自轨道172→176的激发,轨道172由16.3%的d(Ir)、20.3%的π(pic)和63.4%的π(btq1)构成,而轨道176是占据在btq1配体上的π反键轨道,因此该跃迁被指认为[d(Ir)+π(pic)+π(btq1)→ π*(btq1)]的金属到btq1和pic配体到btq1配体的电荷转移(MLCT/LLCT)跃迁.配合物3的该处跃迁与1有相似的跃迁性质.而配合物2,从轨道占据分析可以看出,该处跃迁完全没有pic配体的参与,因此被指认为具有MLCT/IlCT跃迁性质.来自表2和图3,配合物2的该跃迁在3个分子中一跃成为强度和波长都最大的跃迁,这和它的低能吸收正好相反,表明苯环位置居中在降低低能吸收波长和强度的同时,会增强高能吸收波长和强度.1的该处吸收理论值和实验值之差仅为7 nm,表明理论计算结果的准确性高.
它们的第4个吸收带是吸收图上波峰最高的那一组,在实验中最容易被观测.3个配合物的吸收波长基本相同,表明苯环位置的改变基本不影响该处吸收的数值,但它们的振荡强度仍有较大区别.由图3可以看出,配合物2的波峰强度最大,主要是由于其在317 nm附近存在几个强峰共同叠加的结果.分子1在316 nm的吸收来自轨道168→177的激发,分子轨道168是占据在btq1配体上的π成键轨道,而分子轨道177由36.8%的π*(pic)和59.8%的π*(btq1)构成,该跃迁属于[π(btq1)→π*(pic)+π*(btq1)]的btq1配体到pic配体和btq1配体内部的电荷转移(LLCT/IlCT)跃迁.与此相对,从轨道分析可知分子2和3的该跃迁属于[π(pic)+π(btq)→π*(btq)]的pic配体到btq配体和btq配体内部的电荷转移(LLCT/IlCT)跃迁,3个分子虽都为LLCT/IlCT跃迁,但有本质的区别.
2.3 苯环位置改变对分子发射光谱的影响
表6列出了3个配合物在CH2Cl2溶剂中的最低能发射光谱数据,它们分别位于679、642和683 nm,且分子1的理论和实验值相差19 nm.来自表6,该跃迁均属于176(LUMO)→175(HOMO)的激发,和其相对应的最低能吸收轨道占据相似,其HOMO主要由金属Ir的d轨道和配体btq的π轨道构成,而LUMO则主要占据在配体btq上,因此也具有相似的3MLCT/3IlCT跃迁特征.比较3个配合物的发射波长,最大差距为41 nm,但都落在红光范围内,分子2距离橙黄色发光只有20 nm的差距,通过进一步的结构改变和分子设计一定可以实现该类配合物的颜色转换.1~3的最低能吸收和发射的能量差分别为0.73、0.80和0.75 eV,适当的能量差对应着其基态到激发态结构改变的斯托克斯频移.

表6 1~3在CH2Cl2溶剂中的发射光谱数据及实验值
3 结 论
对含有2-(苯并噻吩-2-基)喹啉和吡啶甲酸酯配体的铱配合物进行了一系列分子设计研究,探究了改变喹啉上的苯环位置对此类配合物的结构及光谱性质的影响.苯环位置的改变显著影响了分子2和3的部分键长(Ir-N1)、键角(C2-Ir-N1)和二面角(O1-N2-Ir-C2),即在增强金属与喹啉环相互作用的同时,受空间位阻和共轭效应的影响,分子结构发生不用程度的扭曲,但都保持稳定的八面体构型.苯环位置的改变使分子2的发射波长产生明显蓝移(41 nm),在减小低能吸收波长和振荡强度的同时(第1、2吸收带),显著提升了高能吸收的振荡强度(第3、4吸收带),并使高能吸收的跃迁性质产生显著的差异.相对于分子2,分子3在吸收和发射波长、振荡强度和跃迁性质等方面与分子1都比较接近,只是在第4个吸收带的跃迁性质上与1有略微差异.研究结果表明:苯环在喹啉环连接的中间位置(分子2)时,对整个配合物结构和光谱影响较大,通过对该位置的分子设计可以实现此类配合物的开发.

