猪圆环病毒2型抗体与病原检测相关性分析
袁翠平,贺会利,马宇毅,岑 敏,李 军
(广西兽医研究所/广西兽医生物技术重点实验室 530001)
猪圆环病毒(Porcinecircovirus,PCV)属于圆环病毒科圆环病毒属的DNA病毒,呈闭合单股环状,是负链无囊膜结构,为目前已知的最小哺乳动物病毒[1-2]。根据其抗原性及基因组,可以分为:猪圆环病毒1型(PCV-1)、猪圆环病毒2型(PCV-2)、猪圆环病毒3型(PCV-3),其中PCV-1几乎不引起猪群疾病[3]。PCV-2对猪群有非常强的致病性,主要引起断奶猪多系统衰竭综合征(PMWS)、猪皮炎与肾病综合征(PDNS)、猪呼吸道疾病复合征(PRDC)、母猪繁殖障碍及猪间质性肺炎等症状[4-5]。PCV-3引起母猪皮炎肾病综合征与繁殖障碍,仔猪腹泻,现处于研究阶段。2019年,猪群中发现了基因大小为1770bp的圆环病毒,定为猪圆环病毒4型(PCV-4)[6],PCV-4在我国也广泛存在,但由于PCV-4是2019年才发现的,研究资料较少。PCV-2目前是养殖场猪的主要元凶[7],虽然疫苗在PCV-2的防控中发挥一定作用,但是国内猪群普遍存在PCV-2的感染情况[8],PCV-2主要破坏机体的免疫功能,以淋巴肿大、淋巴细胞减少为特征,从而引起免疫抑制,增加了与其他病原体混合感染的机会,从而导致病猪的死亡率升高,极大地阻碍了养猪业的健康发展。本试验通过对猪群PCV-2的抗体和病原检测,对比结果分析抗体水平和野毒感染之间的关系,从而发现潜在的易感群体,评估疫病的防控效果,进而为PCV-2的诊断提供科学依据,减少经济损失,提高养殖业收入。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器病毒DNA提取试剂盒、2×ESTaq-MasterMix、DNAMarker2000等由北京康为世纪生物科技有限公司提供;琼脂糖凝胶购自西班牙GENE公司;LifePCR仪、凝胶成像系统购自Bio-rad公司。PCV-2ELISA抗体检测试剂盒购自韩国JBT公司;台式离心机购自德国Eppendorf公司;LabsystemsDragonMK3酶标仪购自芬兰雷勃公司。
1.1.2 临床样品采集自广西南宁规模化猪场的保育猪血清115份、育肥猪血清183份,共298份。阳性样品由广西兽医生物技术重点实验室保存。所有检测猪均过免疫PCV-2灭活疫苗。
1.2 方法
1.2.1 PCV-2抗体水平无菌前腔静脉采血,采集的全血8000r/min离心5~10min后,取上清液,PCV-2抗体检测操作步骤和结果判断按使用的说明书进行。
1.2.2 样品RNA/DNA提取取1.2.1离心后的上清液,按照病毒DNA提取试剂盒中的说明书提取血清样品中DNA,提取的病毒核酸样品放于-20℃保存备用。
1.2.3 引物合成PCV-2的PCR检测方法按连慧香等[9]方法进行。引物序列:PCV-2-F:CCGCGGGCTGGCTGAACTT,PCV-2-R:ACCCCCGCCACCGCTACC。引物交由广州华大基因科技有限公司合成。
1.2.4 PCR扩增以PCV-2引物序列对298份血清进行PCR扩增。PCR的反应体系为:样品DNA模板3μL,2×Es-TaqMasterMix13μL,上游引物、下游引物各1μL(引物浓度25pmol/μL),ddH2O7μL,总反应体系共25μL。PCR的反应程序为预变性温度95℃,预变性时间5min;同一温度下变性1min;退火温度55℃,退火时间1min;延伸温度72℃延伸时间1min30s;30~35个循环后,需72℃再延伸10min,目的片段大小为1154bp。使用1.5%~2.0%的琼脂糖凝胶对PCR扩增产物做电泳检测,电泳时间25~30min,使用凝胶成像仪观察试验结果。
1.2.5 数据统计分析用Excel软件对PCV-2的抗体和病原结果进行统计分析。
2 结果
2.1 PCV-2抗体检测结果
通过对298份猪血清样品检测PCV-2抗体,抗体的阳性率为89.93%(268/298),PCV-2抗体的检测结果达到群体免疫合格率(70%以上)。其中保育猪的阳性率为90.43(104/115),育肥猪的阳性率为89.61%(164/183)。
2.2 PCR扩增结果
对298份血清样品和阳性样品同时进行PCR检测。结果显示阳性样品的片段为1154bp,血清样品与阳性结果一致则说明PCV-2病原阳性,血清样品无条带则说明PCV-2阴性(图1)。病原检测298份血清样品中,21份病原阳性,277份病原阴性。
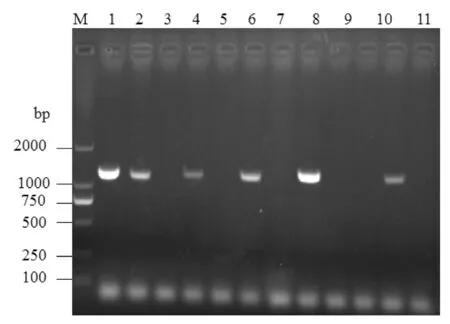
图1 部分样品中PCV-2扩增电泳结果
2.3 结果统计分析
抗体检测298份血清样品中,268份PCV-2抗体阳性,30份PCV-2抗体阴性。病原检测298份血清样品中,21份病原阳性,277份病原阴性。30份PCV-2抗体阴性中圆环病毒阳性率为43.33%(13/30);268份PCV-2抗体阳性中圆环病毒阳性率为2.99%(8/268);268份抗体阳性的平均S/P值为1.417;21份病原阳性的血清抗体阳性的平均S/P值为0.503;8份病原阳性且抗体阳性的血清样品平均S/P值为1.041;13份病原阳性且抗体阴性的血清样品平均S/P值为0.222,说明当PCV-2抗体阴性时圆环病毒阳性率更高。猪血清中病原含量与抗体水平之间呈现不同的相关性。
3 讨论
本试验采用韩国JBT公司生产的试剂盒,检测样品为血清,298份猪血清PCV-2抗体的S/P都小于1.8,268份抗体阳性的平均S/P值为1.417,21份病原阳性的血清抗体阳性的平均S/P值为0.503,说明当PCV-2抗体阴性时圆环病毒阳性率更高。通过查阅相关资料,发现这与孙华伟等[10]人的研究有出入。分析原因:本猪场的猪疫苗免疫时间已久,未发现PCV-2抗体的S/P高于1.8;PCV-2进入体内后首先在扁桃体和淋巴结中复制,随后通过初级淋巴组织进入全身淋巴组织器官,最后进入全身各组织器官,肺脏是PCV-2侵染的主要靶组织。本试验的样品为血清,血清中的成分易受环境影响,干扰因素比组织样品多;猪群PCV-2感染比例随着年龄增加而升高,因此猪群的年龄与此也有一定关系。因此检测的稳定性需要更多数据支撑。本试验只是初步探讨血清中抗体与病原之间的关系,尚存在很多不足。试验说明仅仅根据抗体检测,还不能准确地判定猪群是否感染了野毒,还有待更深入的研究通过抗体检测判断猪群是否感染了野毒。
自2000年,郎洪武等[11]初次分离出PCV-2,目前,我国多地均有PCV-2感染情况的报道[12-16]。PCV-2不仅在猪群分离到,在人、牛、啮齿动物等以及水、空气、人用疫苗中都发现有PCV-2这为PCV-2的防控带来严峻的考验[17]。PCV-2对外界抵抗力极强,可与其他病毒发生混合感染,如:猪繁殖与呼吸综合征病毒、猪瘟病毒、猪细小病毒等病原,从而诱发其他疾病发生,导致猪只死亡率明显升高,最终给养猪业造成巨大的经济损失。潘奕凡等[18]人研究发现增加免疫频次可以提高猪的抗体水平,增强对PCV-2的抵抗力,达到降低PCV-2病原阳性率,目前兽医临床上除猪伪狂犬病病毒 gpI 抗体(野毒)检测试剂盒外,其余抗体检测试剂盒均不能区分检测到的抗体来是疫苗免疫还是野毒感染。由本试验可知,无论猪群的疫苗免疫接种是否合格,猪群都有可能感染圆环病毒2型。临床上不仅需要检测猪群的抗体水平,同时应该检测其病原,将携带有病毒的猪群进行有效的淘汰和净化,对抗体检测为阴性的猪群进行强化免疫。本试验通过检测抗体与病原,揭示其之间的相关性,为该病的诊断提供参考。

