肥大细胞在肿瘤发生发展中的作用
张 娜, 徐天瑞, 安 输
(昆明理工大学生命科学与技术学院,云南省高校靶点药物筛选与利用重点实验室, 昆明 650500)
肥大细胞是Paul Ehrlich于1878年首次发现[1]。肥大细胞来源于骨髓造血干细胞,骨髓肥大细胞祖细胞迁移至周围结缔组织和粘膜上分化成熟并驻留。干细胞因子(stem cell factor, SCF)又称肥大细胞因子,及其受体CD117/c-Kit在肥大细胞成熟过程中发挥重要作用。体外研究表明,单独使用干细胞因子可促进鼠骨髓来源肥大细胞(bone marrow mast cell,BMMC)的发育。干细胞因子和白介素3(interleukin-3,IL-3)联用可促进肥大细胞膜上IgE高亲和受体FcεRI的表达和胞内嗜碱性颗粒的形成[2]。体内研究表明,当在小鼠体内突变c-Kit或SCF基因,致使c-Kit和SCF不能正常表达,则该种小鼠的肥大细胞缺失。成熟的肥大细胞表达多种细胞表面受体,除了c-Kit和FcεRI受体外,还表达细胞因子和趋化因子受体,Toll样受体(Toll-like receptor, TLR)和血管内皮生长因子(vascular endothelial growth factor,VEGF)受体,它们可通过调节肥大细胞的增殖、迁移和活化而影响肥大细胞在不同疾病发生中的作用[3]。肥大细胞分布较为广泛,但主要分布于机体与外界环境相接触的地方例如皮肤、呼吸道粘膜和胃肠道粘膜,所以其在天然免疫和适应性免疫过程中均发挥重要作用[4]。作为诱发过敏反应的最直接效应细胞,肥大细胞在过敏反应特别是速发型过敏反应中的作用被研究最为透彻。肥大细胞是连接过敏反应致敏阶段与效应阶段的枢纽细胞[5]。过敏机体内存在大量的过敏原特异性抗体IgE。IgE可与肥大细胞膜上其高亲和受体 FcεRI 形成稳定的 IgE-FcεRI 复合体。外界过敏原蛋白质可通过铰链相邻的 IgE-FcεRI 复合体活化下游信号通路,产生级联反应而活化肥大细胞,引起肥大细胞脱颗粒[6],并释放众多生物活性物质包括组胺、各种蛋白酶、白三烯和前列腺素等,从而引起过敏反应的发生[7]。
肥大细胞胞质内含有大量的嗜碱性颗粒,这也是肥大细胞最主要的结构特征。嗜碱性颗粒内又富含种类繁多的生物活性物质,主要包括组胺、白三烯、肝素、类胰蛋白酶(tryptase)、类糜蛋白酶(chymase)和β-氨基己糖苷酶(β-hexosaminidase),以及各种炎症因子,例如各类白细胞介素和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等、各种生长因子例如VEGF、成纤维细胞生长因子(fibroblast growth factor, FGF)、神经生长因子(nerve growth factor, NGF)和粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor, GM-CSF)等和趋化因子(chemokine)例如趋化因子C-C基序配体(chemokine C-C motif ligand,CCL)和趋化因子C-X-C基序配体(chemokine C-X-C motif ligand,CXCL)等[8]。其中,大部分生物活性物质可直接或间接诱发过敏反应的发生。同时,因肥大细胞膜上表达众多受体和胞内嗜碱性颗粒内生物活性物质种类繁多,这也决定了肥大细胞的功能具有多样性。除了过敏原,肥大细胞还能被各种病原体、药物、重金属和P物质(substance P)所活化。所以,肥大细胞既可参与天然免疫反应,又在适应性免疫应答、抗原递呈和T细胞应答调控等过程中发挥重要作用[2]。此外,因肥大细胞嗜碱性颗粒内的活性物质大多与肿瘤的发生发展密切相关,所以肥大细胞与肿瘤的关系一直是研究的热点。
1 肥大细胞在肿瘤组织的分布及与肿瘤细胞相互作用对其分布的影响
长期低水平的炎症反应是肿瘤的主要特征之一[9],这也暗示着胞内含有大量种类繁多炎症因子的肥大细胞可能参与肿瘤的发生发展。目前,对不同种类肿瘤组织的病理切片研究表明,无论是在肿瘤组织内还是在瘤旁组织,肥大细胞的数量均明显增加,且肥大细胞也是最早被募集至肿瘤组织并对肿瘤发生产生免疫应答的免疫细胞之一。随着肿瘤病理过程的不断发展,肿瘤组织中肥大细胞的数量亦呈增长趋势[10]。目前,已知多种趋化因子和干细胞因子能促进肥大细胞在肿瘤组织的迁移和定位,例如干细胞因子。许多肿瘤细胞亦包括肥大细胞自身均可表达生成干细胞因子,干细胞因子可通过作用于c-Kit 受体而促进肥大细胞向肿瘤组织迁移[11]。迁移至肿瘤组织的肥大细胞活化后可释放VEGF、促血管新生蛋白因子1(angiopoietin 1, Ang 1)及各种趋化因子,例如 CXCL1、CXCL8和CCL2等。多数肿瘤细胞亦可表达并释放上述因子,它们可分别通过作用于肥大细胞上的 VEGFR1/2(VEGF 受体)、Tie2(Ang 1的受体)及各种趋化因子受体,正反馈地进一步促进肥大细胞在肿瘤组织的迁移和定位[12]。此外,肥大细胞分泌的组胺、前列腺素E2(prostaglandin E2,PGE2)和白三烯B4(leukotriene B4,LTB4)也具有类似作用。组胺可调节肥大细胞中TLR的表达和细胞因子的产生,例如组胺可上调肥大细胞中TLR3的表达以及IL-13和肥大细胞蛋白酶 1(mast cell protease 1, MCP-1)的分泌,增强Th2细胞因子例如IL-4、IL-5、IL-10和IL-13的分泌[13],促进了炎症反应,参与了肿瘤的发生发展。
目前,已知数种实体瘤,例如甲状腺癌、胃癌、胰腺癌、膀胱癌和默克细胞癌,它们较差的预后及瘤组织血管密度与瘤组织中的肥大细胞数量密切相关。肥大细胞也是造成多种血液肿瘤,例如不同种类的霍奇金淋巴瘤、非霍奇金淋巴瘤和浆细胞瘤较差预后的主要因素之一[9]。肥大细胞生成并储存大量的基质金属蛋白酶(matrix metalloproteinase, MMP)例如MMP-2和MMP-9及两类活性较强的丝氨酸蛋白酶-类胰蛋白酶和类糜蛋白酶,它们可有效水解胞外基质(extracellular matrix, ECM)和内皮细胞基底膜的各种组分,例如各型胶原蛋白质和纤粘蛋白,实现对肿瘤组织及其微环境的重构,从而有助于肿瘤细胞的侵袭和转移[14]。此外,类胰蛋白酶和类糜蛋白酶可通过水解胞外基质,有助于释放各种与胞外基质相结合的生长因子,从而促进肿瘤生长和新生血管的形成[15](Fig.1)。
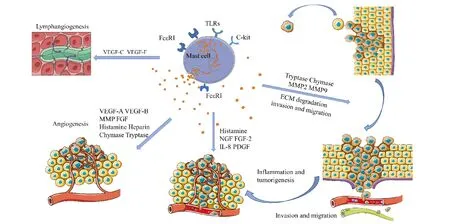
Fig.1 The role of mast cells in the occurrence and development of tumors FcεRⅠ, c-Kit and Toll-like receptor play a key role in the maturation and activation of mast cells. Activated mast cells produce proteases including chymase and tryptase to activate latent matrix metalloproteinases (MMPs) which degrade the extracellular matrix (ECM) and promote the migration and invasion of cancer cells. Mast cells also release several inflammatory factors such as IL-8, and pro-angiogenic factors like vascular endothelial growth factor (VEGF)-A and VEGF-B that induce angiogenesis in the milieu of tumors. Additionally, mast cells can produce lymphangiogenic factors such as VEGF-C and VEGF-F which contribute to lymphomagenesis
2 肥大细胞在肿瘤发生发展中的作用
正如前文所述,因肥大细胞与肿瘤细胞的相互作用,大量肥大细胞被募集至肿瘤组织并被激活,从而在肿瘤组织中释放大量组胺、VEGF、FGF、MMP、类胰蛋白酶和类糜蛋白酶等生物活性物质。其中,组胺可促进肿瘤细胞的增殖、迁移和侵袭,而VEGF、FGF、MMP、类胰蛋白酶和类糜蛋白酶又是促肿瘤血管生成的重要因子。
2.1 肥大细胞促进肿瘤生长
目前,已知肥大细胞所释放的促肿瘤生长活性物质主要有组胺、NGF、FGF-2、IL-8和血小板源生长因子(platelet-derived growth factor, PDGF)(Fig.1)。组胺是肥大细胞释放并诱发过敏反应的重要物质,其通过作用于组胺受体在诸多生理病理过程中发挥重要作用。组胺受体属于G-蛋白偶联受体,其共有4个亚型,分别为H1R、H2R、H3R和H4R。通过放射免疫检测发现,组胺在结直肠癌、乳腺癌、子宫内膜癌、黑色素瘤和非小细胞肺癌(non-small-cell lung cancer, NSCLC)组织中呈高水平状态。同时,组胺在乳腺癌、前列腺癌和肺癌患者血液中的水平亦显著高于健康组[16]。
研究结果表明,组胺对肿瘤生长的影响较为复杂,主要影响因素包括组胺浓度、肿瘤类型及肿瘤细胞所表达组胺受体的亚型。例如,组胺浓度低于10 nmol/L时可促进前列腺癌细胞的增殖。当组胺浓度达到10 μmol/L时,则可抑制前列腺癌细胞增殖[16]。H1R和H2R的主要功能为发挥组胺的促血管生成作用,同时组胺亦可通过H1R促进肿瘤细胞增殖,通过H2R抑制免疫反应。而H3R和H4R,特别是H4R,是肿瘤组织和肿瘤细胞上的主要组胺受体,它们可通过调控代谢途径而促进肿瘤生长[17]。所以,组胺受体成了抗肿瘤药物新的重要靶点。许多组胺受体拮抗剂或激动剂显示出较好的抗肿瘤效果,例如H4R的激动剂氯苯丙酸(clobenpropit)可显著抑制结直肠癌的生长,抑制前列腺癌和胆管癌细胞的增殖、迁移、侵袭和上皮间质转化(epithelial-mesenchymal transition, EMT)[17]。H1R的拮抗剂阿司咪唑(astemizole)可诱导乳腺癌细胞的自噬和凋亡[18]。阿司咪唑与另一种H1R拮抗剂氯雷他定(loratadine)联用则可增强表皮生长因子受体(epidermal growth factor receptor, EGFR)靶向药物吉非替尼(gefitinib)对非小细胞肺癌的敏感性,并逆转非小细胞肺癌对EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)的耐药性[19]。
2.2 肥大细胞对肿瘤血管生成的促进作用
血管生成是一个由内皮细胞介导的促血管生成因子和抗血管生成因子相互平衡的动态过程,涉及细胞外基质蛋白质、粘附分子和蛋白水解酶的参与。一旦促血管生成因子和抗血管生成因子之间的相互平衡被打破,血管就会向着病理性的方向生长。在癌症发展过程中,肿瘤血管生成是促进肿瘤生长、侵袭和转移的主要因素,借此可为肿瘤的快速生长提供所需氧气和营养物质。肥大细胞促进肿瘤血管新生主要依赖于其所释放的众多促血管生成因子。肥大细胞表达释放的能促进肿瘤血管生成的活性物质有VEGF-A和VEGF-B、FGF、组胺、肝素、MMP、类胰蛋白酶和类糜蛋白酶等。VEGF家族另外两类成员VEGF-C和VEGF-F是活性较强的促淋巴管生成因子(Fig.1)。
有研究在通过基因编辑造成肥大细胞功能缺陷的小鼠皮下接种黑色素瘤细胞,发现所接种瘤细胞增殖较慢,瘤组织中血管密度较少。此外,该种小鼠也不易发生黑色素瘤的肺转移。如果对该肥大细胞功能缺陷小鼠移植正常小鼠骨髓,则其接种瘤可恢复正常增殖速度,接种瘤血管密度趋于正常,并可发生肺转移[20]。该研究充分表明,肥大细胞可促进黑色素瘤的生长及其新生血管的形成。鸡胚绒毛尿囊膜(chick embryo chorioallantoic membrane, CAM)血管生成研究显示,如果用VEGF和FGF抗体预处理活化的肥大细胞上清,将显著抑制肥大细胞所诱导的鸡胚绒毛尿囊膜的血管生成[21]。组胺和肝素促进肿瘤血管生成的作用主要表现为:它们不仅能促进内皮细胞增殖、迁移和分化,而且还能增强肿瘤细胞和内皮细胞间的黏附[22]。
类胰蛋白酶和类糜蛋白酶是肥大细胞活化时所释放的主要丝氨酸蛋白酶,它们亦在肿瘤血管生成过程中发挥重要作用。它们均能有效水解肿瘤细胞胞外基质组分,为肿瘤血管生长提供足够空间,同时释放储存于基质中血管生长因子,例如VEGF和FGF-2,从而促进肿瘤血管的生成[23]。MMP与类胰蛋白酶和类糜蛋白酶的功能类似,可以有效水解肿瘤细胞胞外基质,为肿瘤细胞生长和新生血管的形成提供适宜的肿瘤微环境。
2.2.1 类胰蛋白酶对肿瘤血管生成的促进作用 多个研究发现,类胰蛋白酶阳性肥大细胞的数量在多种实体瘤组织中显著增加,这些实体瘤包括黑色素瘤、子宫内膜癌、乳腺癌、胃癌和结直肠癌等[24]。当把肥大细胞和皮肤微血管内皮细胞共培养时,可促进后者血管网状结构的形成,而当肥大细胞处于脱颗粒状态时,这种促进血管网状结构形成的作用更加明显。进一步研究发现,如果直接用类胰蛋白酶刺激血管内皮细胞,内皮细胞形成血管网状结构的速度明显增加,并呈剂量依赖方式。而类胰蛋白酶抑制剂则可显著抑制血管网状结构的形成,抑制率可达73%至88%。
类胰蛋白酶可通过水解和活化其底物而促进血管生成,如类胰蛋白酶可水解血纤维蛋白溶酶原,及胶原酶和基质金属蛋白酶前体,进而活化这3种酶而发挥间接水解胞外基质和促进血管生成的作用(Fig.2)。值得注意的是,类胰蛋白酶可通过直接水解并活化蛋白酶激活受体-2(protease activated receptor-2, PAR-2)而促进血管内皮细胞增殖。活化的PAR-2又可促进IL-6和GM-CSF的表达和释放,而IL-6和GM-SCF又是已知较强的促血管生成因子[25]。当前多个研究结果表明,血清类胰蛋白酶水平是判断多种肿瘤恶性程度和肿瘤患者预后的重要指标。例如,结直肠癌和乳腺癌患者血清类胰蛋白酶浓度明显高于正常水平,而术后血清类胰蛋白酶浓度则显著下降[26]。由此可见,类胰蛋白酶确实可促进肿瘤血管生成和肿瘤的发生发展。所以,许多类胰蛋白酶抑制剂表现出较好抗肿瘤和抗肿瘤血管生成活性[24]。

Fig.2 Tryptase and chymase can act directly and indirectly to induce tumor angiogenesis Tryptase acts on a variety of substrates, such as degradation of extracellular matrix, plasminogen activation, fibrinogen degradation, activation of latent collagenase, MMP and PAR2. Chymase converts Angiotensin Ⅰ to Angiotensin Ⅱ, triggers VEGF-induced angiogenesis. Chymase also can cleave pro-MMP-9 to produce active MMP-9. These substrates are known to be key factors in angiogenesis
2.2.2 类糜蛋白酶在肿瘤血管生成中的促进作用 类糜蛋白酶也是一种肥大细胞特异性丝氨酸蛋白酶,它可以特异性地水解芳香族氨基酸后面的肽键。目前,已知血管紧张素I(angiotensin I)是类糜蛋白酶最为重要的底物之一,其可将血管紧张素I水解并转变为血管紧张素II,而后者具有非常强的促血管生成活性(Fig.2)。有研究利用海绵移植血管生成模型,并在海绵内直接注射类糜蛋白酶。研究结果发现,海绵内肉芽肿组织中的血红蛋白量明显增加,说明类糜蛋白酶可促进血管的生成。此外,已知碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)亦可刺激海绵内肉芽肿组织中血管的生成,同时类糜蛋白酶、血管紧张素II和VEGF在肉芽组织中的表达量也明显增加。当加入类糜蛋白酶抑制剂或血管紧张素II受体拮抗剂时,则可完全抑制血管的生成[27]。据此可推测,类糜蛋白酶-血管紧张素II-VEGF通路是肥大细胞促进血管生成的一条主要途径(Fig.2)。
最近有研究者观察发现,小肠癌发展不同阶段与病变组织中肥大细胞类型及其所表达蛋白酶相关。在小肠癌变之前的炎症或息肉组织中,存在大量粘膜肥大细胞,该肥大细胞表达的蛋白酶主要为类糜蛋白酶MCP2(mast cell protease 2)。当息肉转变为腺癌时,腺癌组织中有大量的结缔组织肥大细胞浸润,该型肥大细胞所表达的蛋白酶主要为类胰蛋白酶MCP5和MCP6。当在肥大细胞中敲除MCP6,则可抑制小肠肿瘤生长[28]。因此,肥大细胞所表达的类糜蛋白酶和类胰蛋白酶可分别在肠癌发生的初期和快速生长期发挥重要作用。利用小鼠模型研究皮肤异常增生和恶变发现,肥大细胞另一类糜蛋白酶MCP4,可通过水解并活化MMP9前体蛋白质,而间接促进皮肤增生组织血管生成[23]。
3 肥大细胞在肿瘤免疫耐受中的作用及肿瘤微环境对肥大细胞活化的影响
肥大细胞在机体对肿瘤产生免疫耐受过程中亦发挥重要作用。肥大细胞因能表达并释放免疫抑制因子IL-10,而发挥免疫抑制作用,同时其还能影响调节性T细胞(Treg, regulatory T cell)的功能而促进免疫耐受的发生[29]。Treg是一类控制体内自身免疫反应的 T 细胞亚群。肿瘤组织中的肥大细胞,其免疫活化因子IL-2表达量明显降低,而免疫抑制因子IL-10、TGF-β及转录因子Foxp3 的表达量显著增加。TGF-β可通过诱导Foxp3表达而促进CD4+CD25-T细胞向 CD4+CD25+Treg细胞转变,从而提高肿瘤组织中的Treg细胞数量,有助于机体对肿瘤组织免疫耐受的产生和肿瘤组织逃避机体的免疫监视[30]。
肿瘤微环境(tumor microenvironment, TME)是诱发肿瘤发生发展的重要因素, 其主要有脉管系统,肿瘤相关成纤维细胞(carcinoma-associated fibroblasts, CAF),胞外基质和浸润的免疫细胞等组成,其对肥大细胞成熟和活化有着重要的调控作用。正如前文所述,肿瘤细胞可生成并释放大量干细胞因子和趋化因子,例如CCL2、CXCL1和CXCL10等至肿瘤微环境,这些趋化因子和干细胞因子对募集肥大细胞至肿瘤微环境具有较强的趋化作用。而活化的肥大细胞亦可表达并释放上述趋化因子和干细胞因子,从而可正反馈地促进肥大细胞向肿瘤微环境迁移和定位。此外,肿瘤微环境富含各种活性介质,包括上述干细胞因子和趋化因子及VEGF、Ang 1和骨桥蛋白等。它们除了能活化肥大细胞外,还具有募集肥大细胞至肿瘤微环境和刺激肥大细胞成熟的功能[1]。
缺氧是肿瘤微环境的一个主要特征。在此条件下,可提高缺氧诱导因子-1(hypoxia inducible factor-1, HIF-1)在肥大细胞中的表达,而HIF-1又可活化肥大细胞。此外,腺苷和PGE2水平在缺氧的肿瘤微环境中明显升高,腺苷可通过其受体活化肥大细胞并释放前炎症因子,而PGE2可促进肥大细胞表达和释放活性介质,例如IL-6、VEGF和CCL2等[1]。所以,肿瘤微环境中的活性介质及缺氧对肥大细胞在肿瘤微环境中的聚集、成熟和活化具有重要的调控作用。
4 问题与展望
肥大细胞是人体的主要免疫细胞之一,其主要生理特征为胞内含有大量嗜碱性颗粒,该颗粒又富含种类繁多且具有较强生物活性的组分。这些肥大细胞在肿瘤组织中呈高聚集态势,它们通过释放颗粒内活性物质而促进肿瘤生长、肿瘤血管的生成及肿瘤转移。鉴于肥大细胞在肿瘤发生发展中的重要作用,那些通过作用于肥大细胞或其重要组分,本用于治疗过敏性疾病的药物,它们的抗肿瘤活性正日益受到重视。例如,c-Kit受体酪氨酸激酶抑制剂马赛替尼(masitinib)可抑制肥大细胞活化,释放炎症介质,又表现出较好的抗肿瘤活性。当前,正在检测其在治疗肥大细胞增生症、胃肠道间质瘤、前列腺癌和胰腺癌等肿瘤的临床疗效。
但当前也有部分研究结果显示,肥大细胞对肿瘤发生发展无影响或具有抑制作用,这主要因肥大细胞除了表达释放促肿瘤细胞增殖和肿瘤血管生长因子外,还能表达释放肿瘤抑制因子,例如TNF-α和IL-9。这反映了肥大细胞的功能多样性,也反映了肥大细胞对肿瘤发生发展影响的复杂性,其中许多影响机制尚未被完全认识。对肥大细胞影响肿瘤发生发展作用机制的深入研究,将会为肿瘤的治疗和预后情况判断提供理论依据和潜在治疗靶标。

