耐高温萌发菌胞外酶活性与天麻种子萌发的关系
赵芳娟 邓百万 解修超 常宁 宁静 杨学英



摘要:为探究耐高温萌发菌在模擬夏季高温条件下漆酶、木聚糖酶、淀粉酶和纤维素酶的活性与天麻种子萌发的关系。对4株萌发菌进行递增式耐高温驯化,采用2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS)法、二硝基水杨酸(DNS)法测定萌发菌胞外酶活性,水琼脂法进行天麻种子萌发试验。结果表明,各菌株之间的酶活性及各菌株之间天麻种子萌发率存在明显差异,经过驯化的耐高温萌发菌4种酶活性和天麻种子萌发率均极显著高于各自对应亲本萌发菌(P<0.01),其中漆酶、木聚糖酶、淀粉酶、纤维素酶活性最高的分别是耐高温萌发菌SH-1、MDA-1、MDC-1、SH-1,酶活性依次为1 000.00、1062.35、402.90、40.91 U/L,天麻种子萌发率最高的是耐高温萌发菌SH-1,萌发率为71.76%,酶活性与天麻种子萌发率相关性最高的是木聚糖酶,相关系数为0.720。说明天麻种子萌发受温度、胞外酶种类及活性等多种因素共同调控,耐高温萌发菌表现出了更高的酶活性,促进天麻种子萌发,且木聚糖酶是影响天麻种子萌发的关键胞外酶。
关键词:小菇属萌发菌;耐高温;胞外酶;天麻种子;萌发率
中图分类号:S567.23+9.01;S182 文献标志码: A
文章编号:1002-1302(2022)04-0205-06
收稿日期:2021-10-11
基金项目:陕西省科技统筹创新工程计划(编号:2015QTGC-033)。
作者简介:赵芳娟(1995—),女,陕西咸阳人,硕士研究生,主要从事微生物资源保育与开发研究。E-mail:975218223@qq.com。
通信作者:邓百万,硕士,教授,主要从事微生物资源保护与开发利用研究。E-mail:2210309868@qq.com
天麻(Gastrodia elata Bl.),多年生草本,是以无性繁殖和有性繁殖交替进行的无根无绿色叶片的异养型植物,有性繁殖需与紫萁小菇等天麻种子萌发菌共生萌发[1-2],具有镇静、抗惊厥、降血压等功效[3]。萌发菌为担子菌纲(Basidiomycetes)小菇属(Mycena)真菌,和蜜环菌均为天麻生长过程中的必要共生菌[4-5]。相较于蜜环菌而言,关于天麻萌发菌的研究较少,目前对萌发菌的研究都集中在采集、分离、筛选、复壮、培养条件和生物学特性等方面,例如,对萌发菌菌种制作和遗传多样性研究[6-7]、天麻种子萌发中的基因表达变化和胁迫条件影响天麻种子萌发率研究[8-9]以及萌发菌原生质体的制备[10],也有学者们对萌发菌化学成分进行研究[11]。
萌发菌品质直接影响天麻种子的萌发率,而高温也是影响种子萌发的重要因素之一,且当外界温度高于30℃时,菌丝失去活力甚至死亡[11]。由于受种子成熟时间的限制,天麻种子萌发时间为6—7月,而天麻主产区汉中夏季高温现象频繁出现,高于30 ℃的天气可长达十几天。所以,耐高温萌发菌对实现天麻种子高温条件下萌发至关重要。萌发菌广泛分布于各地,主要生长于温带和寒温带较为潮湿的枯枝烂叶上,因此,萌发菌对包括温度在内的环境因子具有很广泛的适应性。大型真菌分泌胞外酶可以直接影响真菌对于营养物质的利用情况,其活性与温度等环境生长因子密切相关,其胞外酶种类及活性也与真菌的种类有关[12]。萌发菌胞外酶对植物细胞壁的降解能力以及植物的生长发育起着至关重要的作用,也与天麻种子萌发密切相关。徐锦堂等的研究表明,天麻种子萌发的直接营养来源是萌发菌,不同产地的萌发菌对天麻种子萌发率的影响不同[13],预示着萌发菌胞外酶种类、活性及温度对其生长及天麻种子萌发有很大影响。因此,研究萌发菌胞外酶活性对温度的响应对于萌发菌的生长发育和天麻种子萌发具有重要的指导意义,以期为天麻产业发展提供参考。
1 材料与方法
1.1 供试菌株
试验所用萌发菌均为陕西省食药用菌工程技术研究中心保藏菌株,分别为MDC、MDA、8C、SH,将驯化得到的耐高温萌发菌MDC、MDA、8C、SH依次命名为MDC-1、MDA-1、8C-1、SH-1,所用天麻种子为汉中产区2021年5月收获的新鲜红杆天麻种子。
1.2 供试培养基
固体培养基为PDA培养基:马铃薯(去皮) 200 g,葡糖糖20 g,蛋白胨5 g,磷酸二氢钾5 g,硫酸镁3 g,琼脂粉16 g,水1 000 mL,pH值自然。
水琼脂培养基:琼脂粉16 g,水1 000 mL,pH值自然。
1.3 试验药品
3,5-二硝基水杨酸、羧甲基纤维素钠、酒石酸钾钠购自生工生物工程(上海)股份有限公司;木聚糖购自上海源叶生物科技有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS)购自Sigma公司;苯酚购自天津市大茂化学试剂厂;过硫酸钾购自天津市天力化学试剂有限公司,以上试剂均为分析纯。
1.4 仪器与设备
单人超净工作台(ZHJH-C111213)购自苏州净化设备仪器有限公司;高压灭菌锅(LDZX-75KBS)购自上海博迅医疗生物仪器股份有限公司;紫外分光光度计(UV2550)购自日本岛津公司;超声波清洗器(KQ5200DE)购自昆山市超声仪器有限公司。
1.5 试验时间与地点
耐高温萌发菌递增式驯化试验于2019年6月至2021年4月进行,天麻种子萌发试验于2021年6—8月进行,胞外酶活性测定试验在2021年7月进行,以上试验地点均在陕西省汉中市汉台区东一环路陕西省食药用菌工程技术研究中心(陕西理工大学生物科学与工程学院)。
1.6 试验设计
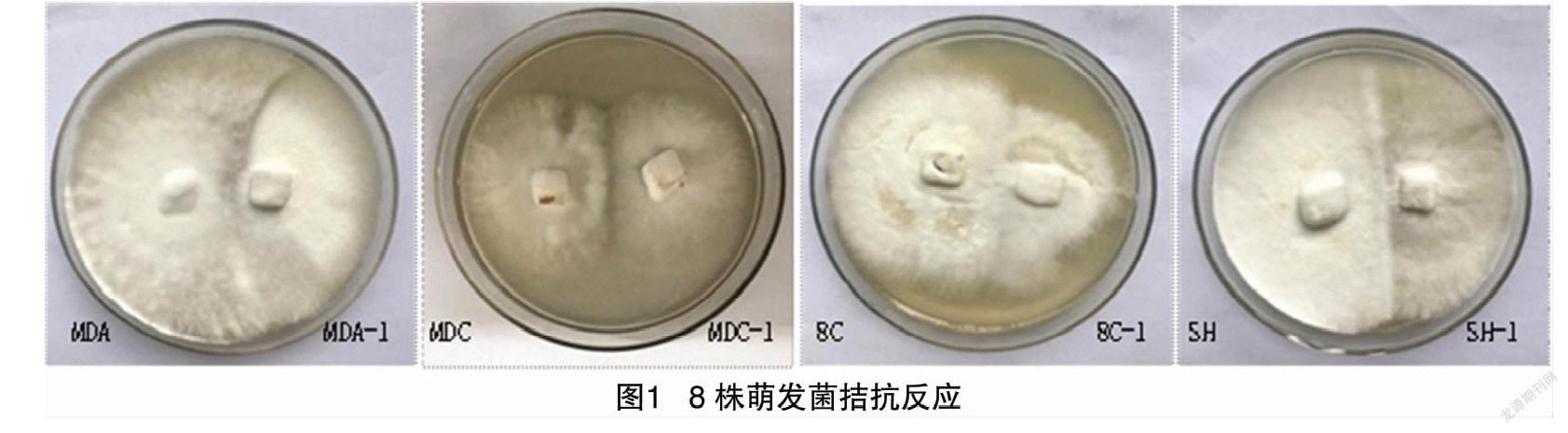
1.6.1 耐高温萌发菌递增式驯化 本试验参考马慧颖等的递进式循环耐高温驯化方法[14-15],略有改动,使萌发菌菌丝逐步适应高温环境,进行耐高温驯化。将实验室4 ℃保存的菌株从试管接至平板培养基,在24 ℃下暗培养10 d后转板,再进行菌丝活化。活化后的菌丝进行耐高温递增式驯化,以24.0、26.0、28.0、30.0、30.5、31.0、31.5、32.0、32.5、33.0、33.5、34.0 ℃递增梯度逐渐减缓的方式进行驯化,得到4株可以在34 ℃生存的耐高温萌发菌。将驯化得到的耐高温萌发菌与亲本进行两两接触试验,观察是否有拮抗现象。
1.6.2 胞外酶活性测定
1.6.2.1 粗酶液的制備 将驯化的耐高温萌发菌与亲本接在平板培养基上,模拟夏季高温昼夜温度,为防止未驯化萌发菌在34 ℃时发生烧菌死菌现象,且30 ℃为萌发菌的胁迫温度[11],因此培养箱温度设置为25 ℃与30 ℃各8 h循环,共22个循环,约 15 d。取菌丝下培养基1 g于研钵中,加5 mL去离子水,研磨1 min,吸取2 mL研磨液于2 mL离心管中,离心(8 000 r/min,3 min)得到上清液即为粗酶液。取上清液1 mL于10 mL试管中并定容至 10 mL,用于后续试验。
1.6.2.2 胞外酶活性测定 依据文献方法设置漆酶活性反应体系[16-18],略有调整:1 mL粗酶液加入 2 mL ABTS溶液,40 ℃水浴预热反应3 min,取出立即补足10 mL,用分光光度计记录3 min内421 nm处吸光度的变化。以沸水浴灭活的粗酶液为对照,做3组重复。1 min内转化1 μmol底物定义为1个酶活单位,U。酶活性以X表示,U/L。
木聚糖酶、纤维素酶、淀粉酶活性用二硝基水杨酸(DNS)法测定[17],略有调整。木聚糖酶、纤维素酶、淀粉酶活性DNS用量分别改为1、1、1.5 mL。1 min 生成1 μmoL木糖或葡萄糖所需要的酶量定义为1个酶活单位,U。酶活性以X表示,U/L。
1.6.3 标准曲线的绘制 依据DNS法测定葡萄糖标准曲线,为y=1.652 3x-0.033 6 (r2=0.991 8),用于淀粉酶及纤维素酶活性的测定,木糖标准曲线为y=0.246 2x-0.031 9 (r2=0.997 5),用于木聚糖酶活性的测定。
1.6.4 酶活性计算方法 木聚糖酶从木糖标准曲线上查出相应的木糖含量折算成酶活单位(U/L),纤维素酶和淀粉酶从葡萄糖标准曲线上查出相应的葡萄糖含量折算成酶活单位(U/L)[18]。
木聚糖酶、纤维素酶和淀粉酶活性:X=m·n/(M·V酶·t);漆酶活性:X=106·V总·ΔD421 nm/(ε·V酶·Δt)。
式中:m指根据标准曲线方程代入D值计算对应葡萄糖或木糖的质量,mg;M指木糖或葡萄糖的摩尔质量;V酶指反应添加的酶液体积,L;V总指反应总体积,L;t指酯反应时间,min;n指酶液稀释倍数;ΔD421 nm为漆酶吸光度;Δt指时间,本试验为3 min;ε为消光系数,36 000 L/(mol·cm)。
1.6.5 天麻种子萌发研究
1.6.5.1 天麻种子预处理 去除天麻蒴果残留杂质,流水冲洗后用滤纸吸干表面水分。后续操作在无菌操作台进行,将天麻硕果置于0.1%氯化汞溶液中8 min,无菌水冲洗掉表面残留氯化汞;再置于10%双氧水中2 min,捞出无菌水冲洗掉表面残留双氧水;再将其放入75%乙醇中40 s,捞出无菌水冲洗掉表面残留乙醇,用无菌滤纸吸干表面水分,将种子撒到灭菌的培养皿中,封好4 ℃保存备用。
1.6.5.2 天麻种子活力及萌发率的测定 10 mL试管依次加入天麻种子与配制的1%红四氮唑溶液,混匀,放置于无光的30 ℃恒温箱内,48 h后用电子显微镜观察天麻种子染色情况。种子被染成鲜红色或粉红色,则证明种子有活力;未被染成红色,则证明种子无活力[19]。
取备用的天麻种子,用灭过菌的散粉刷蘸取适量天麻种子,轻轻抖落在水琼脂培养基上,将驯化后的耐高温萌发菌及亲本萌发菌接种于水琼脂培养基中央,每株菌做6组重复。将其置于25 ℃与30 ℃各8 h循环的恒温箱中暗培养观察,统计其萌发率。
1.6.6 数据处理 酶活性及天麻种子萌发率作图及相关数据分析采用Excel 2010 软件进行,用SPSS 26.0 的One-Way ANOVA进行相关数据方差分析,采用SPSS 26.0 的Pearson进行酶活性与天麻种子萌发率的相关性分析。
2 结果与分析
2.1 耐高温萌发菌驯化试验
培养温度为24 ℃时,萌发菌长势旺盛,菌丝洁白,菌落形态规则,无色素产生。但是当培养温度超过 30 ℃ 时,萌发菌生长缓慢,菌丝偶有变黄、稀疏,菌落形状不规则,并有少量色素产生。将驯化得到的耐高温萌发菌与亲本萌发菌在24 ℃下进行两两接触试验,结果如图1所示,萌发菌进行耐高温驯化后与亲本进行两两接触试验皆出现了不同程度的拮抗线。
2.2 天麻种子萌发情况
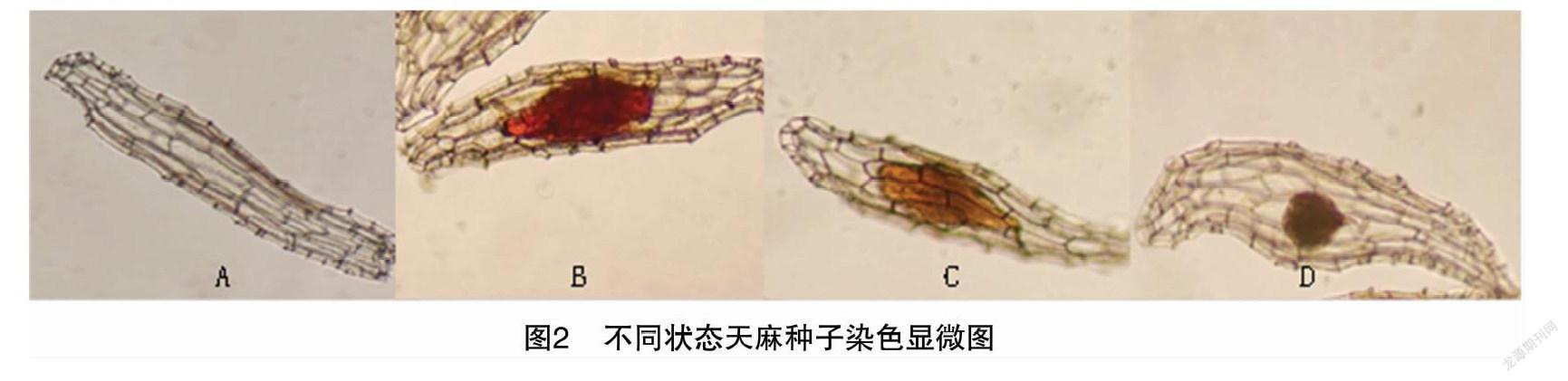
2.2.1 天麻种子活力测定 用电子显微镜观察染色天麻种子,可观察到天麻种子4种不同的状态:无种胚(图2-A);种胚被染成鲜红色,种子有活力(图2-B);种胚被染成黄色,种子无活力(图2-C);异常胚无染色,无活力(图2-D)。种子活力=(种子总数-无种胚种子数-种胚黄色种子数-异常胚种子数)/种子总数×100%。
试验结果统计可得:天麻种子总数为936粒,种胚黄色的种子为7粒,无种胚的种子为21粒,异常胚的种子为4粒。天麻种子活力为96.58%。
2.2.2 天麻种子萌发 肉眼观察到种胚膨大后,每隔5 d用电子解剖镜观察平板上天麻种子萌发情况,可观察到天麻种子从种胚膨大到种子萌发的不同状态:菌丝包裹浸染天麻种子(图3-A)、种胚膨大尚未完全突破种皮(图3-B)、种胚膨大突破种皮(图3-C)、种胚生长即将形成分生原基(图3-D)、种胚出现分生原基(图3-E)、芽体形成(图3-F)。本试验将种胚出现分生原基即视为萌发,统计天麻种子萌发率。天麻种子萌发率=萌发天麻种子/(天麻种子总数×天麻种子活力)。
2.3 萌发菌胞外酶活性与天麻种子萌发
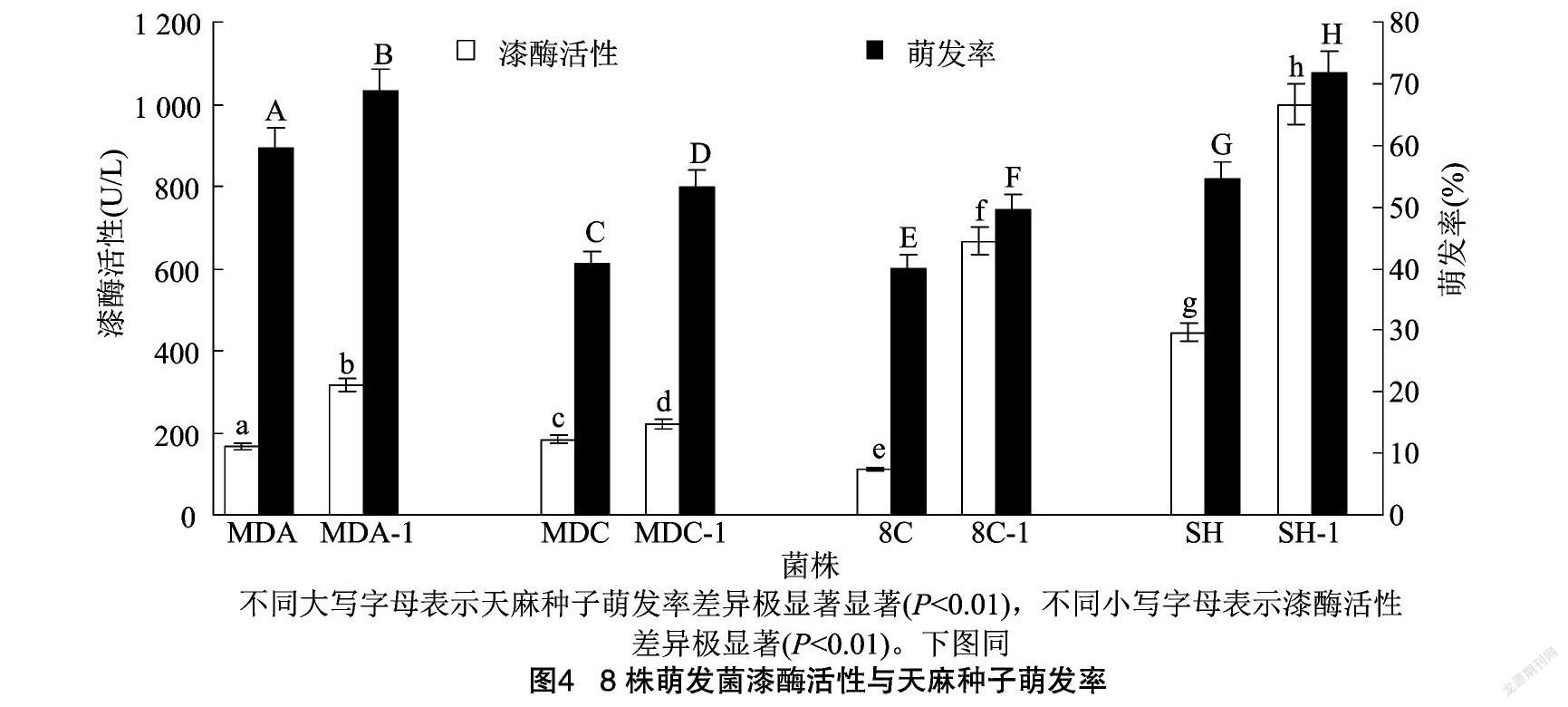
2.3.1 漆酶活性与天麻种子萌发关系 真菌漆酶属于胞外酶,具有降解木质素并为真菌生长发育提供营养的能力,测定漆酶活性的方法较多,目前ABTS法测定漆酶活性是一种较为理想的方法[20]。漆酶活性与天麻种子萌发率的皮尔曼相关系数为0.564,相关性不显著(P=0.146>0.05)。由图4可知,8株萌发菌均表现出不同程度的种子萌发率及漆酶活性。多重比较结果显示,8株萌发菌的漆酶活性及对应天麻种子萌发率均具有极显著差异(P<0.01)。耐高温萌发菌MDA-1、MDC-1、8C-1、SH-1的漆酶活性与其对应的天麻种子萌发率均极显著高于亲本萌发菌,漆酶活性分别高150.00、38.89、555.56、555.56 U/L,萌发率分别高9.09、12.43、9.41、17.19百分点。其中,耐高温萌发菌SH-1的漆酶活性和天麻种子萌发率最好,分别为1 000.00 U/L和71.76%,极显著高于其余菌株的漆酶活性及天麻种子萌发率;耐高温萌发菌MDA-1、MDC-1 与亲本萌发菌MDA、MDC、8C的漆酶活性较小,依次为316.67、222.22、166.67、183.33、111.11 U/L,对应天麻种子萌发率依次为68.82%、53.24%、59.73%、40.81%、40.19%。
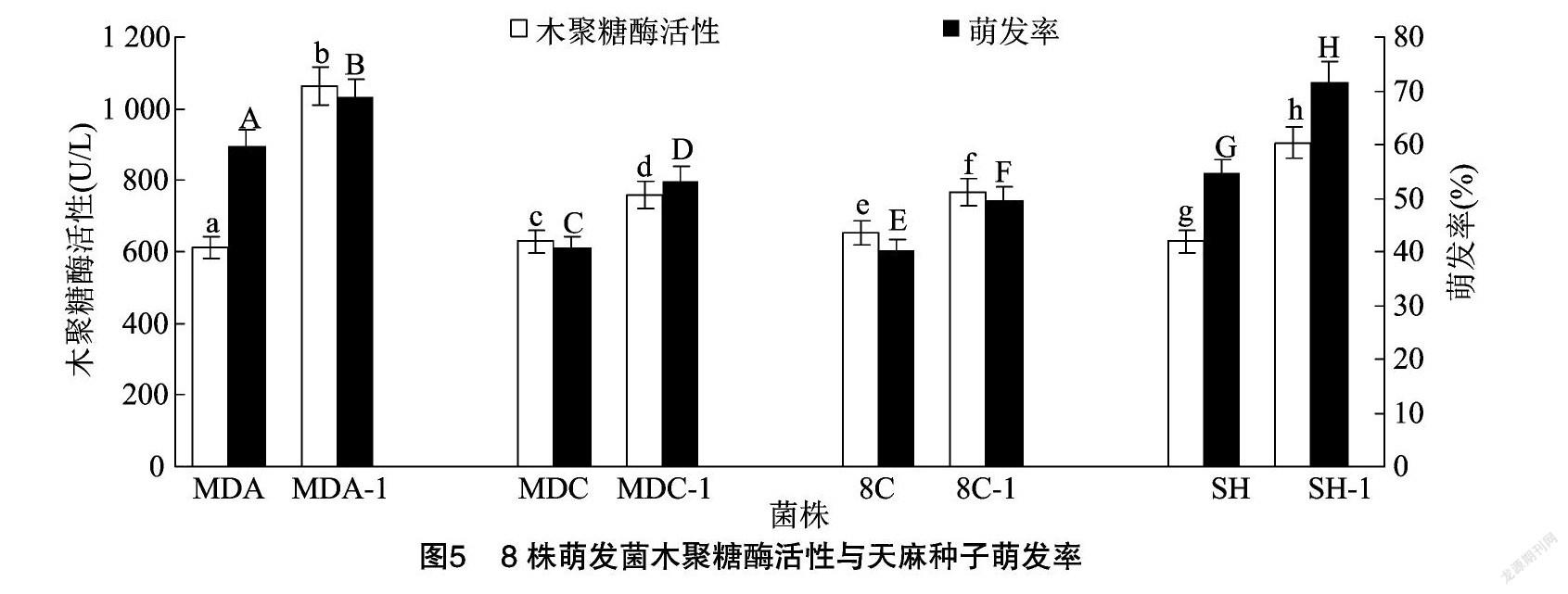
2.3.2 木聚糖酶活性与天麻种子萌发关系 木聚糖广泛存在于植物细胞壁中,就多糖而言其含量仅次于纤维素,是自然界最重要的半纤维素,广义的木聚糖酶是指可以水解半纤维素木聚糖的一组酶的总称[21]。木聚糖酶活性与天麻种子萌发率皮尔曼相关系数为0.720,相关性显著(P=0.044<0.05)。由图5可知,8株萌发菌的木聚糖酶活性各不相同,多重比较结果显示各菌株之间的木聚糖酶活性具有极显著差异,耐高温萌发菌MDA-1、MDC-1、8C-1、SH-1木聚糖酶活性分别极显著高于亲本萌发菌450.91、131.67、114.89、275.96 U/L。其中,耐高温萌发菌 MDA-1木聚糖酶活性最高 (1 062.35 U/L),极显著高于其余菌株,对应的天麻种子萌发率为68.82%;耐高温萌发菌SH-1的木聚糖酶活性次之(905.43 U/L),对应的天麻种子萌发率最高(71.76%)。
2.3.3 淀粉酶活性与天麻种子萌发关系 淀粉酶是一类可以作用于淀粉、多糖衍生物等并把它们分解成小分子的水解酶。淀粉酶活性与天麻种子萌发率皮尔曼相关系数为0.437,相关性不显著(P=0.279>0.05)。由图6可知,8株萌发菌均表现出不同程度的淀粉酶活性,除耐高温萌发菌MDA-1与SH-1外,其余菌株多重比较两两之间均差异极显著。耐高温萌发菌MDA-1、MDC-1、8C-1、SH-1 的淀粉酶活性均极显著高于亲本萌发菌41.88、282.86、112.43、127.65 U/L。其中,耐高温萌发菌MDC-1淀粉酶活性极显著高于耐高温萌发菌SH-1 146.24 U/L,萌发率极显著比耐高温萌发菌SH-1低18.52百分点。
2.3.4 纤维素酶活性与天麻种子萌发关系 纤维素是植物细胞壁的主要构成成分,纤维素酶能够有效降解植物细胞壁。纤维素酶活性与天麻种子萌发率皮尔曼相关系数为0.634,相关性不显著(P=0.092>0.05)。由图7可知,8株萌发菌均表现出不同程度的纤维素酶活性。亲本萌发菌纤维素酶活性相差不大,MDA、MDC、SH之间未达到极显著差异,耐高温萌发菌的纤维素酶活性均极显著高于亲本萌发菌9.30、8.72、4.24、16.34 U/L。耐高温萌发菌SH-1纤维素酶活性最高,为 40.91 U/L,萌发率为71.76%,极显著高于其余菌株;耐高温萌发菌MDA-1、MDC-1的纤维素酶活性次之,分别为34.26、33.65 U/L,萌发率为68.82%、53.24%。
3 结论
驯化后的耐高温萌发菌与亲本萌发菌两两接触均出现拮抗线,可初步判断耐高温菌株与亲本菌株存在差异。在平板上通过25 ℃与30 ℃各8 h循环,对约15 d之后获得的胞外粗酶进行酶活性测定,相同培养条件下进行天麻种子萌发率测定,结果表明,各菌株之间的酶活性及菌株之间天麻种子萌发率存在明显差异,经过驯化的耐高温萌发菌4种酶活性和天麻种子萌發率均显著高于各自对应亲本萌发菌,4种酶活性与天麻种子萌发率相关性从高到低依次为木聚糖酶、纤维素酶、漆酶、淀粉酶。
天麻种子的萌发,需要萌发菌菌丝与种子接触后,侵入皮层细胞壁促进天麻种子萌发形成原球茎,与天麻种子共生萌发。因此,萌发菌细胞壁降解酶的活性也就决定着天麻种子的萌发表现,其中植物细胞壁的重要组成部分为纤维素、半纤维素、果胶。萌发菌水解纤维素的纤维素酶活性最高的是耐高温萌发菌SH-1,为40.91 U/L,其次是耐高温萌发菌MDA-1,为34.26 U/L;水解半纤维素的木聚糖酶活性最高的为耐高温萌发菌 MDA-1,为1 062.35 U/L,其次是耐高温萌发菌SH-1,为905.43 U/L;分解淀粉的淀粉酶活性最高的是耐高温萌发菌MDC-1,为402.90 U/L,其次是耐高温萌发菌SH-1与MDA-1,分别为256.65、255.98 U/L;降解木质素的漆酶活性最高的是耐高温萌发菌 SH-1,为1 000.00 U/L。依据萌发菌的酶降解植物细胞壁的能力,简单预测耐高温萌发菌SH-1与MDA-1的天麻种子萌发率最好,用水琼脂法进行天麻种子萌发率测定,其耐高温萌发菌SH-1、MDA-1 萌发率最高,依次为 71.76%、68.82%。因此,结合前期酶活性试验与天麻种子萌发率试验结果进行分析,说明天麻种子萌发率并不由单一的1种胞外酶决定,天麻种子萌发受温度、胞外酶种类及活性多种因素共同调控,且水解植物细胞壁的木聚糖酶及其活性是影响天麻种子萌发的关键胞外酶,在30 ℃的胁迫温度条件下,经过耐高温驯化后的4株萌发菌均表现出更高的酶活性,促进天麻种子萌发,以期为天麻产业发展提供参考。
参考文献:
[1]徐锦堂.我国天麻栽培50年研究历史的回顾[J]. 食药用菌,2013,21(1):58-63.
[2]袁崇文.中国天麻[M]. 贵阳:贵州科技出版社,2002.
[3]汤永红.中药天麻的鉴定及药理作用探讨[J]. 中国农村卫生,2019,11(19):76,75.
[4]冉孝琴.贵州天麻萌发菌优良菌株的筛选[D]. 贵阳:贵州师范大学,2014.
[5]刘天睿,陈向东,王忠巧,等. 天麻研究进展及产业发展建议[J]. 中国现代中药,2020,22(4):647-651.
[6]游中华.天麻萌发菌种制作和应用技术的改进[J]. 湖北林业科技,2016,45(5):84-85.
[7]虞小燕.天麻萌发菌遗传多样性的研究及优良菌株筛选[D]. 汉中:陕西理工学院,2016:7.
[8]曾 旭,杨建文,凌 鸿,等. 石斛小菇促进天麻种子萌发的转录组研究[J]. 菌物学报,2018,37(1):52-63.
[9]罗阳兰,邓百万,刘军生,等. 胁迫条件对天麻种子共生萌发的影响[J]. 中药材,2019,42(8):1719-1724.
[10]赵明阳,徐玲玲,邓百万,等. 一株小菇属天麻萌发菌原生质体制备的研究[J]. 辽宁农业科学,2019(6):27-30.
[11]王彩云,侯 俊,王 永,等. 天麻种子萌发菌研究进展[J]. 北方园艺,2017,31(12):198-202.
[12]Fox R T V.Armillaria root rot:Biology and control of honey fungus[M]. Andover:Intercept Press,2000.
[13]徐锦堂,郭顺星,范 黎,等. 天麻种子与小菇属真菌共生萌发的研究[J]. 菌物系统,2000(1):137-141.
[14]马慧颖,明 红,刘涌涛,等. 间歇高温条件下4种食用菌生长势的变化及抗高温能力研究[J]. 新乡学院学报(自然科学版),2010,27(5):44-46.
[15]朱静娴.大球盖菇耐高温菌株的选育研究[D]. 泰安:山东农业大学,2018.
[16]刘天睿,张薇薇,王忠巧,等. 蜜环菌胞外酶和多糖含量变化规律研究[J]. 中药材,2019,42(1):57-61.
[17]刘 苹,唐志红,李梦玉,等. 金针菇漆酶活性测定的最佳反应条件及液体培养胞外酶的研究[J]. 食品科技,2012,37(6):14-17.
[18]黄万兵,桂 阳,龚光禄,等. 七株贵州蜜环菌胞内多糖得率及胞外酶活性研究[J]. 北方园艺,2016(2):134-138.
[19]黄万兵,桂 阳,杨通静,等. 不同处理对天麻种子保存时活力的影响[J]. 中药材,2018,41(10):2261-2265.
[20]刘梁涛.高效木质素降解菌菌株的筛选、鉴定及漆酶性质的研究[D]. 新乡:河南师范大学,2018.
[21]李金春,杨 然,李秀婷,等. 微生物木聚糖酶在食品工业中的应用进展[J]. 中国食品学报,2012,12(6):133-140.
3288501908213

