虎杖多糖通过NF-κB/P65信号通路抑制卵巢癌细胞增殖
曾博洁,许剑利,董 珊
(自贡市第一人民医院妇科,自贡 643000)
不受控制的增殖是癌细胞最重要的标志,并且在恶性肿瘤的癌变和进展中起着至关重要的作用。在妇科癌症中,卵巢癌是女性癌症相关病死率的主要驱动因素[1]。尽管在过去的35年中,卵巢癌的发病率保持相对平稳,但其存活率仍然较低,部分是由于其对现有疗法的抵抗力[2]。约75%的卵巢癌患者对标准的化疗治疗反应良好,但卵巢癌通常很快会复发,并对先前的化疗药物产生耐药性。因此,迫切需要开发新的抗卵巢癌药物以改善临床结果。传统草药已成为临床治疗的重要组成部分,它们可用于治疗100多种疾病。近年来,传统草药因在预防和治疗各种类型癌症中的重要作用而广受欢迎,其具有预防肿瘤发生、增强治疗效果以及减轻毒性的优点[3]。有研究[4]显示,几种传统草药具有前瞻性的抗癌特性,并且传统草药中的一些生物活性成分(如康莱特、青蒿素、鬼臼毒素和紫杉醇)已用于临床治疗多种类型的疾病。因此,传统草药具有很大的潜力,可以发展成为新型的抗卵巢癌药物。
随着对中药抗癌疗法的深入研究,天然来源的抗癌化合物越来越受到关注。中药虎杖(Polygonum cuspidatumSieb.et Zucc),系蓼科植物,具有利湿退黄、清热解毒、散瘀止痛、止咳化痰等功效。其核心成分是虎杖苷,在肿瘤治疗方面具有较高的药用价值[5]。药理研究[6]表明,虎杖水提液能显著抑制α-葡萄糖苷酶活性。水提液中成分复杂,多糖是水提液中化学成分的一部分,目前对于虎杖多糖的研究尚未见文献报道。本研究旨在探索虎杖多糖能否抑制肿瘤的生长,并成为新型的抗卵巢癌药物。
1 材料与方法
1.1 主要仪器
荧光定量PCR仪购自Bio-Rad;流式细胞仪购自美国BD Biosciences公司;酶标仪和Image Xpress高内涵成像系统购自美国Molecular Devices公司;qTOWER 3.0系统购自德国Analytik Jena公司。
1.2 主要试剂
虎杖多糖(批号D1713186,纯度≥98%)购自上海阿拉丁生化科技股份有限公司;TRIzol试剂、Lipofectamine 3000均购自美国Invitrogen公司;逆转录试剂盒购自中国Takara公司;胎牛血清购自美国Gibco公司;RPMI-1640培养基购自美国HyClone公司;结晶紫染色溶液购自中国Beyotime公司;磷酸盐缓冲液(Rockville,MD)购自美国Gibco公司;CCK-8试剂(10 μL/孔)购自中国Beyotime公司;RIPA缓冲液购自中国Thermo Fisher Scientific公司。M-MLV逆转录酶(M0251S)购自美国New England Biolabs公司;SYBR ? Premix Ex TaqTM试剂盒购自中国Takara公司;OVSAHO细胞购自中国语纯生物公司;Annexin V-FITC染色细胞凋亡检测试剂盒购自江苏凯基生物技术股份有限公司;ECL化学发光液购自中国Thermo Scientific公司;引物由Sangon Biotech(中国上海)合成。
1.3 方法
1.3.1 细胞培养 将SKOV3细胞以适量浓度接种于培养瓶中,分别加入含10%胎牛血清的RPMI1640培养基,置于37℃、5% CO2及95%相对湿度的培养箱中培养。细胞呈贴壁状态生长,每周传代2~3次,用0.25%胰酶消化2 min传代。
1.3.2 多糖的制备和碳水化合物含量的测定 首先将干燥的整株虎杖植物(300 g)切成小块,然后在95℃下使用2.0 L蒸馏水提取2.5 h共3次,最后通过多层纱布过滤。1 500×g离心10 min后,保存上清液并浓缩至1.5 L,并在4℃下用95%乙醇(2.5体积)沉淀过夜。离心分离沉淀,然后将其溶于蒸馏水中,并用Sevag试剂(氯仿∶丁醇为4∶1)处理除去蛋白质。将脱蛋白的溶液冻干,获得浅棕色多糖提取物(26.5 g)。用苯酚-硫酸法测定多糖提取物的总碳水化合物含量为54.0%(g/g)。
1.3.3 MTT法检测 将SKOV3细胞重悬到96孔板中(每孔2 000个)。24 h后,将虎杖多糖用含5% FBS的培养基稀释至不同浓度,然后添加至96孔板中。孵育24、48和72 h后,分别添加1 mg·mL-1MTT溶液,孵育4 h后,检测细胞活力。最后,用酶标仪检测570 nm处的吸光度。
1.3.4 结晶紫染色法 将SKOV3细胞以2×104细胞/孔的浓度重悬在12孔培养板中,并加入5%胎牛血清和1%抗生素的DMEM培养基,放入37℃的培养箱培养。加入含有不同浓度的BPP的培养基72 h。加入结晶紫溶液以覆盖细胞表面,并孵育20~30 min。用去离子水洗去残留的结晶紫。将培养板风干并用扫描仪拍照。用1% SDS试剂溶解结晶紫,并通过在检测570 nm下的光密度值来确定浓度。
1.3.5 qRT-PCR检测 采用定量PCR(qPCR)分析OC细胞样品中P65 mRNA表达水平。使用TRIzol从SKOV3细胞中提取总RNA样品。通过M-MLV逆转录酶逆转录来自OVSAHO细胞的RNA样品。使用qTOWER 3.0系统进行扩增和溶解曲线分析。使用SYBRRPremix Ex TaqTM试剂盒进行反应,总反应体积为10 μL。使用2-ΔΔCt法计算相对表达水平。
1.3.6 免疫印迹 收集细胞制备蛋白质样品,通过SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离,然后转移至PVDF膜上,用BSA固定PVDF膜4 h后,将膜在TBST中洗涤3次(5 min/次),然后将膜放入一抗(1 000倍稀释)在4℃下孵育过夜。将膜放入TBST中洗涤3次(5 min/次),以除去残留的一抗,并与相应的二抗在37℃温育45 min。根据ECL化学发光液说明书操作,在膜上滴入ECL化学发光液,并使用凝胶成像系统显影。
1.3.7 流式细胞仪检测细胞周期 将处理后的细胞在4℃的70%乙醇中固定4 h。用PBS洗涤2次后,将细胞重悬于含有RNase A和碘化丙啶(10 ng·mL-1和50 μg·mL-1)的柠檬酸盐缓冲液中,并在37℃孵育30 min。用流式细胞仪检测细胞周期。使用ModFit 161 LT 3.0版软件(美国Verity Software House公司)分析数据。
1.3.8 流式细胞仪检测细胞凋亡率 孵育后,收集细胞并在预冷的PBS中洗涤。加入Annexin V和PI在室温下染色15 min,并立即通过流式细胞仪检测细胞凋亡率。
1.3.9 单克隆形成实验 取对数生长期的SKOV3细胞,调整细胞密度为4×102个/mL,每孔2 mL接种于6孔培养板中,在培养箱中培养至细胞贴壁,弃去原有的培养液,分别加入10、20 μmol·L-1虎杖多糖。RPMI1640培养基组作为空白对照组,继续培养48 h后撤去加药的培养基,换成正常的新鲜培养基放于37℃、5% CO2孵箱中继续培养,且每隔2~3 d换液,并于光学显微镜下观察克隆的形成。大约15 d后,6孔板中出现肉眼可见的克隆时终止培养,弃去培养液,用每孔1 mL的PBS清洗2次,每孔加1 mL的4%多聚甲醛固定30 min,弃去固定液,用PBS清洗2次。每孔加入1 mL结晶紫染色液染色20 min左右,然后用PBS缓慢洗去染色液。
1.3.10 TUNEL检测细胞凋亡 将细胞爬片用PBS清洗2次,0.5%Triton X-100室温孵育5 min,加入50 μL TUNEL检测液(TdT酶∶荧光标记液=1∶9)于37℃避光孵育60 min,PBS洗3次,用抗荧光淬灭封片剂封片后于荧光显微镜下观察,用ImageJ图像分析软件进行定量统计分析。
1.4 统计学方法
所有数据采用SPSS 21.0统计学软件进行处理,经正态性和方差齐性检验后,符合正态分布且方差齐的计量资料以均数±标准差(x+s)表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析或重复测量方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 虎杖多糖对卵巢癌细胞增殖的影响
MTT检测结果如图1所示,当虎杖多糖浓度为0~5 μmol·L-1时,细胞增殖无变化(P>0.05)。当虎杖多糖浓度>10 μmol·L-1时,细胞增殖受到抑制(P均<0.05)。本研究采用10、20 μmol·L-1虎杖多糖进行后续实验。

图1 虎杖多糖对卵巢癌细胞增殖的影响
2.2 虎杖多糖对P65 mRNA相对表达量的影响
qRT-PCR检测结果见图2,与对照组相比,添加10、20 μmol·L-1虎杖多糖的细胞中P65 mRNA表达水平降低(P均<0.05)。
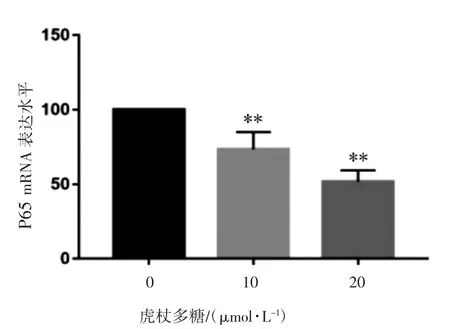
图2 虎杖多糖对P65 mRNA相对表达量的影响
2.3 虎杖多糖对总P65蛋白以及核内P65蛋白表达水平的影响
免疫印迹检测结果见图3,与对照组相比,添加10、20 μmol·L-1虎杖多糖的细胞中P65蛋白和核内P65蛋白表达水平均降低(P均<0.05)。
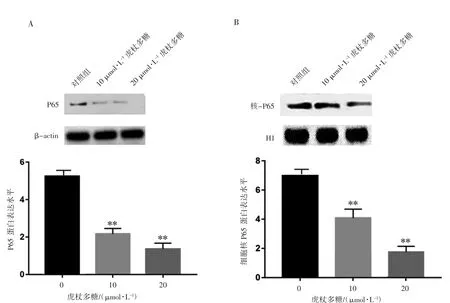
图3 虎杖多糖对p65蛋白表达水平的影响
2.4 虎杖多糖对细胞凋亡的影响
为了验证虎杖多糖对细胞凋亡的影响,本研究用流式细胞仪检测细胞的凋亡率,结果见图4。与对照组相比,添加10、20 μmol·L-1虎杖多糖的细胞凋亡率增高(P均<0.05)。
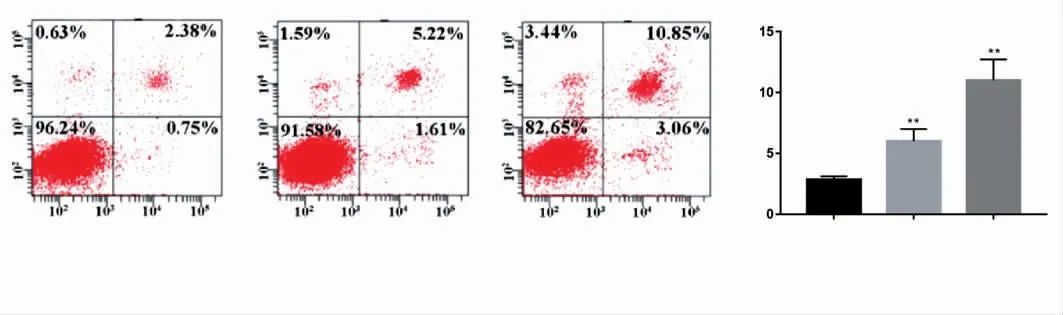
图4 虎杖多糖对细胞凋亡的影响
2.5 虎杖多糖对细胞周期的影响
为了探讨虎杖多糖抑制SKOV3细胞增殖活性的可能机制,本研究用流式细胞仪检测了细胞周期的变化,虎杖多糖可明显诱导S期阻滞,见图5。
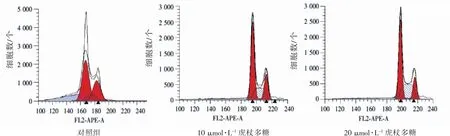
图5 虎杖多糖对细胞周期的影响
2.6 虎杖多糖对细胞增殖的影响
如图6所示,虎杖多糖可明显抑制SKOV3细胞的增殖,并且随浓度增高抑制效果逐渐增强。
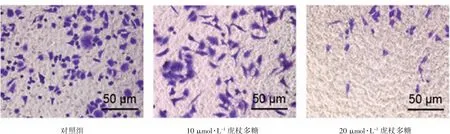
图6 虎杖多糖对细胞增殖的影响(×400)
3 讨论
卵巢癌是病死率最高的妇科肿瘤,严重影响了妇女健康[7]。传统草药在癌症的预防和治疗中可发挥关键作用。虎杖作为传统草药,具有潜在的止血、止痛、抗炎和抗癌作用。目前关于虎杖多糖对卵巢癌抑制作用的研究较少。卵巢癌的化疗耐药及复发转移是医学界待攻克的一大难题,需要研究新药物和新的治疗策略来改善卵巢癌的预后。中药成分开发正在成为发现抗癌药物的新方法[8]。核因子NF-κB(nuclear factor kappa B)是一类具有多种生理功能的转录因子,主要由P65(RelA)、RelB,cRel、P52/P100及P52/P100等成员组成。正常生理状态下,NF-κB在细胞质中与IκB结合,呈无活性三聚体状态。当机体受到损伤、病毒或自由基等刺激后,IκB发生磷酸化降解,激活NF-κB使之移至核内,从而促进细胞因子、炎性因子以及趋化因子的转录[9]。有研究[10]表明,NF-κB/P65信号通路在卵巢癌的发生、发展过程均占有重要的地位。
虎杖具有活血定痛、清热利湿、止咳化痰作用,临床用于治疗湿热黄疽、肺热咳嗽、疮痈肿毒、关节痹痛、水火烫伤等[11]。虎杖多糖是一种天然的多酚类化合物,主要存在于虎杖这一传统中草药中,目前已收录于《中国药典》。虎杖苷能够诱导急性单核细胞白血病细胞凋亡[12];诱导肺癌细胞的增殖周期停滞,诱导细胞凋亡[13];还通过上调Bax/Bcl-2蛋白的比例以及减弱β反应蛋白信号抑制骨肉瘤细胞的增殖[14]。本研究通过免疫印迹检测发现,随着虎杖多糖浓度增加,P65蛋白和核内P65蛋白表达水平均下降,证明虎杖多糖对人卵巢癌细胞SKOV3的P65蛋白有抑制作用,从而达到抑制卵巢癌细胞增殖、影响细胞因子转录表达、进而抑制肿瘤生长的作用。
综上,虎杖多糖可能通过NF-κB/P65信号通路抑制卵巢癌细胞增殖,并促进其凋亡。但由于虎杖多糖具有广泛的生物学作用,并非作用单一靶点,因此还需要更进一步讨论虎杖多糖是否还通过其他途径发挥了生理学作用,进而为临床研究提供理论依据。

