miR-495-3p靶向IL-6R抑制宫颈癌细胞的增殖和转移的机制研究
吉 洁 马志君 曹振东 邵雪斋 张玉娟(承德医学院附属医院,承德 067000)
宫颈癌发病率、病死率在女性生殖系统肿瘤均居首位[1]。据统计,全球每年宫颈癌新发病例高达50 万例,占所有新发癌症病例的5%,其中约85%发生在医疗资源相对匮乏的发展中国家[2]。尽管宫颈癌的预防、诊断和治疗方法不断改善,但晚期宫颈癌患者的预后仍然不佳,许多患者在手术切除、规范化的放化疗后仍复发和转移[3]。因此,研究宫颈癌的发生、转移的生物学机制具有重要意义。微小RNA(microRNA,miRNA)是由20~25 个核苷酸组成的单链小分子RNA,其通过与靶基因的3'非翻译区(untranslated region,UTR)结合来调控转录后基因表达。此外,miRNA 还可作为癌基因或抑癌基因,通过特定的靶点或信号通路参与胚胎发育、细胞分化、凋亡、耐药性、肿瘤转移等多种生物学过程[4-5]。近年研究显示,miR-584 等miRNA 在宫颈癌中异常表达,表明miRNA 可能作为宫颈癌新的预后标志物或治疗靶点[6]。miR-495-3p 是近年发现的抑癌基因,miR-495-3p 低表达与胃癌、透明细胞肾细胞癌的增殖和转移有关[7-8]。然而,miR-495-3p 在宫颈癌中的生物学作用尚未可知。miRNA 预测网站显示白细胞介素6 受体(interleukin 6 receptor,IL-6R)基因是miR-495-3p 的潜在靶基因。既往研究表明胃癌细胞中IL-6R 表达上调,IL-6R 高表达与临床病理特征之间具有显著的相关性[9]。IL-6R 高表达还可促进骨肉瘤细胞的增殖和迁移能力[10]。因此,本研究以IL-6R 为切入点,探讨miR-495-3p 在宫颈癌细胞增殖和转移中的作用,以期为宫颈癌临床诊疗提供新的策略。
1 材料与方法
1.1 材料 人宫颈永生化细胞H8、宫颈癌细胞SiHa、HeLa、caski 购自中国科学院上海细胞库;RPMI1640、MEM、DMEM培养基购自美国Gibco公司;RNeasy Mini Kits、第一链cDNA 合成试剂盒、SYBR Green PCR Master Mix 购自大连TaKaRa 公司;Lipo⁃fectamine 2000、Taqman miRNA 逆转录试剂盒购自美国Invitrogen 公司;细胞计数试剂盒(Cell Counting Kit 8,CCK-8)、细胞裂解液、聚偏氟乙烯膜购自上海碧云天公司;鼠源IL-6R 抗体、兔源细胞周期素D1(CyclinD1)、兔源基质金属蛋白酶2(matrix metallo⁃proteinase,MMP2)、MMP9 购自上海艾博抗公司;康宁Transwell 小室购自北京优尼康生物公司;miR-495-3p模拟物(miR-495-3p mimics)及其阴性对照(miR-NC)、IL-6R 小干扰RNA(si-IL-6R)及其阴性对照(si-NC)、IL-6R 过表达质粒(pcDNA-IL-6R)及其阴性对照(pcDNA-NC)、野生型/突变型IL-6R 荧光素酶报告基因载体(WT/MUT-IL-6R)由上海吉玛制药公司提供。
1.2 方法
1.2.1 细胞培养 H8、SiHa、HeLa、caski细胞采用RPMI1640、MEM、DMEM 培养基在37℃、5%CO2的细胞培养箱进行培养。培养基中均补充10%胎牛血清、100 U/ml 青霉素和100 μg/ml 链霉素。当细胞密度达80%时,按 照1∶3 比例进 行传代,2~3 d 换液1次。
1.2.2 RT-qPCR 检 测miR-495-3p 和IL-6R mRNA表达 利用RNeasy Mini Kits从H8、HeLa、caski各组SiHa细胞中分离总RNA。使用Taqman miRNA 逆转录试剂盒将miRNA转化为cDNA,使用第一链cDNA合成试剂盒将mRNA 逆转录为cDNA。使用引物和SYBR Green PCR Master Mix 进 行RT-qPCR 扩 增。2-ΔΔCt法分析miR-495-3p(内参为U6)、IL-6R mRNA(内参为β-actin)的表达水平。miR-495-3p 正向引物序列5'-GCGGAAACAAACATGGTGCA-3',反向引物序列5'-CAGTGCGTGTCGTGGAGT-3';U6 正向引物序列5'-ACAGATCTGTCGGTGTGGCAC-3',反 向引物序列5'-GGCCCCGGATTATCCGACATTC-3';IL-6R 正向引物序列5'-AGTGTCGGGAGCAAGTTCAG-3',反向引物序列5'-TGGTCTGTGGAGAGA⁃AGCCT-3';β-actin 正向引物序列5'-CCAACCGC⁃GAGAAGATGA-3',反向引物序列5'-CCAGAGGCG⁃TACAGGGATAG-3'。
1.2.3 转染和实验分组 在细胞转染前1天,将生长良好的SiHa细胞接种到6孔无血清培养基中。按照Lipofectamine2000 使用说明,当细胞融合度达到60%时进行转染。将1 μl 的Lipofectamine2000 与24 μl无血清培养基混合。将50 pmol的待转染物与适量无血清培养基混合,使总体积为25 μl。室温下混合20 min。然后将混合物加入每个孔中进行培养。6 h 后更换培养基。根据转染物不同分为miRNC 组、miR-495-3p 组、si-NC 组、si-IL-6R 组、miR-495-3p+pcDNA-NC组、miR-495-3p+pcDNA-IL-6R组。
1.2.4 CCK-8 实验检测细胞活力 将各组SiHa 细胞接种于96孔板,接种后48 h进行CCK-8测定。每孔添加10 μl CCK-8试剂,将培养板在培养箱内孵育2 h。空白孔调零,采用酶标仪检测450 nm 波长处吸光度(absorbance,A)值,计算细胞增殖率。细胞增殖率(%)=(A实验组/A对照组)×100%。
1.2.5 Transwell实验检测细胞转移能力 转染48 h,消化细胞并悬浮在无血清培养基中。细胞密度调整为2×106个/ml。将Transwell 小室放置在24 孔板中。在上室和下室分别加入200 μl的细胞悬浮液和500 μl 的含有10%胎牛血清的培养基。细胞培养24 h 后,擦去上室内细胞,用4%多聚甲醛固定细胞15 min,用结晶紫染色15 min。显微镜下随机选择5个视野进行细胞计数,其均值为转移细胞数。
1.2.6 Western blot 检测IL-6R、CyclinD1、MMP2、MMP9蛋白表达 使用放射免疫沉淀分析裂解缓冲液提取细胞蛋白,并分析蛋白样品浓度。利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,然后转移到聚偏氟乙烯膜上。5%脱脂牛奶封闭膜后,在4℃条件下与适当的一抗孵育过夜。然后,用辣根过氧化物酶标记的二抗孵育膜。以β-actin 为内参,利用增强型化学发光检测试剂盒进行显色,凝胶成像系统检测目的蛋白灰度值,以目的蛋白和β-actin灰度值比值表示目的蛋白相对表达水平。
1.2.7 双荧光素酶报告实验 合成含有与miR-495-3p 结合位点或结合位点突变序列的IL-6R 野生型序列(5'-UUCAAGUUUUUGUUUGUUUGUUU-3')或突变型序列(5'-UUCAAGUUUUUGUUGUCA⁃CUGAU-3'),将其克隆到pmirGIO 双荧光素酶表达载体,分别命名为WT-IL-6R、MUT-IL-6R。利用Lipofectamine2000 将WT-IL-6R、MUT-IL-6R 分别与miR-495-3p mimics、miR-NC 共转染SiHa 细胞,48 h后,双荧光素酶报告检测系检测各组细胞相对荧光素酶活性。
1.3 统计学分析 采用SPSS19.0软件进行统计分析,所有实验均重复3 次,进行3 次独立实验,数据以表示。采用t检验评估两组间差异;采用单因素方差分析评估多组间差异,进一步两组间比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 在宫颈癌细胞系miR-495-3p 和IL-6R 表达情况 与人宫颈永生化细胞H8 比较,宫颈癌细胞SiHa、HeLa、caski 中miR-495-3p 的表达降低,IL-6R mRNA和IL-6R蛋白的表达升高(P<0.05,图1)。

图1 在宫颈癌细胞系中miR-495-3p和IL-6R表达情况Fig.1 Expressions of miR-495-3p and IL-6R in cervical cancer cell lines
2.2 过表达miR-495-3p 对宫颈癌细胞SiHa 增殖和转移的影响 与miR-NC 组比较,miR-495-3p 组SiHa 细胞miR-495-3p 的表达显著升高,CyclinD1、MMP2 和MMP9 蛋白表达显著降低,细胞增殖率、转移数降低(P<0.05,图2)。
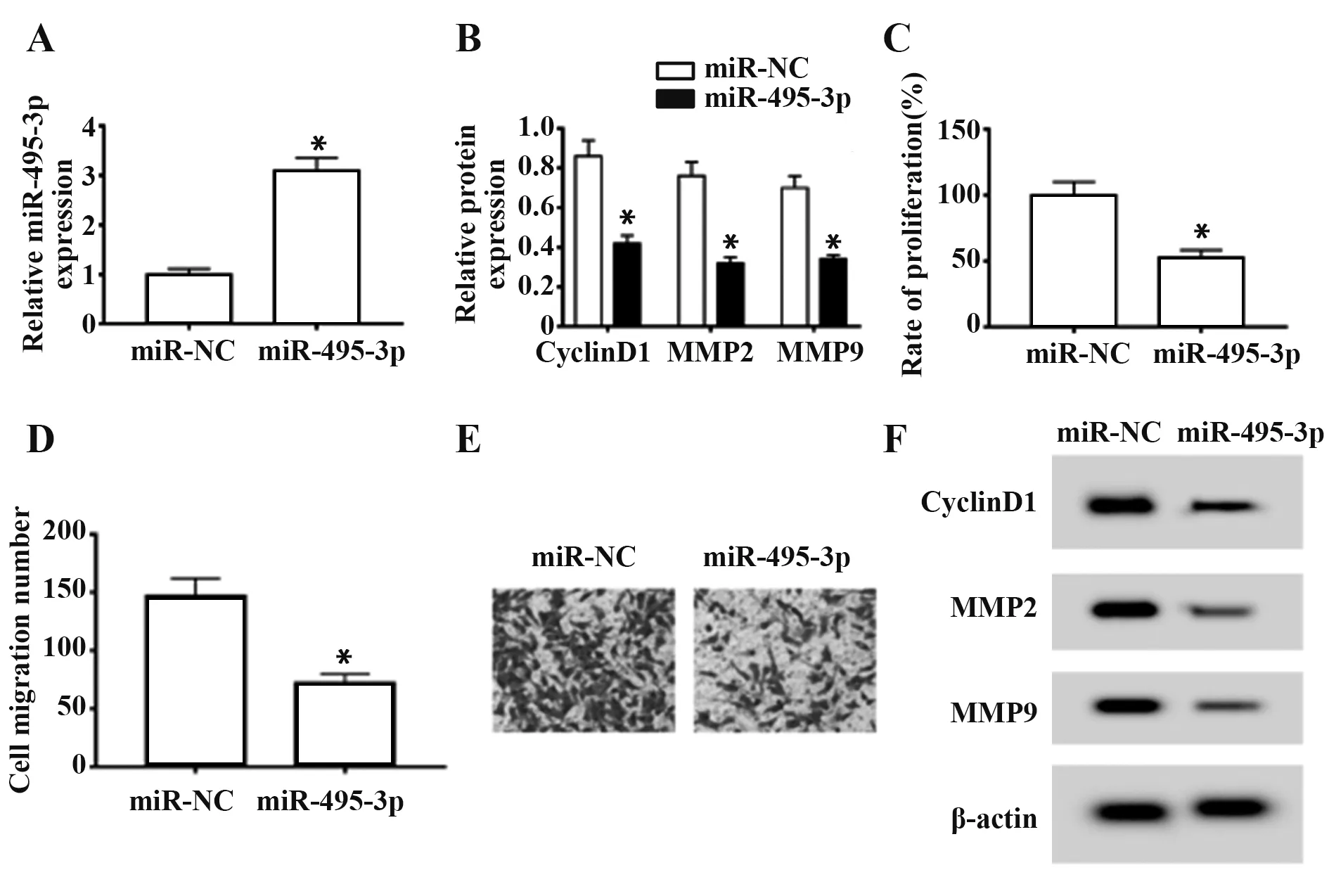
图2 过表达miR-495-3p 对宫颈癌细胞SiHa 增殖和转移的影响Fig.2 Effect of overexpression of miR-495-3p on prolifera⁃tion and metastasis of cervical cancer cells SiHa
2.3 干扰IL-6R 表达对宫颈癌细胞SiHa 增殖和转移的影响 与si-NC 组比较,si-IL-6R 组SiHa 细胞IL-6R 蛋白表达显著降低,CyclinD1、MMP2 和MMP9蛋白表达显著降低,细胞增殖率、转移数降低(P<0.05,图3)。

图3 过表达IL-6R对宫颈癌细胞SiHa增殖和转移的影响Fig.3 Effects of overexpression of IL-6R on proliferation and metastasis of cervical cancer cells SiHa
2.4 miR-495-3p 靶向IL-6R Starbase 软件在线预测显示,miR-495-3p 与IL-6R 之间存在部分连续和互补的核苷酸序列,见图4A。与miR-NC 和WT-IL-6R 共转染组比较,miR-495-3p 和WT-IL-6R 共转染组SiHa 细胞荧光素酶活性显著降低(P<0.05);而miR-495-3p 和MUT-IL-6R 共转染组SiHa 细胞荧光素酶活较miR-NC 和MUT-IL-6R 共转染组无显著变化,见图4B。miR-495-3p 组SiHa 细胞IL-6R 蛋白表达较miR-NC 组显著降低;anti-miR-495-3p 组SiHa细胞IL-6R 蛋白表达较anti-miR-NC 组显著升高(P<0.05,图4C、D)。

图4 miR-495-3p靶向调控IL-6R表达Fig.4 miR-495-3p targeted and regulates expression of IL-6R
2.5 过表达IL-6R 可以逆转miR-495-3p 对SiHa 增殖和转移的影响 与miR-495-3p+pcDNA-NC 组比较,miR-495-3p+pcDNA-IL-6R 组SiHa 细胞IL-6R、CyclinD1、MMP2、MMP9 表达增加,细胞增殖率、转移数增加(P<0.05,图5)。
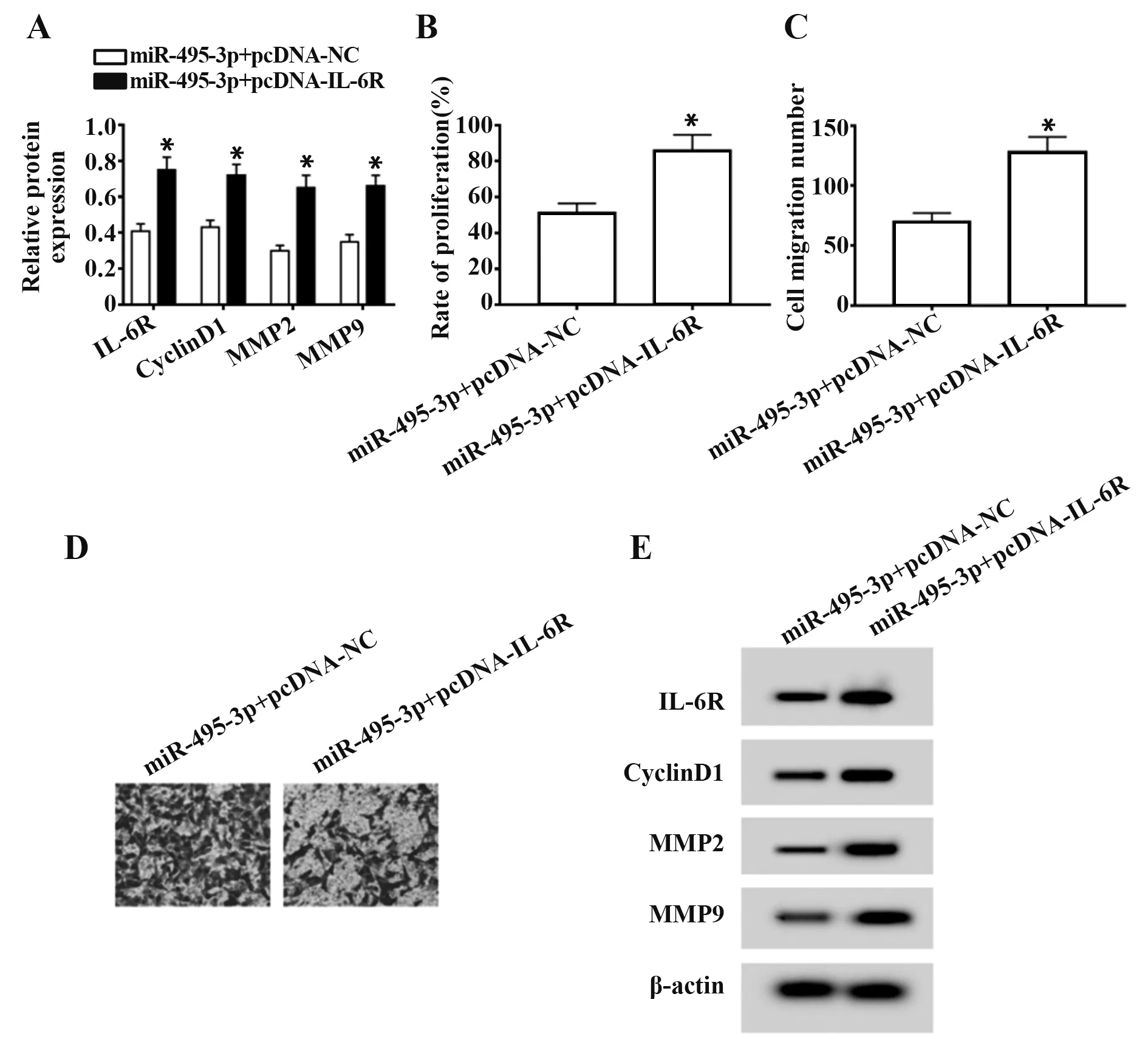
图5 过表达IL-6R 可以逆转miR-495-3p 对SiHa 增殖和转移的影响Fig.5 Overexpression of IL-6R could reverse effects of miR-495-3p on SiHa proliferation and metastasis
3 讨论
宫颈癌的发生发展是一个多基因参与、多步骤的复杂过程。早期宫颈癌患者预后较好,而晚期宫颈腺癌由于局部复发和转移扩散,治疗几乎无效[3]。因此,探讨miR-495-3p 在宫颈癌细胞增殖和转移中的作用,对开发新的治疗策略,改善宫颈癌患者生存现状意义重大。
近年来,miRNA 已成为肿瘤研究的热点,尤其是在恶性肿瘤中。研究显示miR-495-3p 在结肠癌中表达下调,上调miR-495-3p 可诱导结肠癌细胞凋亡,抑制细胞周期进展[11]。miR-495-3p 在黑色素瘤中表达显著降低,上调miR-495-3p 通过靶向E2F3可降低黑色素瘤细胞增殖、迁移和侵袭能力[12]。此外,miR-495-3p 低表达还与胃癌细胞的增殖、侵袭、自噬以及多药耐药有关[13-14]。与上述研究结论一致,本研究发现宫颈癌细胞中miR-495-3p 表达较宫颈永生化细胞H8 显著降低,提示miR-495-3p 表达异常可能与宫颈癌发生有关。进一步功能分析显示,过表达miR-495-3p后SiHa细胞的增殖和转移能力显著降低,促增殖蛋白CyclinD1、促转移蛋白MMP2 和MMP9 表达显著降低。以上研究表明miR-495-3p低表达可促进宫颈癌细胞的增殖和转移。
IL-6R 在多种人类疾病中的作用已被报道。BHARTI 等[15]研究发现临床高侵袭性乳腺导管癌中IL-6R表达增加,下调IL-6R表达可增加单胺氧化酶A活性,抑制肿瘤血管生成和侵袭。WANG 等[16]报道miR-21 通过靶向IL-6R 可抑制内皮祖细胞的增殖、迁移和侵袭,靶向miR-21/IL-6R 通路有助于降低癌症患者复杂静脉血栓形成,促进血栓的溶解。JIANG 等[17]指出IL-6R 高表达是胶质瘤患者生存不良的预测因子,下调IL-6R 可抑制细胞的增殖、侵袭和神经球的形成,抑制体内肿瘤的发生。邢兵等[18]研究表明,BRMS1 可抑制IL-6R 表达进而降低鼻咽癌细胞的增殖和转移能力。此外,IL-6R 高表达还与上皮性卵巢癌的化疗耐药有关[19]。本研究发现宫颈癌细胞中IL-6R 表达显著增加,与miR-495-3p表达呈负相关。双荧光素酶报告基因证实IL-6R 是miR-495-3p 的靶基因。在SiHa 细胞中过表达miR-495-3p 可抑制IL-6R 表达,抑制miR-495-3p 则促进IL-6R 表达。更重要的是抑制IL-6R 表达可降低CyclinD1、MMP2 和MMP9 蛋白表达水平以及SiHa细胞的增殖和转移能力,而恢复实验显示过表达IL-6R 则逆转miR-495-3p mimics 对SiHa 细胞增殖、转移及其相关蛋白表达的影响。以上结果表明,miR-495-3p 低表达通过靶向IL-6R 可促进宫颈癌进展。
综上所述,本研究发现宫颈癌细胞中miR-495-3p表达降低,过表达miR-495-3p 通过靶向IL-6R 可抑制宫颈癌细胞的增殖和转移能力。因此,上调miR-495-3p 可抑制宫颈癌的发展,为宫颈癌的靶向治疗提供了新的策略。

