BMP4重组蛋白在毕赤酵母中表达载体构建与纯化分析
赵 卓,籍昊天,,肖业臣
(1.吉林师范大学生命科学学院,吉林 四平 136000;2.吉林大学基础医学院生物化学与分子生物学系,吉林 长春 130021)
骨形态发生蛋白4(Bone morphogenetic protein 4,BMP4)是骨形成蛋白家族的一员,隶属于TGF-β超家族,在调节胚胎发育、干细胞分化和成人组织稳态等方面起重要的调控作用[1].Klösch等[2-3]将鼠源BMP4在重组大肠杆菌中进行了表达,但表达系统不能对外源蛋白进行修饰,会形成不溶解、无活性的包涵体,并存在后期蛋白复性实验烦琐、复性率较低等问题;Cha等[4-5]将人源BMP4在中国仓鼠卵巢细胞中进行了表达,结果证明哺乳动物活细胞表达系统在大量生产蛋白时成本较高,不适合大规模生产.在BMP4蛋白纯化方面,普遍选择使用亲和层析技术,如免疫亲和层析、染料-配体亲和层析、固定化金属离子亲和层析等[6],但亲和层析技术虽然操作方便,却同样存在成本较高、不宜大规模生产等问题.因此,优化BMP4表达方法、提高利用效率、降低纯化成本,对后续研发和生产至关重要.
巴斯德毕赤酵母表达系统是目前较为常见的表达系统之一,其优点在于表达高效、稳定性好、生产成本低,可根据需要选择胞内或胞外分泌路径.其中,胞外分泌表达纯化工艺简单、生产成本低,适用于工业生产[7].离子交换层析方法可以根据电荷性质差异分离电离分子,具有处理能力强、适用广泛、成本适中等优点,同时还有易于放大和自动化处理等特性,在大批量生产中发挥重要的作用.本文通过设计合成BMP4-Fc目的基因序列,利用巴斯德毕赤酵母作为BMP4表达系统,采用离子交换层析法分离、纯化目的蛋白,通过BMP4形成二聚体时具有促进间充质干细胞增殖的特性,验证了BMP4-Fc融合蛋白的活性.
1 材料及方法
1.1 实验材料
实验所需材料、试剂分别为:限制性内切酶Xho I、Xba I、Sac I和限制性内切酶缓冲液(美国NEB公司);琼脂糖、胰蛋白胨、酵母提取物(英国OXOID公司);DNA电泳标准品(Marker)、聚丙烯酰胺凝胶电泳(SDS-PAGE)标准品(Marker)和增强型化学发光试剂(中国全式金公司);博来霉素(美国Invitrogen公司);质粒小提试剂盒、质粒大提试剂盒、切胶回收试剂盒(中国康为公司);载体pPICZα(中国南京中鼎生物公司),X33毕赤酵母(中国华越洋生物公司);BMP4单克隆抗体、Fc单克隆抗体和辣根过氧化物酶标记羊抗兔抗体(中国Bioss公司);聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)(美国Millipore公司);PCR mix酶和BMP4蛋白(中国聚合美公司);细胞计数试剂(cell counting Kit-8,CCK-8)(美国MedChem Express公司).聚合酶链式反应(Polymerase chain reaction,PCR)引物设计合成由中国生工公司完成.
1.2 载体构建
1.2.1 引物设计
在美国国家生物信息中心(National Center for Biotechnology Information)进行蛋白质检索,获得BMP4的氨基酸序列(登录号:NP 001193.2),设计合成蛋白基因序列(由南京钟鼎公司完成).合成基因全长1 169 bp,在5′端插入Xho I限制性内切酶酶切位点,在3′端插入Xba I和Sac I限制性内切酶酶切位点(由南京钟鼎公司完成),并保存于大肠杆菌中.
1.2.2 构建BMP4-Fc表达载体
取10 μL大肠杆菌培养液,加至150 mL含博来霉素的LB培养基中,37 ℃摇床培养.当D(600)=0.6~0.8时,用质粒大提试剂盒进行质粒提取,用Xho I、Xba I限制性内切酶进行酶切鉴定,并将质粒送到上海生工公司进行测序和验证.确认重组质粒准确无误后,用Sac I限制性内切酶进行单酶切,线性化质粒经DNA凝胶电泳、切胶回收试剂盒回收,-20 ℃保存.
1.2.3 制备重组质粒X33毕赤酵母
将X33毕赤酵母制备成感受态酵母细胞后与线性化重组质粒混合,将混合液加入电转杯,在BTXecm830型方波电穿孔仪中进行电转化.转化后的酵母菌在28 ℃的培养箱中静置2 h后,取部分菌液涂布在含有100 μg/mL博来霉素的酵母浸出粉胨葡萄糖平板培养基中,倒置培养24~48 h.
1.2.4 鉴定克隆载体
挑选长势良好的菌落接种于含有博来霉素的酵母浸出粉胨葡萄糖液体培养基中,28 ℃,200 r/min摇床培养至底部出现菌种沉淀,吸取100 μL菌液进行PCR.将菌液悬浮充分混匀后取500 μL加入到50 mL含甘油的缓冲性完全培养基中,28 ℃,200 r/min培养.D(600)=2~6时,将酵母菌转移至含甲醇的缓冲性复合培养基中培养.每24 h补充1%甲醇诱导分泌蛋白.96 h后收取上清液进行蛋白印迹 (Western-blot)测定,观察目标蛋白位置及分泌量,选择分泌较好的酵母菌菌种保存.
1.2.5 优化重组菌种诱导条件
取重组菌种进行培养,分别设置0,1%,2%,3%,4%,5%的甲醇溶液进行诱导实验,取不同组上清液进行SDS-PAGE和Western-blot测定,使用Fc和BMP4抗体检测重组蛋白表达量.
1.3 分析重组蛋白活性
1.3.1 重组蛋白纯化
取上清液用超滤管浓缩提纯,将浓缩蛋白进行阴离子交换层析,用20 mmol/L Tris-HCl缓冲液冲洗.用20 mmol/L Tris-HCl和不同浓度NaCl混合液分3次洗脱.每次洗脱过程中,NaCl浓度依次设置为100,50,10 mmol/L.
1.3.2 重组蛋白活性测定
复苏间充质干细胞,将培养细胞接种到96孔板中,每孔接种1万个细胞.将磷酸缓冲盐溶液、标准蛋白样品、纯化重组蛋白样品分别加入到培养孔中,置于CO2培养箱中培养36~48 h;向样品孔中加入10 μL CCK-8试剂,轻微震荡混匀,在CO2培养箱中培养2~4 h,利用酶标仪检测样品D(450)值.
1.4 结果分析
使用IBM SPSS 21.0软件进行数据统计,并对实验数据进行ANNOVA分析,显著性水平P<0.05.
2 结果与分析
2.1 质粒单双酶切鉴定
通过Sac I限制性内切酶进行单酶切,将质粒线性化,结果见图1.通过Xho I、Xba I限制性内切酶进行双酶切,得到的目的片段结果见图2,单酶切和双酶切结果显示,目的基因己插入,目的质粒构建成功.
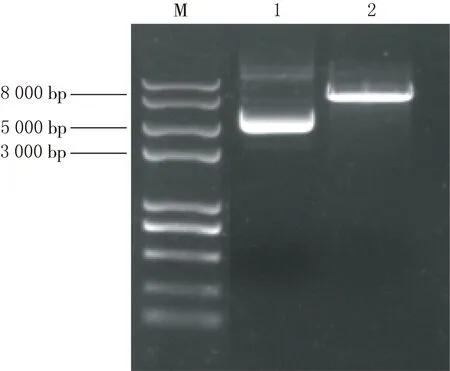
1重组质粒,2重组质粒BMP4-Fc
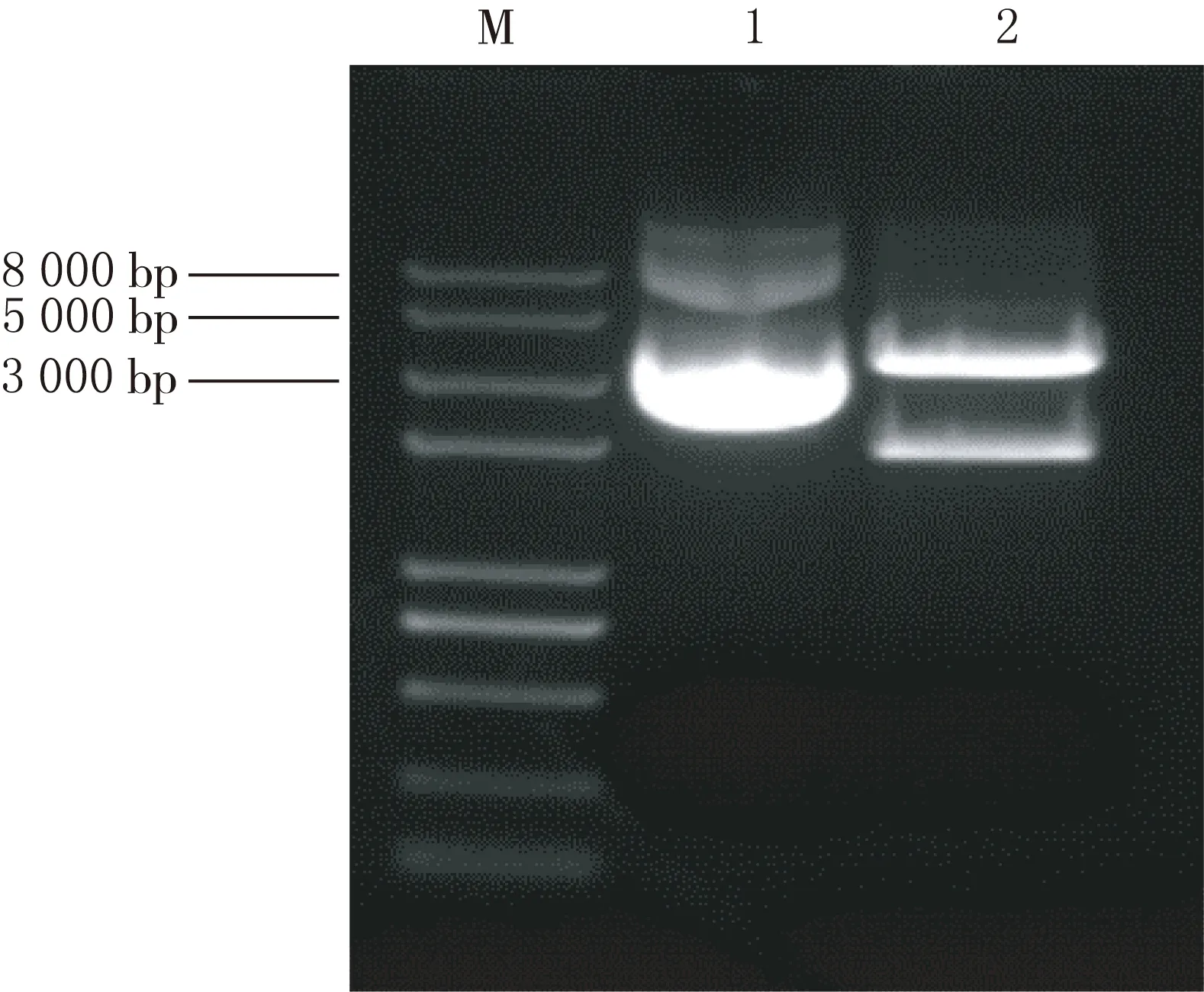
1重组质粒,2重组质粒BMP4-Fc
2.2 重组质粒X33毕赤酵母鉴定与筛选
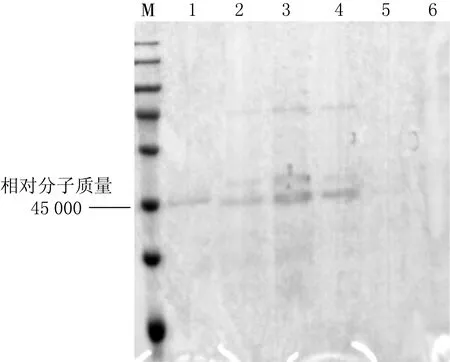
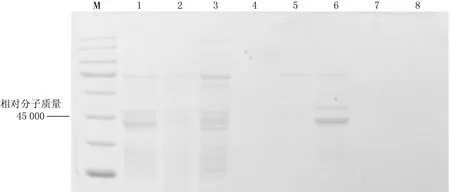
将目的质粒通过电转化法构建重组X33毕赤酵母表达载体,酵母菌菌落PCR实验结果见图3,结果显示2,3,4号菌种有PCR产物,证明目的基因已导入到酵母菌中.SDS-PAGE实验结果见图4,结果显示在相对分子质量为45 000 处,1—4号菌种均有蛋白分泌.
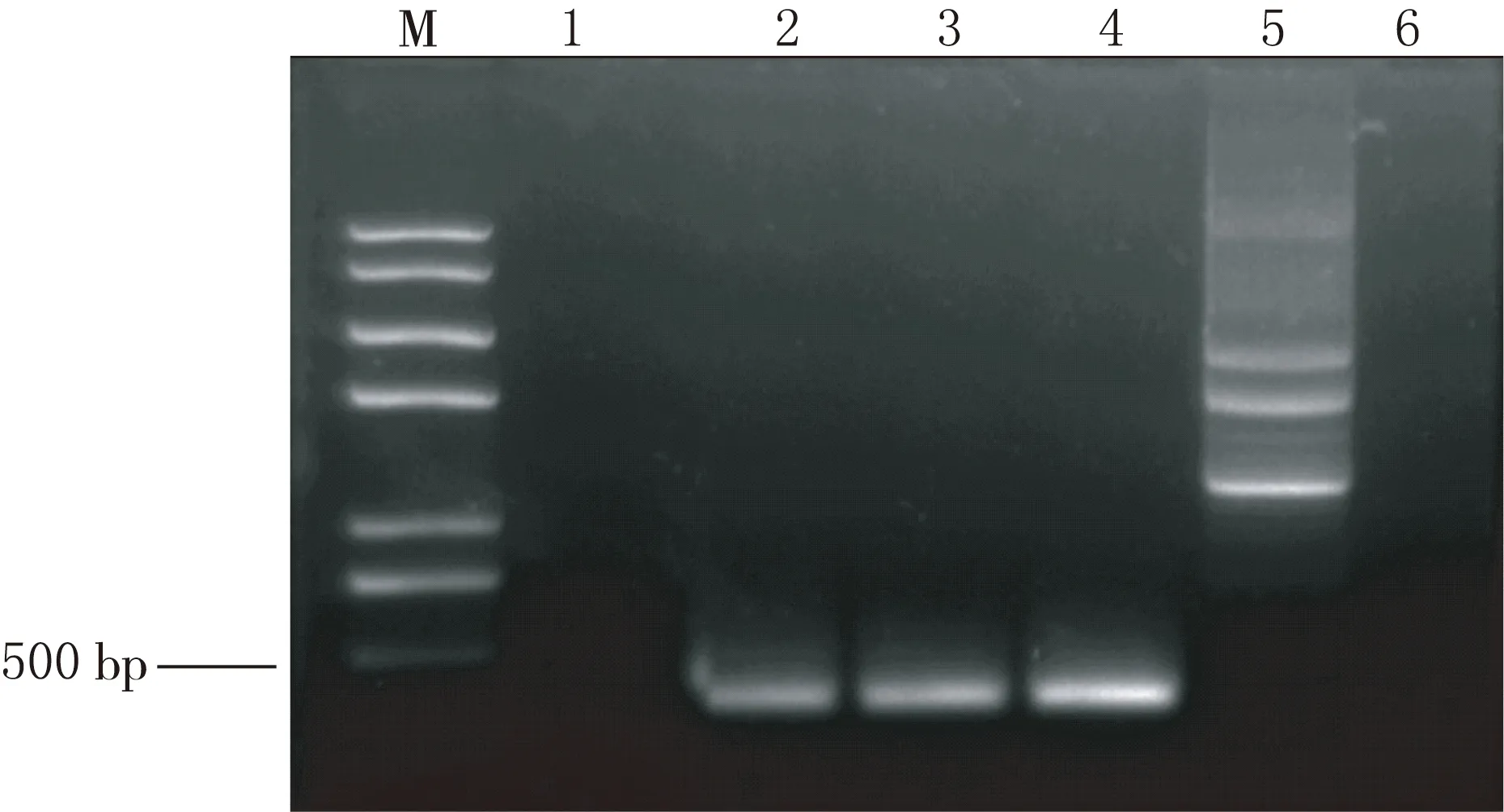
1—4菌种编号,5其他质粒,6双蒸水

1菌种1培养0 h,2菌种1培养48 h,3菌种2培养0 h,4菌种2培养48 h,5菌种3培养0 h,6菌种3培养48 h,7菌种4培养0 h,8 菌种4培养48 h
2.3 诱导条件优化
用不同质量分数的甲醇对同一菌种进行诱导,SDS-PAGE验证结果(见图5)表明,1%,2%和3%的甲醇诱导,在相对分子质量为45 000 处均有蛋白条带.用Fc抗体和BMP4抗体进行Western-blot检测,结果(见图6、图7)发现,1%甲醇诱导的酵母菌分泌的目的蛋白较多.将同一菌种用1%甲醇连续诱导96 h,SDS-PAGE实验结果(见图8)表明,诱导72和96 h的酵母菌分泌的蛋白结果相同,说明甲醇诱导毕赤酵母表达蛋白最优时间为72 h.
1—6:0,1%,2%,3%,4%,5%甲醇诱导蛋白表达上清液
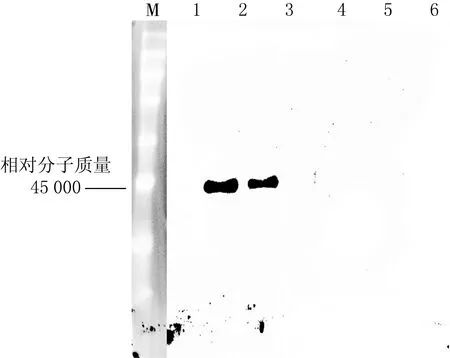
1—6:0,1%,2%,3%,4%,5%甲醇诱导蛋白表达上清液
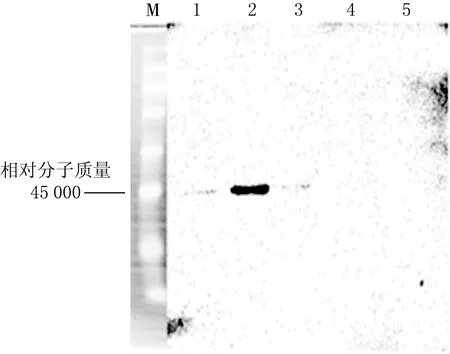
1—6:0,1%,2%,3%,4%,5%甲醇诱导蛋白表达上清液

1—5:培养0,24,48,72,96 h诱导蛋白表达上清液
2.4 重组蛋白纯化
重组蛋白阴离子交换层析:将蛋白原液加入阴离子柱,用20 mmol/L Tris-HCl和不同浓度梯度的NaCl混合液进行洗脱.当NaCl浓度为100 mmol/L时,洗脱结果见图9,目的蛋白被300 mmol/L NaCl和20 mmol/L Tris-HCl混合液洗脱;当NaCl浓度为50 mmol/L时,洗脱结果见图10,目的蛋白被250 mmol/L NaCl和20 mmol/L Tris-HCl混合液洗脱;当NaCl浓度为10 mmol/L时,洗脱结果见图11,目的蛋白被230 mmol/L NaCl和 20 mmol/L Tris-HCl混合液洗脱,说明该浓度洗脱液可得到较高纯度目的蛋白.
1:蛋白原液;2:流穿液;3:20 mmol/L Tris-HCl洗脱峰;4:100 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰;5:200 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰;6:300 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰;7:400 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰;8:1 000 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰

1:经过30 000超滤管浓缩的蛋白原液;2:20 mmol/L Tris-HCl洗脱峰;3:200 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰;4:250 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰;5:300 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰;6:1 000 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰

1:蛋白原液;2:200 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰;3:220mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰;4:230mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰;5:300 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰;6:1 000 mmol/L NaCl+20 mmol/L Tris-HCl洗脱峰
2.5 重组蛋白活性测定及数据分析
分别用磷酸缓冲盐溶液、商品化BMP4与纯化后的BMP4-Fc,对间充质干细胞进行刺激,培养48 h后加入10 μL细胞计数试剂CCK-8培养2 h,用酶标仪检测D(450)值,结果见图12.分析结果显示,商品化BMP4组D(450)比PBS组显著增高,BMP4-Fc组D(450)比PBS组显著增高,商品化BMP4组D(450)略高于BMP4-Fc组但差异不显著,说明BMP4-Fc对间充质干细胞的刺激程度较低,接近商品化BMP4对间充质干细胞的刺激水平.

*P<0.05
3 讨论
蛋白类药物通过血液进入体内循环时,由于半衰期比较短通常需要对患者加大给药剂量,因而会产生副作用.BMP4作为骨形成蛋白家族的一员,对其生理活性的研究与功能开发利用一直受到众多学者的重视.近年来对IgG-Fc标签的研究越来越多,发现Fc标签可以促进蛋白形成稳定二聚体,可延长在血液中的半衰期,降低蛋白免疫原性,从而减少患者给药量、减轻对患者的毒副作用.本文依据BMP4可通过形成二聚体发挥其生理作用的特点,在BMP4基因组中加入了IgG-Fc标签.研究结果显示,当BMP4与IgG-Fc融合后会促使BMP4-Fc融合蛋白形成不易降解的稳定二聚体;同时,BMP4-Fc融合蛋白对间充质干细胞的增殖具有明显的促进作用,说明在BMP4中加入IgG-Fc形成二聚体后可以更好地发挥生理活性.
巴斯德毕赤酵母表达系统可对目的蛋白进行翻译后修饰,具有高效分泌表达的真核表达系统.有研究报道,整合到毕赤酵母基因组内目的基因的拷贝数量决定毕赤酵母表达系统分泌的蛋白量,但本文进行的PCR目的基因扩增和初步诱导表达实验结果与这种情况并不相符,表明不同蛋白在毕赤酵母表达系统中的表达量存在差异.为此,本文进一步纯化了重组蛋白、优化了DEAE离子交换层析条件,发现在230 mmol/L NaCl和20 mmol/L Tris-HCl混合液洗脱条件下,可以除去大部分杂蛋白,得到纯度较高、生理活性好、接近商业化纯品水平的目的蛋白,为BMP4的进一步研究、开发和利用提供了参考依据.
——一道江苏高考题的奥秘解读和拓展

