转铁蛋白受体1对结核分枝杆菌胞内生存影响的初步研究
李军丽 姜爱国 付丽丽 占玲俊 赵爱华
结核分枝杆菌(Mycobacteriumtuberculosis,M.tb)是一种胞内寄生病原菌,其感染后主要在宿主巨噬细胞内生存和繁殖。铁是M.tb生存繁殖的必要条件,M.tb本身胞内缺铁,必须通过宿主获得自身生长繁殖所需要的铁元素。M.tb毒力和生长机制的研究表明,其在缺铁情况下生长停滞,且逐渐获得与低氧生长条件下相似的休眠表型。与野生型和铁储存蛋白bfrB回补菌株比较,M.tbbfrB基因缺失突变株表现出对小鼠肺部侵染毒力和持久性的降低[1]。此外,笔者团队前期在探讨M.tb感染与机体铁代谢水平的研究中也同样发现,铁过载M.tb感染小鼠肺、脾脏和肝脏等组织器官荷菌量及结核病理性改变均明显高于单纯M.tb感染对照组[2]。这些结果均表明宿主铁水平与M.tb的毒力及其在宿主体内复制之间存在关联,提示宿主铁代谢相关基因可能成为抗结核新靶点。
转铁蛋白受体(transferrin receptor,TfR),即CD71分子,是一种Ⅱ型跨膜糖蛋白,由两个同源二聚体的亚基通过两条二硫键交联而成[3,4]。TfR主要功能是通过与转铁蛋白(transferrin,Tf)相互作用参与和介导铁的吸收,是细胞铁稳态的关键调节器[5,6]。目前已发现两种TfR,即在结构和功能上都比较相似的转铁蛋白受体1(transferrin receptor 1,TfR1)和转铁蛋白受体2(transferrin receptor 2,TfR2)。TfR1被广泛关注并大量报道与贫血、神经退行性疾病以及癌症等的发生有关,在非小细胞肺癌、乳腺癌和肾癌中,肿瘤细胞过表达TfR1后对铁元素的吸收速度加快,而相应的患者预后也表现较差[7~11]。同时,越来越多的报道显示,TfR1的异常表达与传染性疾病的发生、发展也同样密切相关,且研究主要围绕病原菌感染与宿主细胞铁代谢稳态间的相互影响。
本研究则在前期的基础上通过细胞水平探讨铁吸收代谢相关受体TfR1与M.tb胞内生存关系,进一步明确TfR1在M.tb感染期间的作用机制,为TfR1成为抗结核潜在新靶点奠定研究基础。
材料与方法
1.细胞、菌株与动物:RAW 264.7小鼠单核-吞噬细胞白血病细胞由笔者所在实验室保存。M.tb标准株H37Rv(菌株号:93009)和耻垢分枝杆菌(Mycobacteriumsmegmatis,M.smegmatis)由笔者所在实验室保存。6~8周龄SPF级雌性C57BL/6N小鼠,体质量为18~20g,购自北京维通利华实验动物技术有限公司[SCXK (京)-2016-0006]。
2.主要试剂:右旋糖酐铁注射液购自江西创导动物保健品有限公司,山羊血清、DAB显色试剂盒购自北京Solarbio公司,GAPDH一抗、TfR1一抗、HRP酶标二抗购自英国Abcam公司,PVDF膜、HRP ECL发光液购自德国Millipore公司,TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒和2×TransTaq®High Fidelity (HiFi) PCR SuperMix Ⅱ (-dye)试剂盒购自北京TransGen Biotech公司,FITC荧光染料购自美国Thermo Fisher公司,Trypsin-EDTA (0.25%)、DMEM培养基购自美国Gibco公司,中性罗氏培养管购自珠海贝索生物技术有限公司。
3.铁过载小鼠模型的建立:采用完全随机法将20只C57BL/6N小鼠随机分为阴性对照组、低剂量组、中剂量组和高剂量组,每组5只。低、中、高剂量组分别经腹腔注射右旋糖酐铁3.75、7.50、15.00毫克/次,阴性对照组则经腹腔注射等体积0.9%NaCl注射液,3 次/周,共计4周。定期观察小鼠生长及精神状态,称重并记录。
4.铁过载小鼠模型M.tb感染:采用完全随机法将24只C57BL/6N小鼠随机分成铁过载M.tb感染组、M.tb感染组、铁过载模型组和正常对照组,每组6只。其中,M.tb感染小鼠经尾静脉注射100μl 1×106CFU/ml对数生长期H37Rv单细胞菌悬液,空白对照组注射等剂量0.9%NaCl注射液。ABSL-3实验室正常饲喂,观察并记录小鼠临床表现,感染后4周解剖小鼠。
5.肺部切片免疫组织化学分析:肺组织切片置于耐高温玻片架,pH值6.0柠檬酸盐缓冲液没过玻片,微波加热至沸腾进行抗原修复。滴加3% H2O2溶液覆盖切片,室温避光孵育10min后PBS洗涤3次。滴加500μl山羊血清,37℃封闭15min。每张切片滴加300μl按1∶1000稀释的抗TfR1一抗,37℃孵育1h后PBS洗涤3次,随后滴加300μl按1∶10000稀释的HRP酶标二抗,37℃孵育30min后PBS洗涤3次。每张切片滴加500μl新鲜配制的DAB染色液,室温避光孵育10min,流水漂洗终止显色反应。苏木精复染后经梯度乙醇脱水干燥,二甲苯透明,中性树胶封固后观察。
6.TfR1免疫印迹与qPCR分析:取10μl肺组织研磨液上清及蛋白相对分子质量标准至SDS-PAGE胶进行电泳分离,采用半干法将蛋白分子转移至PVDF膜。TBST清洗PVDF膜3次,5% BSA溶液室温封闭1h。PVDF膜经1∶1000稀释的抗TfR1一抗4℃孵育12h,TBST清洗3次,1∶5000稀释的HRP酶标二抗37℃孵育3h后进行显影检测。无RNase水调平反转录合成的cDNA模板浓度,按20μl反应体系中10μl SuperMix,6.5μl去离子水,3μl 10倍稀释的cDNA模板和0.5μl引物进行扩增。以GAPDH为内参基因,按95℃预变性4min,94℃变性30s,60℃退火30s,72℃延伸45s,循环35次,72℃后延伸10min的反应条件进行TfR1基因扩增。
7.RAW 264.7巨噬细胞吞噬与杀伤实验:FITC标记的M.smegmatis以MOI 5分别与巨噬细胞共孵育1、2和4h,弃培养上清,PBS洗去胞外未吞噬菌株。每孔加入200μl 0.25%胰酶37℃消化5min,加入500μl DMEM完全培养基中和胰酶,吹散至单个细胞悬液。转移至流式检测管,室温300×g离心5min、PBS洗涤,甲醛固定后进行流式细胞术分析。M.smegmatis以MOI 5与巨噬细胞共孵育进行体外感染,感染24h、48h和72h后PBS洗去胞外未吞噬菌株。每孔加入500μl 0.05% SDS裂解液,吹打混匀,裂解细胞1min。10倍倍比稀释裂解液,分别取10-2、10-3和10-4稀释液50μl均匀涂布于中性罗氏培养管,37℃培养并计算菌落数。
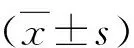
结 果
1.铁过载小鼠肺组织TfR1未见明显增加:如图1A所示,不同剂量铁过载小鼠肺部切片免疫组织化学分析发现,TfR1在低剂量、中剂量和高剂量铁剂小鼠肺组织中表达水平未见显著升高,与阴性对照小鼠肺组织比较无明显变化。进一步通过蛋白质免疫印迹技术对不同剂量铁过载小鼠肺组织研磨液上清中TfR1表达丰度进行分析,结果同样发现低剂量、中剂量和高剂量铁剂小鼠肺组织TfR1表达水平与阴性对照小鼠差异无统计学意义(P均>0.05,图1C)。
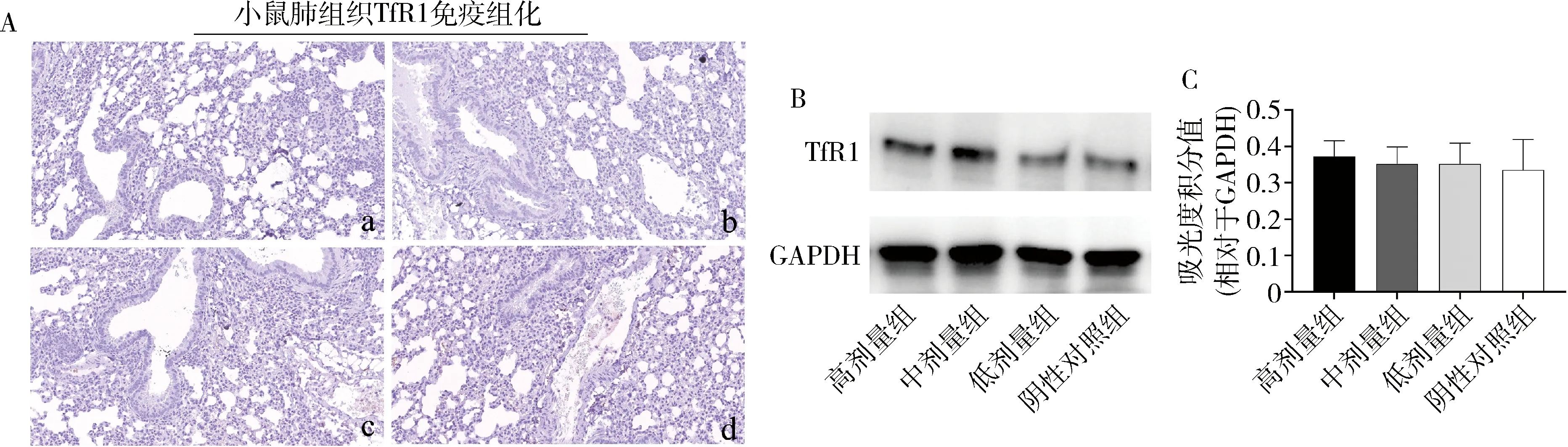
图1 铁过载小鼠肺组织TfR1表达丰度检测A.不同剂量铁过载小鼠肺组织TfR1免疫组化分析(×20)。其中a为阴性对照组,b为低剂量组,c为中剂量组,d为高剂量组;B.不同剂量铁过载小鼠肺组织研磨液上清TfR1免疫印迹检测;C.不同剂量铁过载小鼠肺组织研磨液上清TfR1免疫印迹检测吸光度积分定量分析
2.M.tb感染增加小鼠肺组织TfR1表达:与正常对照小鼠和铁过载模型小鼠比较,M.tb感染后小鼠肺组织TfR1表达水平均有所增加(图2A),且在铁过载M.tb感染小鼠中增加最为显著(图2A)。同时,不同组别小鼠肺组织研磨液上清中TfR1蛋白质免疫印迹显示,表达丰度由高至低依次为铁过载M.tb感染小鼠、M.tb感染小鼠、铁过载模型小鼠及正常对照小鼠,且前两者肺组织TfR1表达丰度显著高于后两者,且差异有统计学意义(P均 < 0.05,图2B)。进一步提取各组小鼠肺组织总RNA并进行TfR1基因qPCR验证,显示铁过载M.tb感染小鼠和M.tb感染小鼠肺组织TfR1在基因表达水平上也显著高于铁过载模型小鼠及正常对照小鼠(P均<0.05,图2C)。
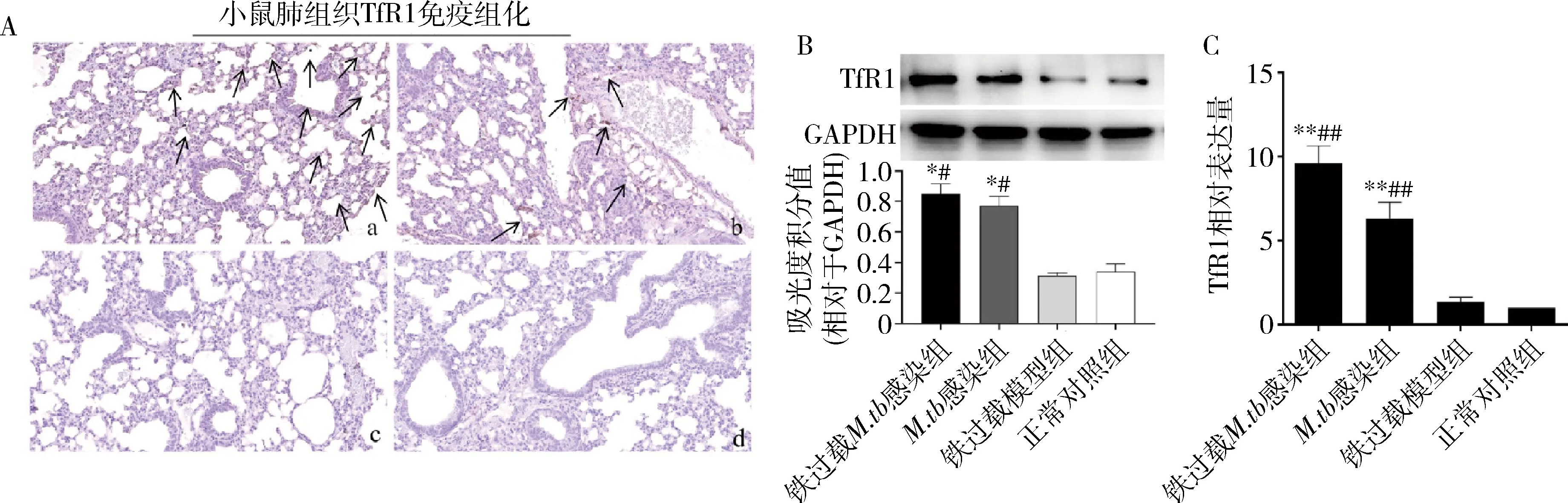
图2 M.tb感染小鼠肺组织TfR1表达丰度检测A.不同实验组小鼠H37Rv感染后肺组织TfR1免疫组化分析(×20)。其中a为铁过载M.tb感染组,b为M.tb感染组,c为铁过载模型组,d为正常对照组;B.不同实验组小鼠H37Rv感染后肺组织TfR1免疫印迹检测及吸光度积分定量分析;C.不同实验组小鼠H37Rv感染后肺组织TfR1基因qPCR检测;与铁过载模型组比较,*P<0.05,**P<0.001;与正常对照组比较,#P<0.05,##P<0.001;箭头指示为TfR1免疫组化阳性反应
3.TfR1缺失对巨噬细胞吞噬功能无影响:siRNA技术构建TfR1-/-RAW 264.7巨噬细胞系,以FITC标记的M.smegmatis进行吞噬实验。流式细胞术检测结果显示(图3),TfR1基因缺失对RAW 264.7巨噬细胞吞噬功能无显著性影响。FITC-M.smegmatis以MOI 5与RAW 264.7巨噬细胞共孵育1h、2h和4h后,TfR1-/-与TfR1+/+RAW 264.7巨噬细胞吞噬荧光菌株数量组间差异无统计学意义(图3A)。共孵育2h时,TfR1-/-和TfR1+/+RAW 264.7巨噬细胞吞噬FITC-M.smegmatis的细胞占比分别为38.9%和37.8%,空白对照组为0.79%(图3B)。
图3 下调TfR1表达对RAW 264.7巨噬细胞吞噬功能的影响A.a至c依次为TfR1-/-与TfR1+/+RAW264.7巨噬细胞与FITC-M.smegmatis共孵育1、2和4h后,吞噬细胞流式计数结果;B.a至b依次为FITC-M.smegmatis与TfR1-/-及TfR1+/+ RAW264.7巨噬细胞共孵育2h后含荧光菌株的细胞占比,c为阴性对照
4.TfR1缺失增强巨噬细胞的杀伤功能:siRNA技术构建TfR1-/-RAW264.7巨噬细胞系,M.smegmatis分别感染TfR1-/-和TfR1+/+RAW 264.7巨噬细胞进行杀伤功能分析。感染后24h、48h和72h,TfR1-/-RAW 264.7巨噬细胞杀伤功能明显优于TfR1+/+RAW 264.7巨噬细胞,不同杀伤时间点其残余的M.smegmatis活菌数显著低于后者,且差异有统计学意义(P均<0.05,图4)。
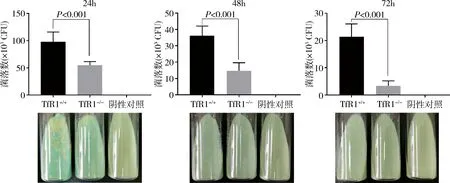
图4 下调TfR1表达对RAW264.7巨噬细胞杀伤功能的影响从左至右依次为TfR1+/+与TfR1-/-RAW264.7巨噬细胞分别感染M.smegmatis 24、48和72h后残余活菌菌落计数结果
讨 论
细菌致病期间需要铁,尤其是胞内病原菌。体内外实验表明,铁元素缺失会严重降低热柯克斯体、嗜肺军团菌、鼠伤寒沙门菌及其他胞内菌的致病性[12]。事实上很多物种也采用在感染期间以扣留游离铁作为主要的防御策略[13]。铁与Tf和铁蛋白(ferritin,Fn)这类转运和储存蛋白相结合不仅解决了可溶性问题,而且限制了入侵病原菌对铁元素的利用。然而,M.tb在长期的进化过程中形成了一套特殊的铁摄取系统来完成自身对铁元素的需求。当机体感染了M.tb以后,一方面,M.tb为了自身的生存需要从被感染的宿主获得一定量的铁元素,以保证其在宿主巨噬细胞内的生存和繁殖。另一方面,其通过产生炎性细胞因子影响铁反应元件(iron responsive element,IRE) 和铁调节蛋白(iron regulatory protein,IRP) 的结合活性,进而在转录后水平调控TfR1的表达,促使细胞增加对铁的摄取从而满足其胞内活性和生存所需铁元素(图5)。
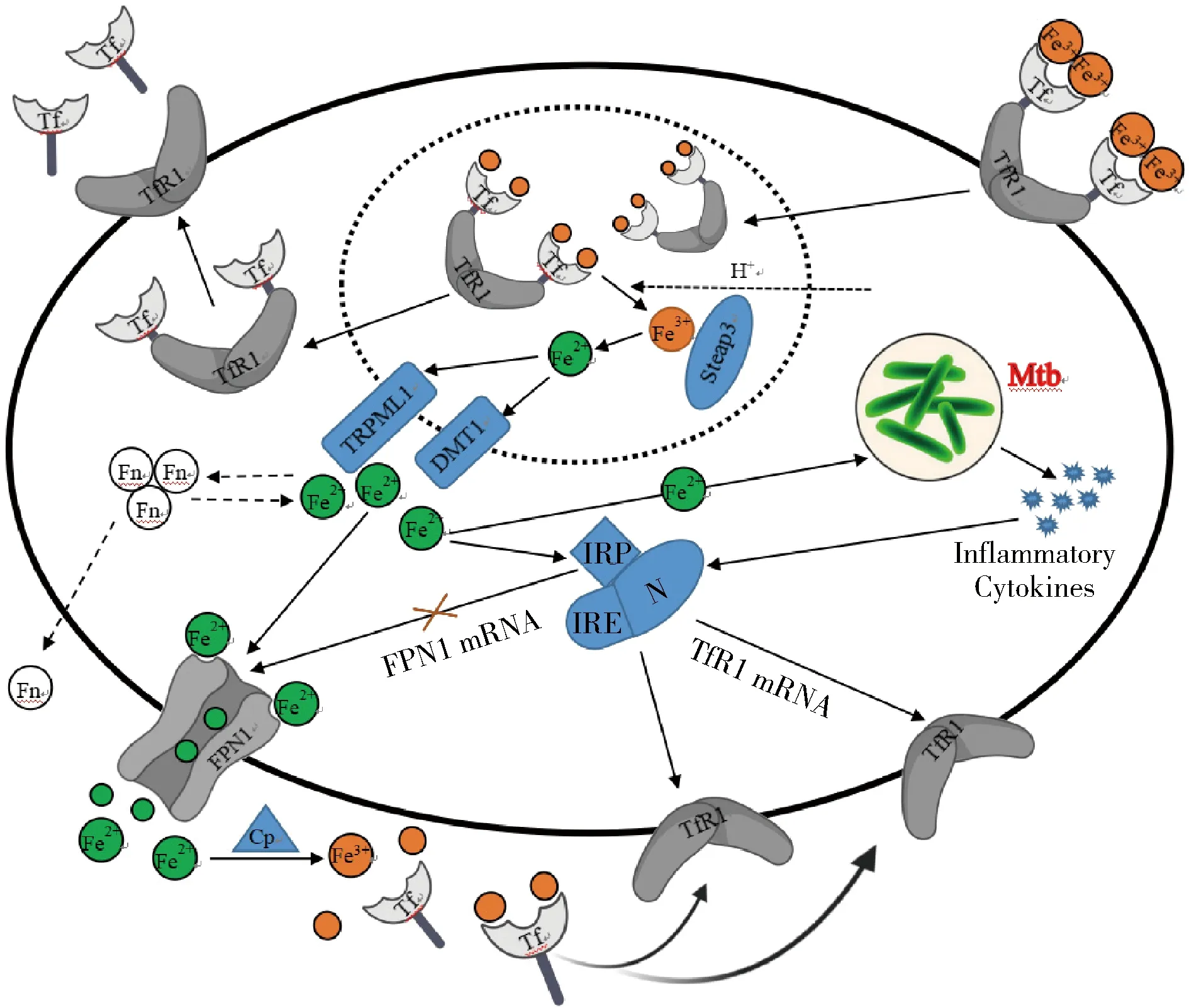
图5 M.tb感染对巨噬细胞铁代谢及TfR1表达的影响铁元素经TfR1吸收进入巨噬细胞,多余铁元素一方面以Fn形式储存或经FPN1泵出细胞外,另一方面满足胞内M.tb生长繁殖。同时,M.tb感染后产生炎性细胞因子影响IRE和IRP的结合活性,从而在转录后水平调控TfR1的表达。TfR1.转铁蛋白受体1;Tf.转铁蛋白,Fe3+.三价铁离子;Fe2+.二价铁离子;Steap3.金属还原酶家族STEAP;Fn.铁蛋白;TRPML1.瞬时受体电位通道;DMT1.二价金属离子转运蛋白;IRE.铁反应元件;IRP.铁调节蛋白;FPN1.膜铁转运蛋白1;Cp.铜蓝蛋白;M.tb.结核分枝杆菌;mRNA.信使RNA
正常细胞铁代谢过程中,位于细胞膜的TfR1可以识别Tf,将Tf-Fe3+复合物转运入细胞内,Fe3+被Steap3还原成Fe2+,再由二价金属离子转运蛋白(divalent metal transporter 1,DMT1)和瞬时受体电位通道(transient receptor potential channels,TRPML1)运送到细胞内铁池供细胞利用。铁池中一部分铁被氧化为Fe3+由Fn储存于细胞内,剩余的铁被膜铁转运蛋白(ferroportin 1,FPN1)泵出细胞外,维持细胞内铁的稳态。细胞膜上TfR1的表达受细胞内铁水平的影响和调节,当细胞内铁缺乏时,TfR1 mRNA的稳定性增加,使TfR1表达增加,从而增加细胞对铁的摄取[14,15]。因此,TfR1水平反映了机体和细胞对铁的需求[16~18]。
笔者团队前期在铁过载小鼠模型的研究中发现,不同剂量铁剂构建的铁过载模型小鼠与正常对照小鼠中外周血可溶性TfR均未见明显改变,而本研究也同样发现该两组小鼠肺组织TfR1表达也均未见明显增强[2]。相反,M.tb感染后该两组小鼠肺组织TfR1表达丰度均显著上调,且铁过载M.tb感染小鼠TfR1表达丰度显著高于M.tb感染小鼠组,这表明,M.tb感染导致小鼠肺部细胞上调表达TfR1以促进宿主细胞对铁的吸收,从而满足M.tb胞内生长繁殖所需铁元素,抑制TfR1表达则可能影响细菌在细胞内的生长与生存。而这些研究结果与有关文献报道分枝杆菌和埃立克体这类胞内病原菌主动招募TfR1至含菌囊泡影响宿主细胞内铁池的动态和存储相一致[19,20]。
为了进一步明确TfR1在M.tb感染期间的作用,笔者团队在细胞水平上进行了相关实验。用小干扰RNA下调RAW264.7巨噬细胞TfR1的表达,进而用FITC-M.smegmatis分别感染TfR1表达下调细胞和未转染正常细胞,并进行FITC荧光菌株吞噬计数。结果显示,在分别感染1、2和4h后,TfR1表达下调的细胞内荧光细菌数与未转染正常细胞差异无统计学意义。但杀伤实验中,M.smegmatis分别感染24、48和72h后,TfR1下调样本中残留活菌数明显低于未转染正常细胞。这些结果说明在感染早期TfR1参与了M.tb的侵染,这可能与M.tb获取铁以利其在胞内生存有关,TfR1的下调不影响M.tb的入侵,但抑制细菌其在细胞内的生长与增殖。
依赖于TfR1的铁摄取对于机体而言是必需的,TfR1基因敲除纯合子小鼠在胚胎期即死亡[21]。因此,本研究针对TfR1仅进行了细胞水平的初步探讨,而为了进一步验证TfR1的下调表达是否降低M.tb感染宿主铁水平,从而抑制体内M.tb生长这一假设,则应该构建TfR1基因敲除杂合子小鼠TfR1-/+,从动物水平上评价TfR1在M.tb感染期间的作用。通过体内实验证实TfR1下调导致机体铁摄取障碍,从而抑制体内M.tb增殖的分子机制,为TfR1作为抗结核感染新靶点提供实验依据。

