多肽添加水平对刺参生长性能、免疫及肠道功能基因表达的影响
李 晓 王 颖* 姜晓东 李红艳 纪 蕾 刘天红 孙元芹 刘洪军
(1.山东省海洋科学研究院,青岛266104;2.青岛市水产生物品质评价与利用工程研究中心,青岛266104;3.山东省海水养殖病害防治重点实验室,青岛266104)
刺参(Apostichopusjaponicus)是典型的温带物种[1],属于棘皮动物门(Echinodermata)、海参纲(Holothuroidea)、仿刺参属(Apostichopus)。刺参因其自身的营养价值、保健功能和药用功效,市场需求量不断增加,养殖规模不断扩大,近年来已成为我国单种水产养殖产值最高的经济品种之一[2]。规模化养殖一般采用配合饲料投喂刺参[3]。蛋白质作为刺参配合饲料的重要成分,能显著提高刺参的特定生长率(SGR)[4],直接影响刺参的生长性能和饲料成本。目前,刺参饲料的蛋白质来源以鱼粉为主。多肽作为蛋白质水解的中间产物,由2个及以上氨基酸分子(通常10~100个)脱水缩合而成,是一种优质的蛋白质原料,已被证实能促进欧洲鲈鱼[5]、凡纳滨对虾[6]、大菱鲆[7]等水生动物的生长,同时还可提高凡纳滨对虾等的非特异性免疫和抗病能力[6],但添加到刺参饲料中的报道较少。
前期研究通过营养和免疫水平上证实了多肽能有效提高刺参的特定生长率,增强自身的非特异性免疫[8],但关于多肽激发机体生长及影响免疫系统的机制尚不清楚。近年来,分子生物学手段快速发展,使得其成为探究多肽对刺参生长和免疫机理影响的一种有效途径。目前已对刺参的生长性状进行了数量性状位点(QTL)分析,定位了与体长、体宽、体质量、体壁质量和出肉率等相关的21个QTL[9];构建了刺参再生时肠道和体壁的大规模基因表达谱[10];利用刺参遗传图谱,分析了刺参夏眠发育相关的转录组[11]。尤其是分析了不同月龄刺参的组织中腱生蛋白、胶原蛋白α2、整合素αV和整合素βL基因的分布及表达量[2],克隆了刺参核因子-κB(NF-κB)信号通路的3个基因:p105、p50、rel[12],还对比了不同添加物对刺参肠道免疫基因p105、p50、rel和lysmRNA表达的影响[13]。
肠道作为刺参体腔内最主要的器官,占据了体腔绝大部分空间。刺参一般以海洋沉积物中的有机物作为营养物质,肠道是其内外环境物质交换的渠道,用于消化食物和吸收营养,另外还可保护刺参免遭病原入侵[14],备受免疫学研究关注[15-16]。Dalmo等[17]研究认为饲料中添加免疫增强剂能够提高肠道免疫反应,提升水产养殖动物的抗病力,进而保护水产动物免受致病原的入侵。但是有关刺参肠道免疫调控的规律及其原理仍处于未知。鉴于此,本研究探讨了多肽对刺参肠道中生长类基因——腱生蛋白、胶原蛋白α2、整合素αV和整合素βL,以及细胞免疫基因——p105、p50、rel和体液免疫基因——lys相对表达量的影响,旨在探索多肽对刺参生长性能的影响以及其免疫调控的规律,进而为刺参养殖业的可持续发展提供技术支持和科学依据。
1 材料与方法
1.1 试验材料
试验用刺参[体重为(35.40±1.58) g]购自青岛昊睿源水产苗种养殖有限公司;鳀鱼购自威海恒欣源水产有限公司;碱性蛋白酶购自南宁庞博生物工程有限公司;马尾藻采自山东荣成俚岛潮间带(2020年6月),烘干,粉碎,过80目筛备用;海泥采自即墨鳌山卫。
多肽制备方法:鳀鱼清洗切块,0.6 mol/L NaHCO3脱脂10 h后,碱性蛋白酶1.5%(w/v)(料液比1∶10),保持pH 8.0,在50 ℃酶解6 h。酶解结束后,100 ℃灭酶15 min,冷却后调节pH至中性,8 000 r/min离心15 min,浓缩上清液,经喷雾干燥后,制得小分子质量多肽的混合物,即为本试验用多肽。多肽的有效含量为70%,平均分子质量为424 u,其中>3 000 u占比0.19%,3 000~2 000 u占比0.81%,2 000~1 000 u占比6.45%,1 000~500 u占比21.24%,500~180 u占比50.74%,<180 u占比20.58%。表1为制备多肽中含量较高的前10条肽段。

表1 多肽的主要肽段序列
1.2 试验设计
挑选300头刺参在暂养池中驯化7 d以适应环境,之后将其随机分为5组(分别为D1、D2、D3、D4、D5组),每组3个重复,每个重复20头。试验饲料组成及营养水平见表2。各原料按照配比混匀后,添加3倍质量的海泥,加入20%的水,加工制成颗粒饲料(直径0.4 mm,长10 mm),烘干备用。试验周期60 d。

表2 试验饲料组成及营养水平(干物质基础)
1.3 饲养管理
整个试验在室内自然光照条件下进行,期间保持充氧,养殖水体160 L,水温保持在(15.0±0.5) ℃,盐度28~30, pH 7.8~8.2。于每天的09:00投饵1次,投饵量为刺参体重的2%~3%,每10 d调整1次投饵量。每日投饵20 h后,采用虹吸法将粪便和残饵吸出备用,同时更换养殖用水,换水量为养殖水体的1/3。每10 d全部更换养殖用水,并彻底清洗水箱,以保证水质清洁。收集得到的残饵和粪便于60 ℃烘干保存。
1.4 样品采集及指标测定
1.4.1 生长性能指标
暂养结束后,正式试验开始前,随机抽取10头刺参,作为初始样品;养殖试验结束后,刺参饥饿48 h,随机从各水箱内抽取10头刺参,作为终末样品。
湿重测定:称重时用捞网沥净刺参水分,之后将刺参放置在干滤纸上30 s后,称重。为减小操作误差,测定过程均由固定人员操作。
干重测定:将已测定湿重的刺参65 ℃下烘干8 h后,称重。
刺参的SGR、摄食率(FR)计算公式[18]如下:
SGR(%/d)=[(ln终末干重-
ln初始干重)/投喂时间]×100;
FR(%)=饵料干重/[投喂时间×
(终末干重+初始干重)/2]。
1.4.2 免疫指标及抗氧化指标
养殖试验结束后,将每个重复的6只刺参转移到无菌培养皿中。在刺参腹部做1 cm的切口,采用无菌注射器从切口处收集体腔液,并将每组的体液样品彻底混合。4 ℃、2 000×g离心30 min,取上清液-80 ℃下储存,用于检测刺参的免疫及抗氧化指标[19]。
选取酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)活性和总抗氧化能力(T-AOC)4个指标,利用酶活性检测试剂盒(南京建成生物工程研究所)进行测定,测定方法参照试剂盒说明书。
1.4.3 基因相对表达量
养殖试验结束后,从每个水箱中分别随机抽取5头刺参,解剖,将同一组刺参的中肠组织混合作为1个样品,液氮速冻,-80 ℃保存采用RNA isoPlus(TaKaRa)提取刺参中肠肠道组织的总RNA,总RNA的完整性和纯度用凝胶电泳检测。按照PrimeScriptTMRT试剂盒(TaKaRa)操作说明合成cDNA第一链。
采用SYBR Green方法利用荧光定量PCR仪对生长基因(腱生蛋白、胶原蛋白α2、整合素αV、整合素βL)及免疫基因(p105、p50、rel、lys)的相对表达量进行检测,内参基因分别为细胞色素B和β-肌动蛋白(β-actin),基因引物序列见表3。定量PCR的体系包括:上、下游引物(10 μmol/L)0.5 μL,第一链cDNA 1 μL,2×SYBR Premix Ex TaqⅡ 5 μL和经焦碳酸二乙酯处理的超纯水(DEPC水)3 μL。采用95 ℃持续30 s 1个循环;95 ℃持续5 s,退火温度60 ℃持续30 s(40个循环),60~95 ℃持续10 min。绘制熔解曲线用于检验每个PCR反应只有1个PCR产物,结果采用2-ΔΔCt法,计算目的基因相对表达量。
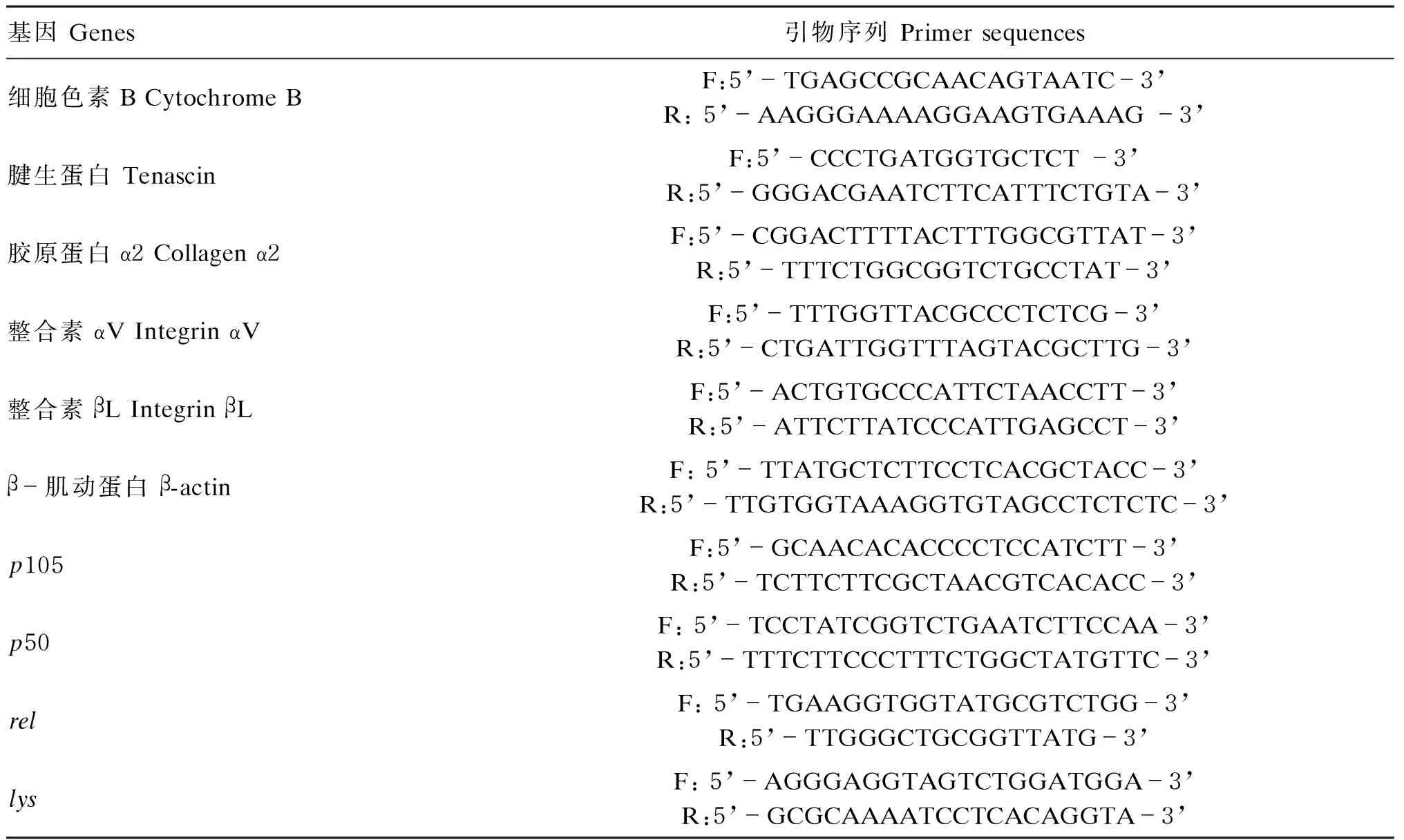
表3 内参和目的基因引物序列
1.5 数据统计分析
试验数据采用SPSS 16.0单因素方差分析(one-way ANOVA)和多重检验法(Duncan氏)进行统计分析,数据最终表示为平均值±标准误。
2 结 果
2.1 多肽添加水平对刺参生长性能的影响
由表4可知,刺参的SGR随着多肽添加水平的增加在不同组间呈现先上升后下降的趋势,D4组的刺参SGR显著高于其他组(P<0.05)。D4组的刺参终末湿重最高,但与D3组和D5组的结果差异不显著(P>0.05)。D4组的刺参终末干重最高,显著高于其他各组(P<0.05)。刺参的FR组间差异不显著(P>0.05)。

表4 多肽添加水平对刺参生长性能的影响
2.2 多肽添加水平对刺参免疫及抗氧化指标的影响
由表5可知,刺参体内T-AOC及SOD、ACP、AKP活性随着多肽添加水平的增加而升高。ACP和AKP活性最高出现在D5组,且D2、D3、D4和D5组中的酶活性显著高于D1组(P<0.05)。SOD活性、T-AOC最高出现在D5组,D2与D1组间差异不显著(P>0.05)。
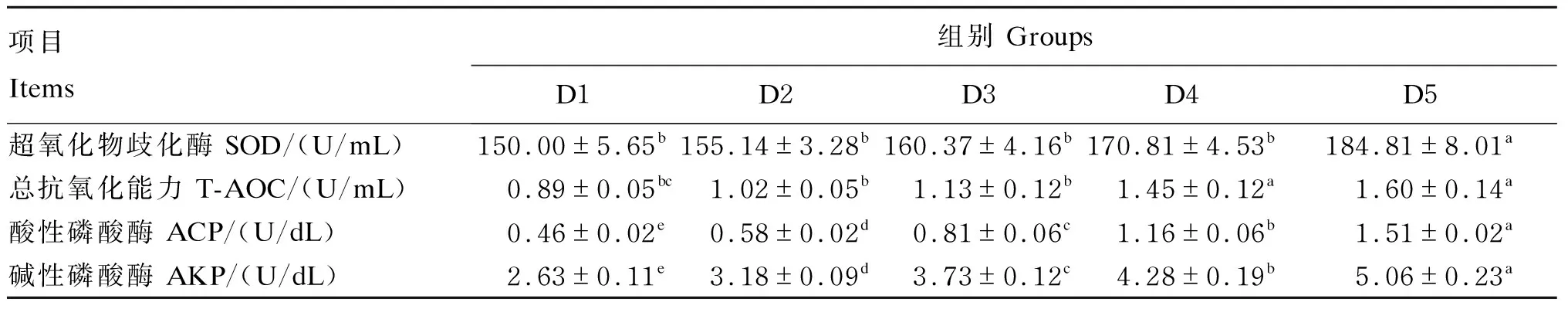
表5 多肽添加水平对刺参免疫及抗氧化指标的影响
2.3 多肽添加水平对刺参肠道生长相关基因表达的影响
由图1可知,4种基因在刺参肠道组织的表达呈现整体上调的趋势,基本都是在D4组时达到表达高峰,随后降低。在D3、D4、D5组腱生胶原蛋白基因相对表达量均显著高于D1组(P<0.05),分别提高了9.21%、16.88%、11.40%(图1-A);胶原蛋白α2基因相对表达量在D2、D3、D4、D5组均显著高于D1组(P<0.05),分别提高了2.76%、10.21%、19.16%、5.66%(图1-B);D3、D4、D5组整合素αV基因相对表达量均显著高于对照组(P<0.05),分别提高了15.32%、17.65%和14.51%(图1-C);D3、D4、D5组整合素βL基因相对表达量均显著高于D1组(P<0.05),分别提高了15.42%、16.71%和4.44%(图1-D)。
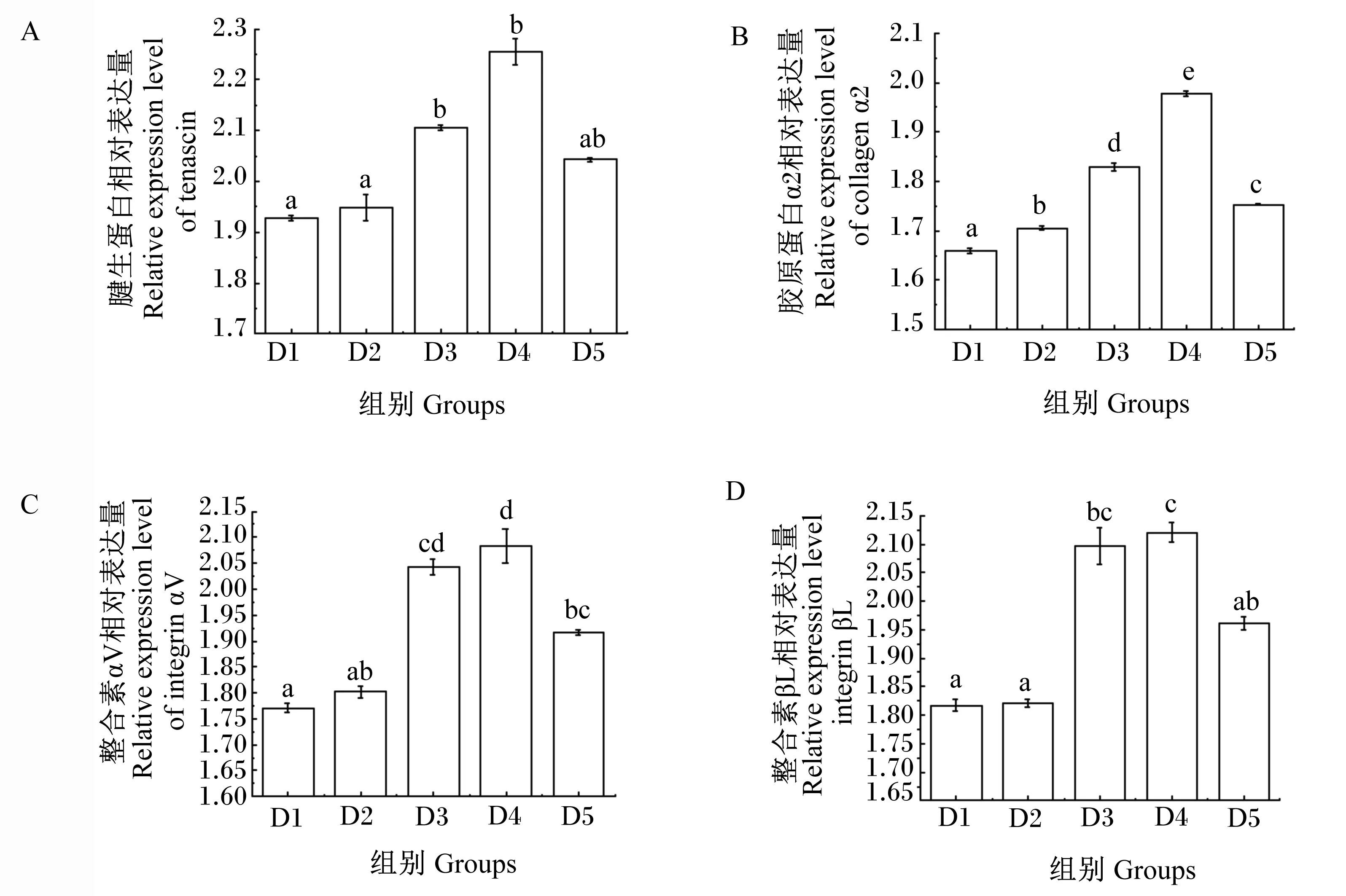
相同字母表示差异不显著(P>0.05),相邻字母表示差异显著(P<0.05),相间字母表示差异极其显著(P<0.01)。下同图。
2.4 多肽添加水平对刺参肠道免疫相关基因表达的影响
由图2可知,刺参肠道组织内p105基因表达水平呈现升高趋势,D2、D3、D4、D5组均显著高于对照组(P<0.05),分别提高了2.14%、5.22%、5.99%、8.98%,D3和D4组差异不显著(P>0.05)(图2-B);p50基因相对表达量呈现升高趋势,D4、D5组均显著高于D1组(P<0.05),分别提高了2.68%和6.34%,D1、D2和D3组差异不显著(P>0.05)(图2-C);lys基因表相对表达量呈现升高趋势,D2、D3、D4、D5组均显著高于D1组(P<0.05),分别提高了8.09%、12.82%、13.71%和4.44%,D3、D4和D5组间差异不显著(P>0.05)(图2-D)。
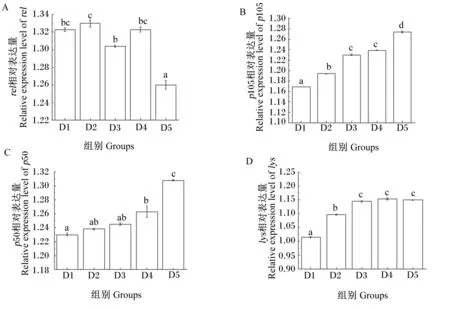
图2 多肽添加水平对刺参肠道免疫相关基因表达的影响
3 讨 论
3.1 多肽片段的特征分析
试验制备得到的多肽有效含量为70%,平均分子质量为424 u。多肽中含量较高的前10条肽段中,赖氨酸(Lys)、精氨酸(Arg)、脯氨酸(Pro)及亮氨酸(Leu)在肽段序列末端重复出现。这与Li等[20]的研究结果相似,Li等[20]发现在鳕鱼来源的多肽片段中,Lys重复出现在肽段序列末端,同时,对大鼠肠黏膜具有免疫功能的多肽序列几乎都含有疏水性氨基酸,且大部分都作为肽链的N端出现。这与Tzehoval等[21]研究一致,具有高免疫活性多肽的N-末端均为疏水性氨基酸。本研究制备的多肽对促进刺参生长及免疫有一定的功效,可能也与其肽段组成及序列有关。多肽的分子质量分布能影响欧洲黑鲈(Dicentrarchuslabrax)[22]及海鲷(Sparusaurata)[23]等的生长性能和品质,饲料中的多肽被进一步水解成游离氨基酸吸收,或者以完整形式被直接吸收,低分子质量的多肽更有利于这些鱼类的生长。
3.2 多肽对刺参生长性能的影响
尽管目前已有海洋多肽对水生动物的生长、发育、免疫调节等有促进作用的报道[5-7,23],但多肽应用于刺参养殖的研究较少。本研究试验期间没有刺参死亡,各组刺参的体重均出现显著增长,表明试验饲料有利于刺参的存活与生长。适量的多肽有效地提高了刺参的特定生长率,而超过适宜添加量后,刺参的SGR会呈现下降趋势。这与很多其他必需营养元素类似,如蛋白质[24]和碳水化合物[19]。多肽的吸收一般有2种途径:有些多肽无需降解,可被直接吸收;有些则需要被胰蛋白酶和肠肽酶水解后才能被吸收。被吸收的多肽进入肠黏膜运输后,可直接参与生理活动、代谢调节,并促进生长[25]。体质量在24.51 g左右的刺参在投喂不同水平多肽后,各组间FR存在显著差异[8],本研究采用的刺参初始体质量在35.40 g左右,虽然适当添加多肽能一定程度上降低刺参的FR,但是各组间FR差异不显著, 可能与两者所采用的刺参个体大小不同有关。本研究表明,饲料中添加适当的多肽(10%~15%)能有效提高刺参的生长性能,一定程度上降低刺参的FR。
3.3 多肽对刺参免疫及抗氧化指标的影响
体腔液中T-AOC及SOD、ACP和AKP活性随着多肽添加水平的增加呈升高趋势,表明酶解得到的低分子质量多肽混合物,对部分活性氧自由基具有强力的清除作用,有利于提高刺参的抗氧化能力,同时还能增强刺参的非特异性免疫。由于刺参只具有非特异性免疫,因此体液在细胞免疫和体液免疫中具有关键作用[26]。体液中的这些免疫及抗氧化指标(SOD、ACP和AKP等)在刺参体液免疫中具有不可替代的作用。SOD是生物体清除活性氧、免受细胞氧化伤害的主要抗氧化酶类,在防御机体衰老和生物分子损伤等方面有着极为重要的作用[19]。ACP和AKP可以杀死侵袭性病原体,改变致病性分子表面以加速其吞噬和降解[27]。两者在刺参抗病、免疫反应、细胞损伤和修复中起着至关重要的作用[28]。李日美等[6]发现在凡纳滨对虾幼体中添加10~20 g/kg的小肽可提高其生长速度,并提高其非特异性免疫和抗病能力。Wang等[26]采用注射法发现小肽能提高刺参SOD、ACP、AKP活性,细胞吞噬和呼吸爆发力在第4天达到最大值。多肽的抗氧化机制较为复杂,有些可以直接促进抗氧化酶的活性,有些则需要通过特殊基团与自由基结合,利用还原作用达到直接消除自由基的目的。本研究制备的低分子质量多肽混合物对刺参非特异性免疫有增强作用,充分说明此多肽具有高免疫活性,一定程度上与肽段的氨基酸组成及序列有关。另外,非特异性免疫的提高能一定程度上增强刺参的抗病力。
3.4 多肽对刺参肠道内生长相关基因表达量的影响
饲料中的成分能一定程度上影响水生动物体内的基因表达。Liu等[29-30]报道饲料中的游离氨基酸、肽和蛋白质能够调节肽转运蛋白(PepT1)的表达,从而直接/间接的影响鱼类的生长性能。当大西洋鳕鱼(Gadusmorhua)的饲料中含有不同比例的鱼蛋白水解物或游离氨基酸时,它将改变肠道中的区域PepT1表达谱[31]。腱生蛋白、胶原蛋白α2、整合素αV和整合素βL基因在机体生命活动中能够参与多种过程,具有广泛的组织分布。腱生蛋白的主要作用是加强结缔组织,调节细胞形态。胶原蛋白是最主要的结构蛋白[32],占总蛋白含量的70%左右。整合蛋白由α亚单位和β亚单位通过非共价键连接,能够介导细胞和细胞间以及细胞和细胞外基质间的相互识别和黏附[33],进而联系细胞外部与细胞内部结构。结果表明,这4种生长基因在刺参肠道中的总体表达量随着多肽添加水平的增加呈现先上升后下降的趋势,规律与SGR基本一致。腱生蛋白基因上调,能够提高刺参的再生能力;胶原蛋白α2基因的表达上调,会促进α2胶原蛋白的合成作用,从而提高胶原蛋白含量;通过整合素αV基因参与细胞增殖与分化,β整合素基因抑制细胞凋亡[34],两者结合可调控肠道再生,同时也会在免疫反应中起到抑制剂的作用。适量的多肽能够通过上调刺参蛋白类基因的表达,对刺参再生及体壁生长等进行调节,进而达到促进刺参生长,但对于各基因的联动影响机制还有待进一步研究。
3.5 多肽对刺参肠道内免疫相关基因的影响
刺参体内的p105、p50、rel是NF-κB信号通路的重要基因。NF-κB信号通路能激活机体非特异性免疫反应,通路中的转录因子可以被多种刺激物激活,进而参与诱导包括溶菌酶在内的150多种目的基因的表达[35]。转录因子p105/p50和rel均具有N端rel同源结构域(RHD),可以通过该结构与DNA结合,调控各种下游诸如趋化因子、细胞因子、溶菌酶和黏附因子等重要免疫因子的表达[13]。本研究结果表明多肽能显著提高刺参肠道组织中p105和p50基因相对表达量,但对rel基因相对表达量影响不显著,因此推测p105/p50可能属于限制性因子,而rel则可能是一个非限制性因子,与之前阳刚等[13]研究结果一致。在刺参的NF-κB信号通路中,转录因子rel可以分别和p105和p50形成二聚体,而且一旦p50和rel进入核内后可形成二聚体,调控相关基因的表达[12]。溶菌酶能够切断肽聚糖中N-乙酰胞壁酸和N-乙酰氨基葡萄糖间的β-1,4糖苷键,加速细菌溶解死亡,从而清除侵入体内的病原菌[36]。多肽的添加显著提高了刺参肠道内溶菌酶基因lys的表达,表明多肽可以加强NF-κB信号通路的转导,调控下游包括lys在内的相关免疫基因的表达来提高肠道的免疫反应,最终达到增强仿刺参的非特异免疫的作用。
4 结 论
本试验研究结果表明,饲料中添加10%~15%低分子质量的多肽可以显著提高刺参的SGR,降低刺参对饵料的FR,同时多肽能上调肠道内生长类基因的表达进而促进刺参生长,上调免疫类基因的表达提高刺参自身免疫力。

