TrkB抑制剂对前列腺癌细胞生物学效应及VEGF表达的影响*
张帆, 汪锋, 钗丽干, 都吉雅, 崔宏伟, 苏依图
(1.内蒙古自治区人民医院 病理科, 内蒙古 呼和浩特 010017; 2.内蒙古自治区人民医院 临床医学研究中心, 内蒙古 呼和浩特 010017)
肿瘤新生血管的形成被公认为是恶性肿瘤发生侵袭和浸润的首要因素[1]。肿瘤内部血管的形成对肿瘤的生长具有重要作用,能够为肿瘤组织提供新陈代谢所必需的氧气和营养,从而使肿瘤得以迅速地生长,并同时为肿瘤的远端转移提供转运途径。影响肿瘤血管新生的因素较多,目前已经证实血管内皮生长因子(vascular endothelial growth factor, VEGF)在肿瘤的侵袭和转移中发挥了重要作用[2]。相关研究发现,多种肿瘤组织中都存在VEGF高表达的现象,且VEGF的表达水平与肿瘤内微血管的密度、肿瘤血管的生长状态等均密切相关[3]。酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)是原癌基因Trk编码的神经营养酪氨酸激酶受体家族成员, 是脑源性神经生长因子(brain-derived neurotrophic factor, BDNF)的特异性受体[4-5],研究表明TrkB在许多人类肿瘤中过度表达,突变的信号转导通过TrkB促进肿瘤的形成、扩散和转移,并导致抗肿瘤抵抗事件发生;亦有研究表明TrkB-BDNF受体-配体复合物与肝细胞癌、卵巢癌、神经母细胞瘤等多种肿瘤的临床分期、转移、预后具有显著的相关性[6-8]。为了进一步探讨TrkB是否能够通过调控前列腺癌细胞中VEGF的表达而影响肿瘤细胞的增殖、侵袭及转移,本研究应用酪氨酸激酶抑制剂(K252a)进行干预,分析了TrkB抑制剂对前列腺癌细胞生物学效应及VEGF表达的影响,旨在为研究前列腺癌血管生成的机制,以及前列腺癌的相关理论研究和实验研究提供基础。
1 材料与方法
1.1 材料
1.1.1主要试剂 人前列腺癌PC3细胞(内蒙古医科大学附属医院临床中心试验机构提供);二甲基亚砜(dimethyl sulfoxide, DMSO)、无血清细胞冻存培养基-1640(roswell park memorial institute-1640,RPMI-1640;北京Solarbio),胎牛血清、胰蛋白酶、磷酸盐缓冲(上海LABIO),MTT试剂盒(美国BD Biosciences),Western-blot试剂盒(美国Sigma);TrkB、VEGF蛋白一抗、辣根过氧化物酶标记山羊抗兔二抗(美国Cell Signaling Technology),流式细胞检测试剂(美国Solarbio)。
1.1.2主要仪器 CO2细胞培养箱(美国赛默飞),电热干燥箱及恒温水浴箱(上海精宏),高速离心机、医用型生物洁净工作台、倒置显微镜(美国Thermo),酶标仪(美国DYNEX),倒置荧光显微镜(美国Nikon),流式细胞仪(美国BD),蛋白电泳仪、转膜仪(美国BIO-RAD),紫外分光光度计(上海仪天)。
1.2 研究方法
1.2.1细胞处理及分组 采用RPMI-1640培养液,于37 ℃、5%CO2细胞培养箱中培养,当细胞生长到60%~70%汇合时,应用0.25%胰蛋白酶将细胞消化为单细胞悬液,加入24孔板中,每孔1×104个细胞接种,置于37 ℃、5%CO2细胞培养箱中培养,当细胞生长贴壁后随机分为空白对照组、K252a干预组。
1.2.2四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法测定细胞增殖抑制率 空白对照组未作处理,K252a干预组进一步分为150 nmol/L、300 nmol/L、450 nmol/L及600 nmol/L K252a(200 μL)4个亚组,37 ℃、5%CO2细胞培养箱中继续培养24 h、48 h、72 h后,析出培养液,放置5 kg/L MTT 20 μL,孵育4 h,用移液器移去培养板中的液体,加入DMSO 150 μL充分溶解Formazan颗粒,避光摇动10 min;使用酶连免疫吸附实验检测490 nm波长处的吸光度(OD);计算各组前列腺癌PC3细胞在各时间点的增殖抑制率,细胞增殖抑制率(%)=(1-OD实验组/OD空白对照组)×100%;实验重复3次。
1.2.3Transwell检测细胞迁移数目 取对数生长期前列腺癌PC3细胞,调整细胞浓度为2.0×105/孔,将空白对照组、K252a干预组(450 nmol/L)各150 μL细胞悬液接种于Transwell小室,37 ℃、5%CO2细胞培养箱中培养0 h、12 h、24 h,后经多聚甲醛固定、磷酸盐缓冲液清洗。显微镜观察进行细胞计数:随机选取10个高倍视野(200×),计算穿过的细胞数;实验重复3次。
1.2.4流式细胞术检测细胞周期分布百分比 选取对数生长期的PC3细胞,经消化、离心后,接种于6孔培养板中,细胞数目5×105个/孔;置于37 ℃、5%CO2细胞培养箱中培养24 h,观察细胞贴壁后,加入450 nmol/L K252a设为K252a干预组,同时设空白对照组;48 h后离心并收集细胞,磷酸盐缓冲液冲洗2次后,转移至EP管中,加入70%预冷乙醇500 μL,4 ℃固定2 h;经磷酸盐缓冲液洗去固定液后,在细胞沉淀中加入RNaseA溶液100 μL,37 ℃水浴30 min,加入PI染色液,避光孵育30 min;经流式细胞仪收集细胞,于激发波长488 nm处检测;收集数据后经Flow Jo7.6软件进行分析。实验重复3次。
1.2.5流式细胞术检测细胞凋亡率 选取对数生长期的PC3细胞,经消化、离心后,接种于6孔培养板中,细胞数目5×105个/孔;置于37 ℃、5%CO2细胞培养箱中培养24 h,观察细胞贴壁后,加入450 nmol/L K252a设为K252a干预组,同时设空白对照组;培养48 h后,经胰酶消化,收集细胞后经磷酸盐缓冲液冲洗,离心后弃上清,经Annexin V-FITC染液避光染色10 min,随后加入PI染液避光染色5 min;经流式细胞仪检测并输出数据。实验重复3次。
1.2.6蛋白免疫印迹法(Western blot)检测TrkB、VEGF蛋白表达 各组细胞使用含有PMSF的RIPA裂解液进行裂解,12 000 r/min离心15 min,取上清液,经Western-blot检测各组TrkB、VEGF蛋白表达量;经过制胶、样品处理及加样、蛋白电泳、转膜、丽春红染色、封闭、抗体孵育、曝光显影等操作流程后,应用 Image-I成像系统进行灰度值分析;实验重复3次。
1.3 统计学分析

2 结果
2.1 K252a对前列腺癌细胞增值抑制率的影响
由表1中的数据可见,在各浓度K252a的作用下,伴随作用时间的延长,前列腺癌PC3细胞的增殖抑制率呈整体上升趋势,均高于空白组(P<0.05)。进一步分析发现,在450 nmol/L K252a的条件下,作用时间48 h的PC3细胞的增殖抑制率最高。可见,K252a对前列腺癌PC3细胞具有显著的抑制作用。

表1 各组前列腺癌PC3细胞增殖抑制率Tab.1 Inhibitory rate of K252a on PC3 cell proliferation in each
2.2 K252a对前列腺癌PC3细胞迁移的影响
表2中的统计数据显示,K252a干预组在24 h的迁移细胞数目低于空白对照组(P<0.05),提示K252a对前列腺癌PC3细胞的运动迁移能力具有抑制作用。
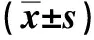
表2 各组前列腺癌PC3细胞迁移数目Tab.2 Effect of K252a on the migratory number of PC3 cells in each
2.3 K252a对前列腺癌PC3细胞细胞周期与凋亡的影响
由表3可见,经过K252a干预后,前列腺癌PC3细胞的周期分布与空白对照组比较,K252a干预组的G1期细胞比率高于空白对照组(P<0.05),S期细胞比率低于空白对照组(P<0.05);2组G2期、M期细胞比率比较,差异无统计学意义(P>0.05)。K252a干预组的前列腺癌PC3细胞的凋亡率为(24.32±4.66)%,空白对照组的前列腺癌PC3细胞的凋亡率为(4.54±1.01)%,K252a干预组的细胞凋亡率高于空白对照组(t=7.185,P=0.002)。提示K252a可抑制细胞内DNA的合成,促进前列腺癌PC3细胞凋亡。

表3 各组前列腺癌PC3细胞的细胞周期分布Tab.3 Effect of K252a on PC3 cell cycle in each
2.4 K252a对前列腺癌PC3细胞中TrkB、VEGF蛋白表达的影响
与空白对照组比较,K252a干预组前列腺癌PC3细胞中TrkB、VEGF蛋白相对表达量降低,差异具有统计学意义(P<0.05)。见表4、图1。
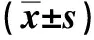
表4 各组前列腺癌PC3细胞中TrkB、VEGF蛋白相对表达量Tab.4 Relative protein expression levels of TrkB and VEGF in each
3 讨论
前列腺癌是好发于老年男性群体中的恶性肿瘤,随着人口老龄化的进程、生活环境和生活方式的改变,前列腺癌在中国的发病率有逐年升高的趋势[9-10]。迄今为止,前列腺癌细胞的远处转移是引起前列腺癌患者死亡的主要因素[11],因此,积极探索肿瘤细胞转移的机制及其影响因素,对于降低患者死亡率具有重要意义[12]。
有关新生血管形成机制的研究发现,肿瘤血管生成十分繁杂,一般涵盖血管基底膜降解,血管内皮细胞增殖和转移,血管腔生成及其外膜生成等环节[13]。当此类环节受到缺氧等因素的影响后,肿瘤组织内会释放出血管形成诱导因子与抑制因子,两种调控因子对肿瘤血管形成调节的失衡导致肿瘤血管生成。VEGF属于常见的肿瘤血管生成因子之一,其能够在促进内皮细胞增殖的同时增加血管的通透性,继而导致血管的生成[14]。TrkB是Trk的家族成员,其与相应的配体结合后,通过促发相应的信号传导通路实现对肿瘤细胞生长的正调控[15]。
现有研究表明,在肿瘤组织高表达TrkB的病例中,肿瘤细胞具备较强的肿瘤转移能力,肿瘤转移的风险较高[16-17]。祁麟等[18]的研究结论表明,结肠癌细胞SW620中靶向沉默TrkB基因后,肿瘤细胞的凋亡水平显著增加。王铸等[10]在研究中发现,靶向沉默TrkB基因可通过降低膀胱癌细胞相关信号转导通路活性从而降低肿瘤细胞增殖及转移的能力。因此,通过降低前列腺癌肿瘤细胞中TrkB的表达可能会显著抑制肿瘤细胞的转移和侵袭能力[19-22]。本研究K252a对前列腺癌细胞生长影响的研究结果显示,在450 nmol/L浓度K252a的条件下,作用时间为48 h的PC3细胞的增殖抑制率最高,从细胞水平提示了K252a对前列腺癌PC3细胞有显著抑制作用;本研究结果也提示,K252a对前列腺癌PC3细胞的运动迁移能力具有明显的抑制作用。以上结果可能跟抑制TrkB表达后,前列腺癌细胞的生长及迁移能力均明显降低有关。本研究还表明,当TrkB表达受抑制时,前列腺癌细胞在DNA合成前期(G1期)的合成增加,而在DNA合成期(S期)细胞数目明显降低,且细胞的凋亡率明显提升,说明K252a可能抑制了细胞内DNA的合成,进而促进前列腺癌PC3细胞凋亡。为了进一步探索TrkB-BDNF受体-配体复合物合成受抑制后影响前列腺癌细胞生物学行为的具体机制,本研究还进一步分析了K252a对前列腺癌PC3细胞中TrkB、VEGF蛋白表达的影响,结果与相关研究一致,TrkB的抑制剂阻断了TrkB-BDNF通路,约束了肿瘤组织中VEGF的合成[23-24],提示肿瘤新生血管的形成将受到显著抑制进而发生肿瘤血管生成缓慢的现象[25],TrkB可能与前列腺癌血管生成之间有着密切关系[26]。
综上所述,本次研究通过探讨TrkB抑制剂对前列腺癌细胞生物学效应的影响以及对VEGF表达的影响,分析TrkB、VEGF参与前列腺癌发生发展的可能机制,初步证实了降低TrkB的表达能够促进前列腺癌细胞凋亡、抑制细胞增殖和转移的能力,并从不同的角度分析TrkB通过上调VEGF提高肿瘤组织内血管密度、促进新生血管形成的作用,为前列腺癌抗血管生成的靶向治疗提供了客观依据。

